






还剩22页未读,
继续阅读
沪教版初中九年级化学上册第4章认识化学反应第3节第2课时依据化学方程式的计算课件
展开
这是一份沪教版初中九年级化学上册第4章认识化学反应第3节第2课时依据化学方程式的计算课件,共30页。
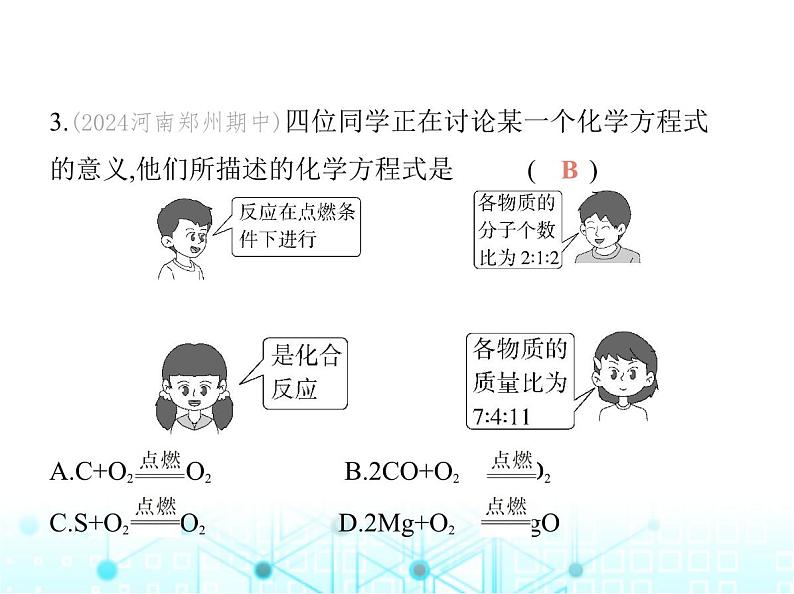
第4章 认识化学反应第3节 化学方程式的书写及应用第2课时 依据化学方程式的计算知识点3 化学方程式的意义1.(2023河北邯郸二十三中期中)化学方程式是化学反应简明 的表达形式,它从“质”和“量”两个方面表达了化学反应 的意义,根据化学方程式不能获得的信息是 ( )A.化学反应的快慢B.化学反应发生的条件C.化学反应的反应物和生成物D.反应物和生成物的质量关系A解析 根据化学方程式无法得知化学反应的快慢,故选A。2.(学科素养·科学思维)(2023安徽淮南月考)从化学方程式:2H2+O2 2H2O中获取的信息错误的是 ( )A.在化学反应前后,原子的种类没有改变B.氢气与氧气在点燃的条件下反应生成水C.4 g氢气与4 g氧气充分反应,生成8 g水D.反应中三种物质的分子数之比是2∶1∶2C解析 根据2H2+O2 2H2O,可知每4份质量的氢气和32份质量的氧气在点燃的条件下完全反应生成36份质量的水,则 4 g氢气与4 g氧气充分反应生成水的质量小于8 g,C错误。归纳总结 化学方程式提供的信息(1)反应物、生成物和反应条件;(2)反应物、生成物之间的粒子个数比;(3)反应物、生成物之间的质量比。3.(2024河南郑州期中)四位同学正在讨论某一个化学方程式 的意义,他们所描述的化学方程式是 ( ) A.C+O2 CO2 B.2CO+O2 2CO2C.S+O2 SO2 D.2Mg+O2 2MgOB解析 B中反应的反应条件是点燃;各物质的分子个数比为 2∶1∶2;反应符合“多变一”的特征,属于化合反应;各物质 的质量比为(28×2)∶32∶(44×2)=7∶4∶11。知识点4 利用化学方程式的简单计算4.(学科素养·科学态度与责任)(2023福建中考)为求证“喝反 复烧开的饮用水会造成亚硝酸盐中毒”的真伪,学习小组以 煮沸52次的桶装水为水样,利用下述反应测定亚硝酸盐的含 量(以NaNO2计):2NaNO2+2KI+2H2SO4 2NO↑+I2+2H2O+K2SO4+Na2SO4。结果表明,1 L水样反应时产生了5.08×10-3 mg的I2。(1)计算1 L水样中NaNO2的质量。解:设1 L水样中NaNO2的质量为x。2NaNO2+2KI+2H2SO4 2NO↑+I2+2H2O+K2SO4+Na2SO4138 254x 5.08×10-3 mg = x=2.76×10-3 mg答:1 L水样中NaNO2的质量为2.76×10-3 mg。(2)查阅《食品安全国家标准(GB 2762-2022)》,经换算,合格 饮用水中NaNO2的含量应低于7.50×10-3 mg·L-1。结合计算结果,得出的结论是:喝反复烧开的饮用水 (填“会” 或“不会”)造成亚硝酸盐中毒。不会解析 (1)根据化学方程式,由I2的质量计算NaNO2的质量。 (2)由(1)可知,1 L水样中NaNO2的质量为2.76×10-3mg<7.50×10-3 mg,则喝反复烧开的饮用水不会造成亚硝酸盐中毒。5.(2023黑龙江绥化中考,8,★★☆)在化学反应A+2B C+2D中,已知C和D的相对分子质量之比是22∶9,当6.4 g B与足 量A完全反应后,生成3.6 g D。则在此反应中,B和C的质量比 是 ( )A.8∶11 B.2∶11 C.16∶11 D.16∶9C解析 设生成C的质量为x,C的相对分子质量为22a。A+2B C + 2D 22a 2×9a x 3.6 g = x=4.4 g则生成C的质量为4.4 g,所以在此反应中B和C的质量比是6.4 g∶4.4 g=16∶11。6.(守恒法)(2022江苏常州中考,20,★★★)某阻燃剂主要成分 为碱式碳酸镁[Mga(OH)2(CO3)b],遇热分解生成三种氧化物。 称取一定质量阻燃剂样品,充分灼烧(其他成分未发生反应), 将产生的气体依次通过浓硫酸和过量澄清石灰水,浓硫酸增 重0.18 g,澄清石灰水中生成4 g白色沉淀(已知:浓硫酸能吸收 水蒸气,澄清石灰水中的氢氧化钙与二氧化碳反应生成碳酸 钙沉淀和水)。则Mga(OH)2(CO3)b中a值为 ( )A.6 B.5 C.4 D.3B解析 根据质量守恒定律,化学反应前后元素的种类和质量 不变,生成的水中氢元素全部来自样品中的氢氧根,根据氢元 素守恒,设氢氧根的质量为x,则有 H2O ~ 2OH- 18 34 0.18 g x = 解得x=0.34 g。生成的碳酸钙沉淀中碳元素全部来自样品中的碳酸根,根据碳元素守恒,设碳酸根的质量为y,则有CaCO3~C 100 60 4 g y = 解得y=2.4 g。在碱式碳酸镁中氢氧根离子与碳酸根离子质 量比为(17×2)∶(60×b)=0.34 g∶2.4 g,解得b=4。根据化合物 中各元素正、负化合价的代数和为0,可得(+2)×a+(-1)×2+(-2)×4=0,所以a=5。7.(2023山西中考节选,28,★★☆)“侯氏制碱法”是我国著 名制碱专家侯德榜经过多年研究做出的杰出贡献,其最大的 优点是降低了成本,大大提高了NaCl的利用率。(1)“侯氏制碱法”的原理可表示为:X+NaCl+NaHCO3 NH4Cl+Na2CO3,X的化学式是 。(2)用58.5 t NaCl(其利用率在96%以上)制碱,至少能生成Na2 CO3的质量是多少?NH3解:设至少能生成Na2CO3的质量为x。NH3+NaCl+NaHCO3 NH4Cl+Na2CO3 58.5 106 58.5 t×96% x = x=101.76 t答:至少能生成Na2CO3的质量为101.76 t。解析 (1)由质量守恒定律可知,反应前后各原子的种类和数 目不变,故X的化学式为NH3。(2)将参加反应的氯化钠的质 量代入化学方程式即可求得生成碳酸钠的质量。8.(2024陕西宝鸡期末,18,★★☆)化学兴趣小组为测定某大 理石样品中碳酸钙的质量分数,进行如下实验:取12.0 g样品 置于烧杯中,向其中逐渐加入稀盐酸(样品中杂质不与稀盐酸 反应)。测得生成气体的质量与加入稀盐酸的质量关系如图 所示,请回答下列问题:(1)样品充分反应后,产生气体的质量为 g;(2)计算该大理石样品中碳酸钙的质量分数。(写出计算过 程,结果保留到0.1%)4.4解:设该大理石样品中碳酸钙的质量为x。CaCO3+2HCl CaCl2+H2O+CO2↑100 44x 4.4 g = x=10 g则大理石样品中碳酸钙的质量分数为 ×100%≈83. 3%答:该大理石样品中碳酸钙的质量分数为83.3%。解析 (1)由图可知,样品充分反应后,产生气体的质量为4.4 g。(2)将产生的二氧化碳气体的质量代入化学方程式可求 得碳酸钙的质量,从而求得该大理石样品中碳酸钙的质量分 数。9.(2023河北青龙月考,28,★★☆)小高同学为了测定某生铁 中含铁量,做了如下实验,称取5.7 g样品,放入质量为50.0 g的 烧杯中,再向烧杯中加入50.0 g稀硫酸(杂质既不与稀硫酸反 应,也不溶于水,铁与硫酸反应的化学方程式为Fe+H2SO4 FeSO4+H2↑)。实验过程中进行了四次称量,记录数据如下:请计算:(1)反应产生氢气的总质量为 g。(2)该生铁中铁的质量分数(结果保留到0.1%,写出计算过 程)。0.2解:设该生铁中铁的质量为x。Fe+H2SO4 FeSO4+H2↑56 2x 0.2 g = x=5.6 g则该生铁中铁的质量分数为 ×100%≈98.2%。答:该生铁中铁的质量分数为98.2%。解析 (1)加入稀硫酸后,生铁中的铁和稀硫酸反应产生氢 气,根据质量守恒定律,生成氢气的总质量为5.7 g+50.0 g+50.0 g-105.5 g=0.2 g。(2)将氢气的质量代入化学方程式可以求 出铁的质量,从而可以计算出该生铁中铁的质量分数。10.(学科素养·科学思维)(2023江苏宿迁中考改编)我们的祖 先很早就掌握了炼铜的工艺,他们将孔雀石[主要成分是Cu2(OH)2CO3]和木炭一起加热就可得到红色的铜。兴趣小组为测定某孔雀石中Cu2(OH)2CO3的质量分数,进行如下实验:称 取25 g孔雀石样品,粉碎后放入烧杯,向其中加入200 g稀硫酸 (稀硫酸过量),充分反应后称量,烧杯内物质的总质量为220.6g[假设杂质都不与稀硫酸发生反应,反应的化学方程式为Cu2(OH)2CO3+2H2SO4 2CuSO4+CO2↑+3H2O]。(1)生成气体的质量是 g。4.4(2)求该孔雀石中Cu2(OH)2CO3的质量分数(写出计算过程)。解析 (1)根据质量守恒定律,生成二氧化碳气体的质量是25 g+200 g-220.6 g=4.4 g。(2)将二氧化碳的质量代入化学方程式中计算出Cu2(OH)2CO3的质量,从而求得该孔雀石中Cu2(OH)2CO3的质量分数。
第4章 认识化学反应第3节 化学方程式的书写及应用第2课时 依据化学方程式的计算知识点3 化学方程式的意义1.(2023河北邯郸二十三中期中)化学方程式是化学反应简明 的表达形式,它从“质”和“量”两个方面表达了化学反应 的意义,根据化学方程式不能获得的信息是 ( )A.化学反应的快慢B.化学反应发生的条件C.化学反应的反应物和生成物D.反应物和生成物的质量关系A解析 根据化学方程式无法得知化学反应的快慢,故选A。2.(学科素养·科学思维)(2023安徽淮南月考)从化学方程式:2H2+O2 2H2O中获取的信息错误的是 ( )A.在化学反应前后,原子的种类没有改变B.氢气与氧气在点燃的条件下反应生成水C.4 g氢气与4 g氧气充分反应,生成8 g水D.反应中三种物质的分子数之比是2∶1∶2C解析 根据2H2+O2 2H2O,可知每4份质量的氢气和32份质量的氧气在点燃的条件下完全反应生成36份质量的水,则 4 g氢气与4 g氧气充分反应生成水的质量小于8 g,C错误。归纳总结 化学方程式提供的信息(1)反应物、生成物和反应条件;(2)反应物、生成物之间的粒子个数比;(3)反应物、生成物之间的质量比。3.(2024河南郑州期中)四位同学正在讨论某一个化学方程式 的意义,他们所描述的化学方程式是 ( ) A.C+O2 CO2 B.2CO+O2 2CO2C.S+O2 SO2 D.2Mg+O2 2MgOB解析 B中反应的反应条件是点燃;各物质的分子个数比为 2∶1∶2;反应符合“多变一”的特征,属于化合反应;各物质 的质量比为(28×2)∶32∶(44×2)=7∶4∶11。知识点4 利用化学方程式的简单计算4.(学科素养·科学态度与责任)(2023福建中考)为求证“喝反 复烧开的饮用水会造成亚硝酸盐中毒”的真伪,学习小组以 煮沸52次的桶装水为水样,利用下述反应测定亚硝酸盐的含 量(以NaNO2计):2NaNO2+2KI+2H2SO4 2NO↑+I2+2H2O+K2SO4+Na2SO4。结果表明,1 L水样反应时产生了5.08×10-3 mg的I2。(1)计算1 L水样中NaNO2的质量。解:设1 L水样中NaNO2的质量为x。2NaNO2+2KI+2H2SO4 2NO↑+I2+2H2O+K2SO4+Na2SO4138 254x 5.08×10-3 mg = x=2.76×10-3 mg答:1 L水样中NaNO2的质量为2.76×10-3 mg。(2)查阅《食品安全国家标准(GB 2762-2022)》,经换算,合格 饮用水中NaNO2的含量应低于7.50×10-3 mg·L-1。结合计算结果,得出的结论是:喝反复烧开的饮用水 (填“会” 或“不会”)造成亚硝酸盐中毒。不会解析 (1)根据化学方程式,由I2的质量计算NaNO2的质量。 (2)由(1)可知,1 L水样中NaNO2的质量为2.76×10-3mg<7.50×10-3 mg,则喝反复烧开的饮用水不会造成亚硝酸盐中毒。5.(2023黑龙江绥化中考,8,★★☆)在化学反应A+2B C+2D中,已知C和D的相对分子质量之比是22∶9,当6.4 g B与足 量A完全反应后,生成3.6 g D。则在此反应中,B和C的质量比 是 ( )A.8∶11 B.2∶11 C.16∶11 D.16∶9C解析 设生成C的质量为x,C的相对分子质量为22a。A+2B C + 2D 22a 2×9a x 3.6 g = x=4.4 g则生成C的质量为4.4 g,所以在此反应中B和C的质量比是6.4 g∶4.4 g=16∶11。6.(守恒法)(2022江苏常州中考,20,★★★)某阻燃剂主要成分 为碱式碳酸镁[Mga(OH)2(CO3)b],遇热分解生成三种氧化物。 称取一定质量阻燃剂样品,充分灼烧(其他成分未发生反应), 将产生的气体依次通过浓硫酸和过量澄清石灰水,浓硫酸增 重0.18 g,澄清石灰水中生成4 g白色沉淀(已知:浓硫酸能吸收 水蒸气,澄清石灰水中的氢氧化钙与二氧化碳反应生成碳酸 钙沉淀和水)。则Mga(OH)2(CO3)b中a值为 ( )A.6 B.5 C.4 D.3B解析 根据质量守恒定律,化学反应前后元素的种类和质量 不变,生成的水中氢元素全部来自样品中的氢氧根,根据氢元 素守恒,设氢氧根的质量为x,则有 H2O ~ 2OH- 18 34 0.18 g x = 解得x=0.34 g。生成的碳酸钙沉淀中碳元素全部来自样品中的碳酸根,根据碳元素守恒,设碳酸根的质量为y,则有CaCO3~C 100 60 4 g y = 解得y=2.4 g。在碱式碳酸镁中氢氧根离子与碳酸根离子质 量比为(17×2)∶(60×b)=0.34 g∶2.4 g,解得b=4。根据化合物 中各元素正、负化合价的代数和为0,可得(+2)×a+(-1)×2+(-2)×4=0,所以a=5。7.(2023山西中考节选,28,★★☆)“侯氏制碱法”是我国著 名制碱专家侯德榜经过多年研究做出的杰出贡献,其最大的 优点是降低了成本,大大提高了NaCl的利用率。(1)“侯氏制碱法”的原理可表示为:X+NaCl+NaHCO3 NH4Cl+Na2CO3,X的化学式是 。(2)用58.5 t NaCl(其利用率在96%以上)制碱,至少能生成Na2 CO3的质量是多少?NH3解:设至少能生成Na2CO3的质量为x。NH3+NaCl+NaHCO3 NH4Cl+Na2CO3 58.5 106 58.5 t×96% x = x=101.76 t答:至少能生成Na2CO3的质量为101.76 t。解析 (1)由质量守恒定律可知,反应前后各原子的种类和数 目不变,故X的化学式为NH3。(2)将参加反应的氯化钠的质 量代入化学方程式即可求得生成碳酸钠的质量。8.(2024陕西宝鸡期末,18,★★☆)化学兴趣小组为测定某大 理石样品中碳酸钙的质量分数,进行如下实验:取12.0 g样品 置于烧杯中,向其中逐渐加入稀盐酸(样品中杂质不与稀盐酸 反应)。测得生成气体的质量与加入稀盐酸的质量关系如图 所示,请回答下列问题:(1)样品充分反应后,产生气体的质量为 g;(2)计算该大理石样品中碳酸钙的质量分数。(写出计算过 程,结果保留到0.1%)4.4解:设该大理石样品中碳酸钙的质量为x。CaCO3+2HCl CaCl2+H2O+CO2↑100 44x 4.4 g = x=10 g则大理石样品中碳酸钙的质量分数为 ×100%≈83. 3%答:该大理石样品中碳酸钙的质量分数为83.3%。解析 (1)由图可知,样品充分反应后,产生气体的质量为4.4 g。(2)将产生的二氧化碳气体的质量代入化学方程式可求 得碳酸钙的质量,从而求得该大理石样品中碳酸钙的质量分 数。9.(2023河北青龙月考,28,★★☆)小高同学为了测定某生铁 中含铁量,做了如下实验,称取5.7 g样品,放入质量为50.0 g的 烧杯中,再向烧杯中加入50.0 g稀硫酸(杂质既不与稀硫酸反 应,也不溶于水,铁与硫酸反应的化学方程式为Fe+H2SO4 FeSO4+H2↑)。实验过程中进行了四次称量,记录数据如下:请计算:(1)反应产生氢气的总质量为 g。(2)该生铁中铁的质量分数(结果保留到0.1%,写出计算过 程)。0.2解:设该生铁中铁的质量为x。Fe+H2SO4 FeSO4+H2↑56 2x 0.2 g = x=5.6 g则该生铁中铁的质量分数为 ×100%≈98.2%。答:该生铁中铁的质量分数为98.2%。解析 (1)加入稀硫酸后,生铁中的铁和稀硫酸反应产生氢 气,根据质量守恒定律,生成氢气的总质量为5.7 g+50.0 g+50.0 g-105.5 g=0.2 g。(2)将氢气的质量代入化学方程式可以求 出铁的质量,从而可以计算出该生铁中铁的质量分数。10.(学科素养·科学思维)(2023江苏宿迁中考改编)我们的祖 先很早就掌握了炼铜的工艺,他们将孔雀石[主要成分是Cu2(OH)2CO3]和木炭一起加热就可得到红色的铜。兴趣小组为测定某孔雀石中Cu2(OH)2CO3的质量分数,进行如下实验:称 取25 g孔雀石样品,粉碎后放入烧杯,向其中加入200 g稀硫酸 (稀硫酸过量),充分反应后称量,烧杯内物质的总质量为220.6g[假设杂质都不与稀硫酸发生反应,反应的化学方程式为Cu2(OH)2CO3+2H2SO4 2CuSO4+CO2↑+3H2O]。(1)生成气体的质量是 g。4.4(2)求该孔雀石中Cu2(OH)2CO3的质量分数(写出计算过程)。解析 (1)根据质量守恒定律,生成二氧化碳气体的质量是25 g+200 g-220.6 g=4.4 g。(2)将二氧化碳的质量代入化学方程式中计算出Cu2(OH)2CO3的质量,从而求得该孔雀石中Cu2(OH)2CO3的质量分数。
相关资料
更多









