




2024长沙中考化学一轮复习 第十单元 酸和碱 (课件)
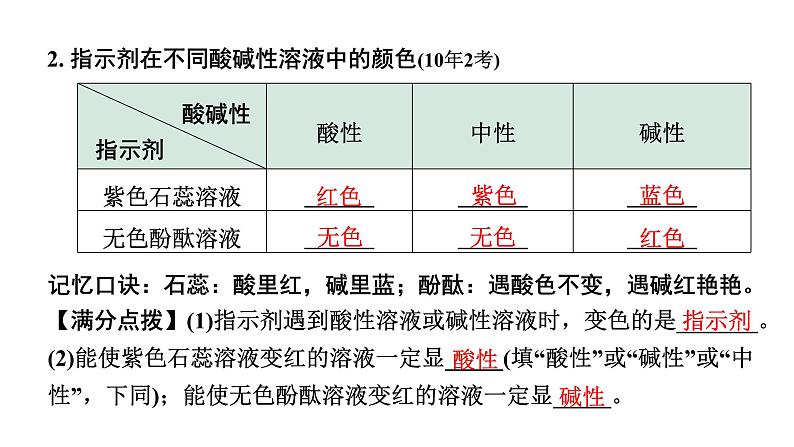
展开1. 指示剂:能跟酸或碱溶液起作用显示不同颜色的物质,叫做酸碱指示剂,简称指示剂。常用的指示剂有紫色______溶液和无色______溶液。
命题点1 溶液的酸碱性及pH(10年7考)
记忆口诀:石蕊:酸里红,碱里蓝;酚酞:遇酸色不变,遇碱红艳艳。【满分点拨】(1)指示剂遇到酸性溶液或碱性溶液时,变色的是_______。(2)能使紫色石蕊溶液变红的溶液一定显_____(填“酸性”或“碱性”或“中性”,下同);能使无色酚酞溶液变红的溶液一定显_____。
2. 指示剂在不同酸碱性溶液中的颜色(10年2考)
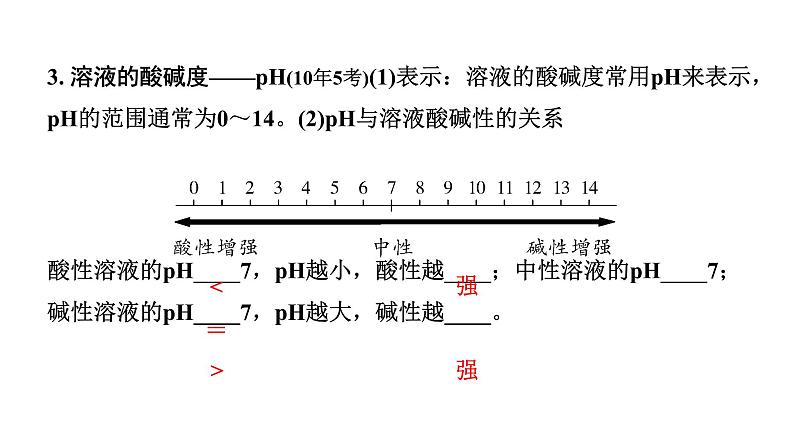
3. 溶液的酸碱度——pH(10年5考)(1)表示:溶液的酸碱度常用pH来表示,pH的范围通常为0~14。(2)pH与溶液酸碱性的关系酸性溶液的pH____7,pH越小,酸性越____;中性溶液的pH____7;碱性溶液的pH____7,pH越大,碱性越____。
4. 测定溶液pH的方法(详见第一单元命题点3)(2019.13A)5. 溶液酸碱性的应用(1)了解空气污染情况,测定雨水的pH(pH<_____的降雨为酸雨)。(2)了解身体的健康状况,测定人体内或排出的液体的pH。(3)测定土壤的酸碱性,提供土壤改良的依据。
1. (2021长沙11题3分)据报道,某经营宾馆的不法商人用氢氧化钠溶液浸泡、洗涤床单和被套,导致它们显碱性,引起顾客皮肤不适。氢氧化钠溶液的pH可能是( )A. 3 B. 7 C. 13 D. 5
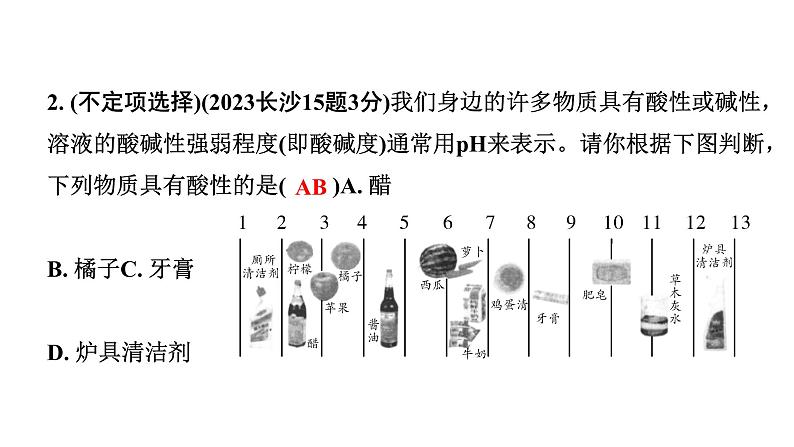
2. (不定项选择)(2023长沙15题3分)我们身边的许多物质具有酸性或碱性,溶液的酸碱性强弱程度(即酸碱度)通常用pH来表示。请你根据下图判断,下列物质具有酸性的是( )A. 醋 B. 橘子C. 牙膏 D. 炉具清洁剂
3. 据长沙晚报报道:中央第六环保督察组向长沙市转办的群众信访举报件中,其中有一封有关某洗涤厂违规排放废水污染河流的举报信,当地环保部门高度重视,立即派工作人员实地检测,测得污水的pH>7,请你分析并回答:(1)工厂排出的废水显____性(填“酸”“碱”或“中”)。(2)为了长沙的青山绿水,请你提一条合理的建议__________________________。
工业废水处理达标后再排放
4. (2023天津改编)下列为一些常见食物的近似pH,胃酸过多的人空腹时最适宜吃的食物是( )A. 苹果:2.9~3.3 B. 柠檬:2.0~3.0C. 葡萄:3.5~4.5 D. 玉米粥:6.8~8.0
5. (2022贺州)学校兴趣小组同学在家做实验,用自制黄色的花汁分别滴入不同液体中,现象记录如下表。下列说法错误的是( )A. 该花汁可作酸碱指示剂B. 该花汁滴入碳酸氢钠溶液中变黄色C. 常温下该花汁的pH可能是7D. 该花汁滴入稀盐酸中变红色
写出图中涉及的化学方程式①_________________________、___________________________②___________________________、________________________________③____________________________________、______________________________________
Zn+2HCl=== ZnCl2+H2↑
Zn+H2SO4 === ZnSO4+H2↑
NaOH+HCl=== NaCl+H2O
2NaOH+H2SO4=== Na2SO4+2H2O
Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
Na2CO3+H2SO4=== Na2SO4+H2O+CO2↑
命题点2 酸的性质及用途(10年3考)
④______________________________、__________________________________⑤________________________________⑥______________________________
Fe2O3+6HCl=== 2FeCl3+3H2O
Fe2O3+3H2SO4=== Fe2(SO4)3+3H2O
BaCl2+H2SO4=== BaSO4↓+2HCl
AgNO3+HCl=== AgCl↓+HNO3
1. 酸的定义:解离时产生的阳离子全部是_______的化合物。2. 浓盐酸和浓硫酸的物理性质及用途(10年3考)
3. 其他常见的酸:碳酸(不稳定,易分解,其分解的化学方程式为____________________)、硝酸、醋酸(常用作调味品)。4. 酸的化学性质(10年7考)(1)与酸碱指示剂作用:酸能使紫色石蕊溶液变____色,使无色酚酞溶液_____色。(2)与活泼金属反应①通式:酸+活泼金属→盐+氢气②举例:铁与稀盐酸反应:________________________(写化学方程式,下同),现象:_________________________________________。
H2CO3=== H2O+CO2↑
Fe+2HCl=== FeCl2+H2↑
固体溶解,产生气泡,溶液由无色变为浅绿色
锌与稀硫酸反应:_________________________。(3)与金属氧化物反应①通式:酸+金属氧化物→盐+水②举例:氧化铁与稀盐酸反应:______________________________,现象:______________________________。氧化铜与稀硫酸反应:_____________________________,现象:_____________________________。
Zn+H2SO4=== ZnSO4+H2↑
固体溶解,溶液由无色变为黄色
CuO+H2SO4=== CuSO4+H2O
固体溶解,溶液由无色变为蓝色
(4)与碱反应①通式:酸+碱→盐+水②举例:氢氧化钠与稀盐酸反应:___________________________;氢氧化钙与稀硫酸反应:_________________________________。
HCl+NaOH=== NaCl+H2O
H2SO4+Ca(OH)2=== CaSO4+2H2O
(5)与盐反应①通式:酸+盐→新酸+新盐②举例:碳酸钠与稀盐酸反应:__________________________________;碳酸钙与稀盐酸反应:__________________________________;碳酸氢钠与稀盐酸反应:___________________________________。【总结】酸具有相似化学性质的原因是_______________。
CaCO3+2HCl=== CaCl2+H2O+CO2↑
NaHCO3+HCl=== NaCl+H2O+CO2↑
1. (2019长沙12题3分)下列关于酸的说法错误的是( )A. 浓硫酸具有吸水性,浓盐酸具有挥发性B. 稀盐酸和稀硫酸都可用于金属除锈C. 稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色D. 稀硫酸能够与活泼金属反应制取氢气
2. (2022长沙改编)下列说法中错误的是( )A. 用pH试纸测得醋酸溶液的pH为9B. 浓盐酸敞口放置一段时间溶质质量分数减小C. 用熟石灰改良酸性土壤D. 浓硫酸有吸水性,可用作干燥剂
3. (2022长沙13题3分)下列有关酸和碱的说法错误的是( )A. 用稀盐酸能鉴别氯化钠与碳酸钠B. 锌和稀硫酸反应生成硫酸锌和氢气C. 食盐可以用来改良酸性土壤D. 常温下测得某溶液的pH=0,则该溶液一定显酸性
4. (长沙真题组合)判断下列实验现象的正误(对的打“√”,错的打“×”)。(1)打开盛有浓盐酸的试剂瓶瓶盖,瓶口有白烟产生(2022.11A)( )(2)向氧化铁中加入足量稀硫酸,红棕色固体溶解,溶液由无色变成浅绿色(2022.11B)( )
5. (2023长沙23题节选)为加深对酸的主要性质的认识,通过实验解释生活中的一些现象。在学完酸的化学性质后,老师组织同学们完成了以下实验活动。【实验内容与分析】实验一: 按如图所示完成实验。实验二: 往生锈的铁钉中加入足量的稀盐酸。实验三: 往滴有酚酞的氢氧化钠溶液中加入一定量的稀盐酸。实验四: 往5.3克Na2CO3粉末中加入足量的稀盐酸。(1)实验一中,观察到石蕊溶液变____色。
(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因_________________________________________________。(3)实验三中,观察到溶液由红色变成无色,由此现象分析,反应后所得溶液中,溶质成分的可能组合有(不考虑酚酞)__________________(用化学式表示)。
盐酸先与铁锈反应生成氯化铁,后再与铁反应产生氢气
NaCl;NaCl和HCl
(4)请计算,实验四中理论上可以生成二氧化碳的质量为____克(可能用到的相对原子质量: H-1 C-12 O-16 Na-23 Cl-35.5)。【应用与拓展】(5)结合以上实验内容,请设计实验方案除去铜粉中混有的氧化铜,得到纯净的铜:___________________________________________________________________。
取混合物于烧杯中,加入足量稀盐酸,充分反应后过滤,将滤渣洗涤,干燥
6. (2022株洲)下列物质间不能发生反应的是( )A. 稀盐酸和镁条B. 稀盐酸和铜丝C. 稀盐酸和氢氧化镁D. 稀盐酸和氢氧化铜
7. (2023广西北部湾)下列有关硫酸的认识或做法正确的是( )A. 组成:硫酸溶液中H+和 的数目相同B. 性质:能与CO2、SO2等非金属氧化物反应C. 用途:用于生产化肥、农药、火药、染料等D. 生产:含硫酸的工业废水,用CaCl2处理后直接排放
8. (2023潍坊)构建知识网络模型是化学学习中重要的学习方法。如图1是小明同学利用左手构建的酸的化学性质知识网络(其中A、B表示反应物,C表示生成物)。请完成下列问题:(1)如用湿润的pH试纸测定盐酸的pH,则结果会______(填 “偏大”“偏小”或“无影响”)。
(2)图1中①的现象是_________。(3)世界卫生组织推广使用中国铁锅,使用铁锅炒菜时,放点食醋可以补充人体中构成血红素的____(填“Fe2+”或“Fe3+”),该反应的原理是利用了酸的_____(填序号“②”“③”“④”或“⑤”)化学性质。
(4)小明用图2来说明稀硫酸与氢氧化钠溶液反应的过程,该过程不发生变化的微粒是__________(用符号表示),该反应的微观实质可表示为H++OH-=== H2O。依此类推当图1中③是向稀盐酸中滴加硝酸银溶液时,反应的微观实质用同样的方法可表示为____________________。
Ag++Cl-=== AgCl↓
(5)图1中⑤的性质可用于除铁锈,反应的化学方程式为______________________________。(6)盐酸、硫酸、食醋具有相似化学性质是因为它们的水溶液中都含有____(用符号表示)。
写出图中涉及的化学方程式①____________________________、________________________________
HCl+NaOH === NaCl+H2O
2HCl+Ca(OH)2=== CaCl2+2H2O
命题点3 碱的性质及用途 中和反应及其应用(10年3考)
②_____________________________________、_____________________________________③______________________________、_______________________________④_____________________________________
MgCl2+2NaOH=== Mg(OH)2↓+2NaCl
MgCl2+Ca(OH)2=== Mg(OH)2↓+CaCl2
CO2+2NaOH=== Na2CO3+H2O
CO2+Ca(OH)2=== CaCO3↓+H2O
Ca(OH)2+Na2CO3=== CaCO3↓+2NaOH
1. 碱的定义:解离时产生的阴离子全部是___________的化合物。2. 氢氧化钠和氢氧化钙的物理性质及用途(10年3考)
【备考补充】工业制取烧碱的化学方程式:____________________________________。氧化钙与水反应制取氢氧化钙的化学方程式:______________________。
Ca(OH)2+Na2CO3=== 2NaOH+CaCO3↓
CaO+H2O=== Ca(OH)2
3. 其他常见的碱氢氧化钾(KOH);氢氧化铜[Cu(OH)2](蓝色);氢氧化铁[Fe(OH)3](红褐色);氢氧化铝[Al(OH)3](白色,可用于治疗胃酸过多);氨水(NH3·H2O)等。4. 碱的化学性质(10年4考)(1)与酸碱指示剂作用:碱能使紫色石蕊溶液变___色,无色酚酞溶液变___色。(10年2考)
(2)与非金属氧化物反应[2019.45(2)]①通式:碱+非金属氧化物→盐+水②举例:氢氧化钠溶液与二氧化碳反应:_______________________________(写化学方程式,下同)。氢氧化钙溶液与二氧化碳反应:_______________________________。(3)与酸反应①通式:碱+酸→盐+水(中和反应)②举例:氢氧化钙与稀盐酸反应:_______________________________。
2NaOH+CO2=== Na2CO3+H2O
Ca(OH)2+CO2=== CaCO3↓+H2O
Ca(OH)2+2HCl=== CaCl2+2H2O
(4)与某些盐反应①通式:可溶性碱+可溶性盐→新碱+新盐②举例:氢氧化钠与硫酸铜溶液反应:______________________________________,现象:_____________。氢氧化钠与氯化铁溶液反应:__________________________________,现象:_______________。【总结】碱具有相似化学性质的原因是__________________。
2NaOH+CuSO4=== Cu(OH)2↓+Na2SO4
3NaOH+FeCl3=== Fe(OH)3↓+3NaCl
5. 中和反应(1)定义:酸和碱作用生成盐和水的反应。(2)中和反应的探究(详见微专题5)(3)应用:①改良土壤的酸碱性,如用________改良酸性土壤。(10年3考)②处理工厂废水,如用熟石灰处理酸性废水。③用于医药,如蚊虫叮咬后涂抹肥皂水;服用含碱性物质(如氢氧化铝)的药物来治疗_________。【满分点拨】中和反应一定有盐和水生成,但有盐和水生成的反应_______(填“一定”或“不一定”)是中和反应。
1. (长沙真题组合)判断下列实验现象的正误(对的打“√”,错的打“×”)。(1)向氯化铜溶液中加入几滴氢氧化钠溶液,产生蓝色沉淀(2022.11C) ( )(2)向氢氧化钙溶液中加入几滴紫色石蕊溶液,石蕊溶液由紫色变成红色(2022.11D)( )
2. [2023长沙23(6)题2分]小明在征得老师的同意后,继续进行了如下图所示实验。由上述实验可以得出氢氧化钙的哪些性质_________________________________________________。
①微溶于水;②能使酚酞溶液变红;③能与稀盐酸反应
3. (2023潍坊)下列溶液在空气中敞口久置,因发生化学变化导致溶液质量减小的是( )A. 浓盐酸 B. 浓硫酸C. 石灰水 D. 烧碱溶液
4. (2022郴州)下列关于Ca(OH)2的说法错误的是( )A. 微溶于水,水溶液呈碱性B. 能与酸反应,可用于治疗胃酸过多C. 与CuSO4溶液按一定比例混合, 可配制波尔多液D. 澄清溶液可用来检验CO2
5. (2023安徽)中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是( )A. 生石灰用于加热即热食品B. 氢氧化铝用于治疗胃酸过多C. 熟石灰用于改良酸性土壤D. 硼酸用于处理皮肤上沾有的碱
6. (2022成都)忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析与设计错误的是( )
7. (2022齐齐哈尔)A~F是初中化学常见的物质,它们之间的转化关系如图所示。图中“——”表示两种物质间能发生化学反应,“→”表示两种物质间的转化关系。已知A在农业上用来改良酸性土壤,B、E是两种组成元素相同的液体,C、F是两种组成元素相同的气体,(其中部分反应条件、反应物及生成物已略去)。请回答下列问题:(1)写出E物质的化学式_______。(2)写出A和C反应的化学方程式________________________________。(3)C生成F的反应______(选填“吸热”或“放热”)。
Ca(OH)2+CO2=== CaCO3↓+ H2O
8. (2023长春改编)某化学兴趣小组绘制碱的化学性质,设计实验如下:同学们选取四种碱来验证碱的化学性质,设计实验如下:
(1)实验一能够观察到的明显现象是溶液由无色变为____色。(2)实验二澄清石灰水变浑浊,验证了上述知识网络图中碱能够与________________反应;试管中的物质经过滤后得到0.05 g沉淀,则参加反应的二氧化碳的质量为_____g。(3)实验三发生反应的化学方程式为______________________________。
3HCl+Al(OH)3=== AlCl3+3H2O
(4)实验四产生白色沉淀,对反应后的物质进行过滤,并对滤液中溶质的成分产生了兴趣,经分析,滤液中一定有氢氧化钠,滤液一定____(选填“酸性”“中性”或“碱性”)。
2024长沙中考化学一轮复习 第十单元 酸和碱 (课件): 这是一份2024长沙中考化学一轮复习 第十单元 酸和碱 (课件),共50页。PPT课件主要包含了指示剂,酸碱性,氢离子,HCl,H2SO4,有刺激性气,溶液中都含有H+,溶液变红,Fe2+,氢氧根离子等内容,欢迎下载使用。
2024四川中考化学一轮复习 第十单元 酸和碱(课件): 这是一份2024四川中考化学一轮复习 第十单元 酸和碱(课件),共60页。PPT课件主要包含了置换反应,CuO,CuOH2,HCl,②④⑥⑨⑧⑪,紫色石蕊溶液,有气泡产生,H2O,CuO+,溶液由红色变成无色等内容,欢迎下载使用。
2024海南中考化学一轮复习 中考考点研究 第十单元 酸和碱(课件): 这是一份2024海南中考化学一轮复习 中考考点研究 第十单元 酸和碱(课件),共60页。PPT课件主要包含了海南近年真题及拓展,∶94,稀盐酸,无明显现象,氢氧化钠溶液,产生蓝色沉淀,答红色,酸和碱,思维导图,HCl等内容,欢迎下载使用。












