



高考化学一轮复习第9章水溶液中的离子反应与平衡第46讲水溶液中的离子平衡图像课件
展开
这是一份高考化学一轮复习第9章水溶液中的离子反应与平衡第46讲水溶液中的离子平衡图像课件,共45页。PPT课件主要包含了2点的变化等内容,欢迎下载使用。
1.进一步加深对电离平衡、水解平衡、沉淀溶解平衡的理解与应用。2.能根据图像中的关键点、变化趋势,计算Ka、Kb或Ksp,判断粒子浓度的大小关系。3.能利用沉淀溶解平衡原理,分析图像中粒子浓度的关系,进行有关Ksp的计算。
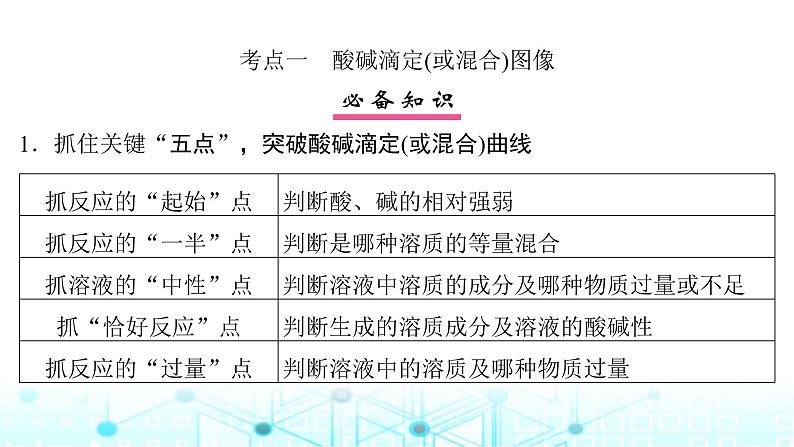
考点一 酸碱滴定(或混合)图像 1.抓住关键“五点”,突破酸碱滴定(或混合)曲线
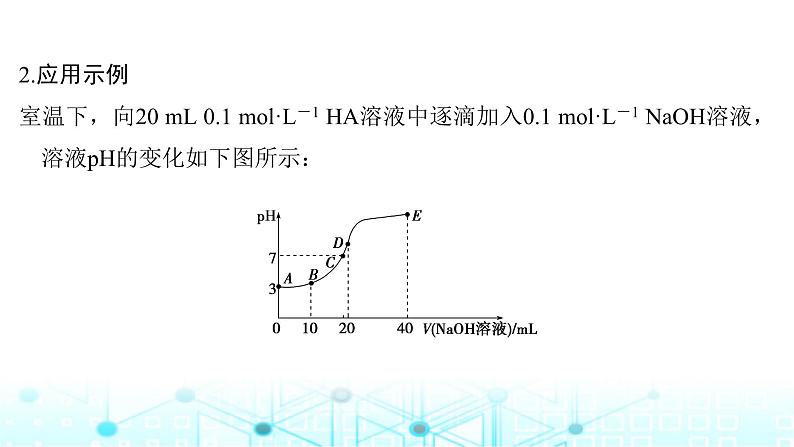
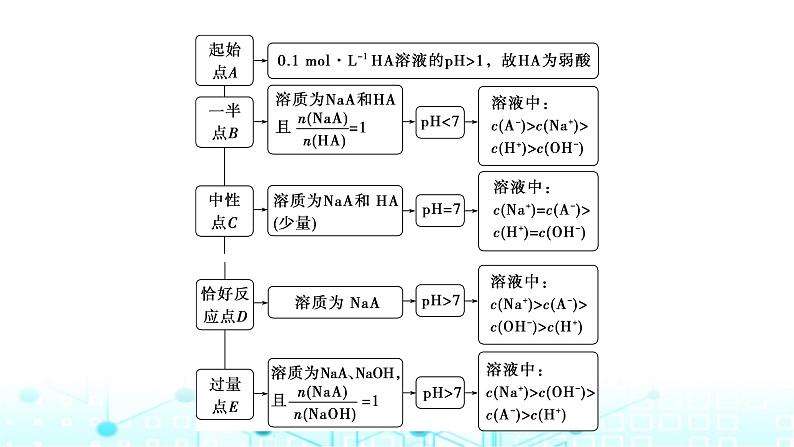
2.应用示例室温下,向20 mL 0.1 ml·L-1 HA溶液中逐滴加入0.1 ml·L-1 NaOH溶液,溶液pH的变化如下图所示:
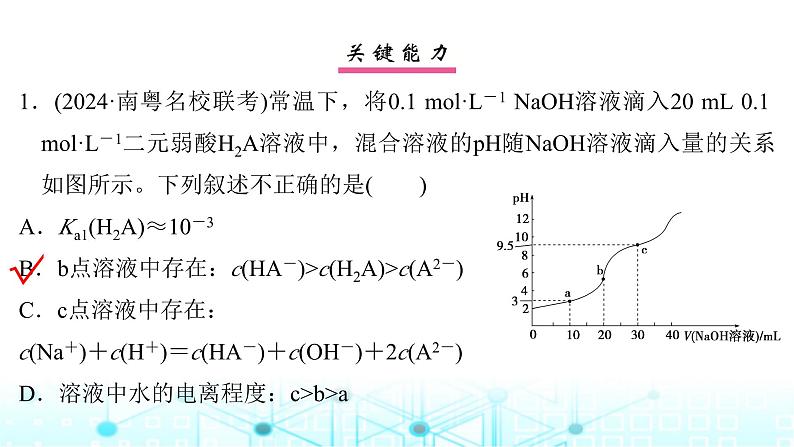
1.(2024·南粤名校联考)常温下,将0.1 ml·L-1 NaOH溶液滴入20 mL 0.1 ml·L-1二元弱酸H2A溶液中,混合溶液的pH随NaOH溶液滴入量的关系如图所示。下列叙述不正确的是( )A.Ka1(H2A)≈10-3B.b点溶液中存在:c(HA-)>c(H2A)>c(A2-)C.c点溶液中存在:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)D.溶液中水的电离程度:c>b>a
B.b点溶液中溶质为NaHA,溶液呈酸性,说明HA-的电离程度大于其水解程度,溶液中存在:c(HA-)>c(A2-)>c(H2A),B项错误;C.由电荷守恒可知,c点溶液中存在:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),C项正确;D.a点为H2A与NaHA的混合溶液,b点为NaHA溶液,c点为NaHA与Na2A的混合溶液,溶液中水的电离程度:c>b>a,D项正确。
2.常温下,用0.10 ml·L-1 NaOH溶液分别滴定 20.00 mL浓度均为0.10 ml·L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是( )A.点①和点②所示溶液中:c(CH3COO-)<c(CN-)B.点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)D.点②和点③所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
解析:A项,点①所示溶液中存在电荷守恒:c(OH-)+c(CN-)=c(Na+)+c(H+),且c(OH-)>c(H+),点②所示溶液中存在电荷守恒:c(OH-)+c(CH3COO-)=c(Na+)+c(H+),且c(OH-)<c(H+),两溶液中钠离子浓度相同,所以c(CH3COO-)>c(CN-),错误;B项,点③所示溶液pH=7,c(OH-)=c(H+),故c(Na+)=c(CH3COO-)>c(H+)=c(OH-),点④所示溶液中溶质为CH3COONa,溶液呈碱性,故c(Na+)>c(CH3COO-)>c(OH-)>c(H+),错误;
C项,点①所示溶液为等浓度的HCN和NaCN溶液,存在元素守恒:c(HCN)+c(CN-)=2c(Na+),点②所示溶液为等浓度的CH3COOH和CH3COONa溶液,存在元素守恒:c(CH3COOH)+c(CH3COO-)=2c(Na+),两溶液中钠离子浓度相同,故c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),正确;D项,点②和点③所示溶液中均存在电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),且c(Na+)>c(CH3COOH),故c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),错误。
考点二 分布系数图像 分布曲线指以pH为横坐标,分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线。
B.a、b、c三点溶液中微粒成分不同,溶液pOH不同,对水的电离影响程度不同,B错误;
下列叙述正确的是( )A.曲线①代表δ(H2A),曲线②代表δ(HA-)B.H2A溶液的浓度为 0.200 0 ml·L-1C.HA-的电离常数Ka=1.0×10-2D.滴定终点时,溶液中c(Na+)
相关课件
这是一份高考化学一轮复习第9章水溶液中的离子反应与平衡第43讲水的电离和溶液的pH课件,共46页。PPT课件主要包含了H2O⇌H++OH-,×10-14,稀的电解质溶液,玻璃棒,标准比色卡,答案10,答案1∶4,强氧化性,2滴定前准备,蒸馏水等内容,欢迎下载使用。
这是一份2025届高考化学一轮总复习第9章水溶液中的离子反应与平衡第46讲水溶液中的离子平衡图像课件,共45页。PPT课件主要包含了2点的变化等内容,欢迎下载使用。
这是一份2025届高考化学一轮总复习第9章水溶液中的离子反应与平衡第43讲水的电离和溶液的pH课件,共46页。PPT课件主要包含了H2O⇌H++OH-,×10-14,稀的电解质溶液,玻璃棒,标准比色卡,答案10,答案1∶4,强氧化性,2滴定前准备,蒸馏水等内容,欢迎下载使用。









