






还剩42页未读,
继续阅读
所属成套资源:全套鲁教版初中九年级化学上册单元素养综合检测课件
成套系列资料,整套一键下载
鲁教版初中九年级化学上册第五单元素养综合检测课件
展开
这是一份鲁教版初中九年级化学上册第五单元素养综合检测课件,共50页。
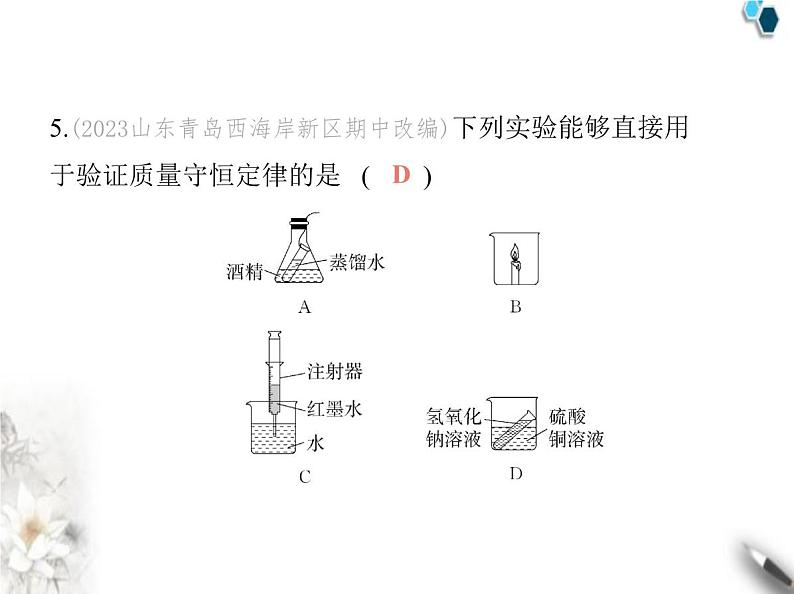
第五单元 素养综合检测(满分100分, 限时45分钟)C解析 化学反应前后原子的种类、数目不变,反应物中含有 4个氢原子、4个氮原子、12个氧原子,已知的生成物中含有 4个氢原子、4个氮原子、10个氧原子,所以X的化学式是O2。2.(2023四川德阳中江期末)铝在氧气中燃烧生成氧化铝,参加反应的铝、氧气与生成的氧化铝之间的质量比为 ( )A.27∶32∶102 B.108∶96∶204C.4∶3∶2 D.27∶32∶59B解析 在4Al+3O2 2Al2O3反应中,参加反应的铝、氧气与反应生成的氧化铝的质量比为108∶96∶204。3.(2023山东济南槐荫期中)(多选)下列关于2CO+O2 2CO2的说法中,不正确的是 ( )A.参加反应的一氧化碳与氧气的质量比为2∶1B.反应前后分子、原子的个数均保持不变C.表示一氧化碳加氧气等于二氧化碳D.表示一氧化碳与氧气在点燃的条件下反应生成二氧化碳ABC解析 参加反应的一氧化碳与氧气的质量比为(2×28)∶32= 7∶4;题中化学反应前后原子的个数不变,分子的个数减少; 在化学方程式中,“+”读作“和”,“ ”读作“生成”。4.(2024广西贵港覃塘期中改编)下列现象不能用质量守恒定 律解释的是 ( )A.石蜡熔化前后,其质量不变B.氢氧化钠溶液和硫酸铜溶液反应,反应前后物质的总质量 不变C.木材在空气中燃烧后化为灰烬,灰烬的质量比木材的质量小D.铜丝在空气中加热,生成物的质量比原来铜丝的质量大A解析 石蜡熔化属于物理变化,不能用质量守恒定律解释。5.(2023山东青岛西海岸新区期中改编)下列实验能够直接用 于验证质量守恒定律的是 ( ) D解析 酒精与蒸馏水混合属于物理变化,不能用质量守恒定 律解释;蜡烛燃烧有二氧化碳生成,二氧化碳会逸散到空气 中,不能直接用于验证质量守恒定律;红墨水与水混合属于物 理变化,不能用质量守恒定律解释。A解析 题中反应是一种化合物与一种单质在一定条件下反 应生成另一种化合物的反应,故选A。7.【模型法】(2023江苏宿迁中考)乙醇作为一种清洁能源, 已成为各国可再生能源的发展重点之一。如图为乙醇充分 燃烧的微观示意图,下列有关该反应的说法正确的是 ( )A.反应生成丙和丁的分子个数比是2∶3B.反应前后原子种类发生改变AC.反应前后各元素的化合价均没有变化D.该反应中共涉及三种氧化物解析 由反应的微观示意图可知,乙醇与氧气在点燃的条件 下反应生成二氧化碳和水,反应的化学方程式为C2H5OH+3O2 2CO2+3H2O。反应前后原子种类不发生改变;反应物中氧气是一种单质,氧气中氧元素的化合价为零,而生成物均为 氧化物,其中氧元素的化合价均为-2价,因此该反应前后一定 存在元素化合价的改变;该反应中涉及的氧化物有二氧化碳 和水。8.(2024四川达州宣汉期末)在反应A+3B 2C+3D中,已知23 g A和48 g B恰好完全反应,生成44 g C,又知D的相对分子 质量为18,则A的相对分子质量为 ( )A.96 B.23C.92 D.46D解析 由质量守恒定律可知,反应生成D的质量为23 g+48 g- 44 g=27 g。设A的相对分子质量为x。A+3B 2C+3Dx 3×1823 g 27 g = x=46。9.(2024山东济南平阴期中)(多选)氯气经常用于自来水消毒, 也可用于制造盐酸、漂白粉和漂粉精等。实验室通常用二 氧化锰固体和浓盐酸在加热的条件下制取氯气。反应的化 学方程式为MnO2+xHCl(浓) MnCl2+2H2O+Y↑。下列有关此反应的说法中,正确的是 ( )A.该反应涉及的氧化物有两种B.物质Y的化学式为Cl2C.MnO2是这个反应的催化剂D.x的数值是4ABD解析 化学反应前后原子的种类、数目不变,分析题中化学 方程式可知,反应后含有4个H原子,故x=4,故物质Y的化学式 为Cl2;该反应中二氧化锰和水属于氧化物;二氧化锰是该反 应的反应物。10.(2020广西梧州中考)一定条件下,在密闭容器中发生了某 反应,测得反应过程中各物质的质量如表:下列说法正确的是 ( )A.x的值一定等于30B.该反应是分解反应C.丙可能是该反应的催化剂D.反应后甲、乙的质量比为2∶1A解析 反应5分钟时,甲的质量增加了6 g,乙的质量减少了4g,则参加反应的甲、乙的质量比为3∶2,则(28-10)∶(19-z)=3∶2,z=7。由质量守恒定律可知,x=(28+7+2+22)-(4+23+2)=30,y=(28+7+2+22)-(10+19+7)=23。反应后甲、丁质量增加,是反应物,乙、丙质量减少,是生成物,该反应不符合“一变多”的特征,不属于分解反应;反应后甲、乙的质量比为28g∶7 g=4∶1。11.(一题多解)(2024四川巴中期末)在某一密闭容器中有10 g 氢气和氧气的混合气体,充分燃烧后,生成9 g水,则原混合气 体中氢气和氧气的质量比可能是 ( )A.1∶8 B.4∶1 C.2∶1 D.1∶9D解析 方法一:设生成9 g水需要氢气的质量为x,氧气的质量 为y。2H2+O2 2H2O4 32 36x y 9 g = x=1 g = y=8 g①如果剩余气体为氢气,则原混合气体中氢气的质量为10 g-12.(2023山东济南市中期中)(双选)4.6 g某纯净物完全燃烧后 生成8.8 g CO2和5.4 g水。则对该物质及其反应的相关判断 中,正确的是( )A.该物质中只含碳、氢两种元素B.该物质中,碳、氢元素的质量比为4∶1C.该物质的1个分子中碳原子和氢原子的个数比为1∶3D.参加反应的O2的质量为3.2 gBC解析 由质量守恒定律可知,反应前后元素的种类、质量不 变,8.8 g二氧化碳中碳元素的质量为8.8 g× =2.4 g,5.4 g水中氢元素的质量为5.4 g× =0.6 g,该物质中碳、氢元素的质量之和为2.4 g+0.6 g=3 g<4.6 g,因此该物质由碳、氢、氧三 种元素组成;该物质中碳、氢元素的质量比为2.4 g∶0.6 g= 4∶1;该物质的1个分子中碳原子和氢原子的个数比为 ∶ =1∶3;参加反应的O2的质量为8.8 g+5.4 g-4.6 g=9.6 g。二、填空题(共34分)13.(4分)质量守恒定律的发现,使得化学科学由定性研究走 向定量研究,促进了化学科学的发展。(1)一定质量的镁条在空气中完全燃烧后,生成的固体质量 (填“<”“>”或“=”)镁条的质量,这与质量守恒定律 (填“矛盾”或“不矛盾”)。(2)现有化学反应A+3B C+2D,已知A为a g,B为b g,恰好完全反应后生成的D为d g,则生成C的质量为 g。(3)某纯净物X在氧气中燃烧的化学方程式为2X+5O2 4CO2+2H2O,则X的化学式为 。>不矛盾(a+b-d)C2H2 解析 (1)参加反应的镁和氧气的质量之和等于生成的氧化 镁的质量,故生成的固体的质量>镁条的质量,该反应符合质 量守恒定律。(2)参加反应的各物质的质量总和等于反应后 生成的各物质的质量总和,故生成C的质量为(a+b-d)g。(3) 根据质量守恒定律可知,化学反应前后原子的种类和数目不 变,已知的反应物中碳、氢、氧原子的个数分别为0、0、10, 反应后的生成物中碳、氢、氧原子的个数分别为4、4、10, 则物质X的化学式为C2H2。14.(2024山东栖霞期中)(6分)化学方程式是重要的化学用语, 是学好化学必备的语言工具。配平是书写化学方程式非常 关键的一个环节,请将下列反应的化学方程式配平。(化学计 量数为1也要填上)(1) C2H2+ O2 H2O+ CO2;(2) Al+ HCl AlCl3+ H2↑;(3) Fe2O3+ CO Fe+ CO2。25242623132315.(2023山东淄博张店期中)(6分)写出下列反应的化学方程式。(1)常温下,铝和氧气发生反应,在铝表面形成致密的氧化铝 薄膜: 。(2)氧化铜和碳在高温条件下反应生成铜和二氧化碳: 。(3)碳单质包括金刚石、石墨和C60等,它们的化学性质相似, 写出C60在空气中完全燃烧的化学方程式: 。16.【模型法】(2023山东济宁任城期中)(10分)天然气是我们 生活中最常用的燃料之一。天然气燃烧反应的微观示意图 如图。请回答: (1)天然气的主要成分是甲烷,构成1个甲烷分子的微粒是 。(2)该反应前后,不变的是 (填序号)。1个碳原子和4个氢原子①②④⑥①元素种类 ②物质总质量③物质种类 ④原子种类⑤分子种类 ⑥原子个数(3)该反应的化学方程式为 ,反应中的能量转化过程是 。(4)甲烷除了可以作燃料外,在工业上还利用甲烷与水在一定 条件下生产水煤气(一氧化碳和氢气的混合气体),该反应的 化学方程式为 。化学能转化为热能解析 (2)根据质量守恒定律可知,化学反应前后,原子的种 类、原子的数目、物质的总质量、元素的种类均保持不变, 化学反应涉及新物质的生成,故物质的种类和分子的种类一 定发生改变。(1)图中待测值x= ,该反应中反应物是 。(2)反应过程中甲和丁的质量变化之比为 (填最简整数 比)。(3)下列说法正确的是 (填字母)。A.该反应是分解反应B.该反应中丙一定是催化剂C.乙一定是化合物D.丁一定是单质E.乙和甲中至少含有一种相同的元素30甲和丁4∶1CE解析 (1)由质量守恒定律可知,x=20×4-12-20-18=30;反应后 甲、丁质量减少,是反应物。(2)反应过程中甲和丁的质量变 化之比为(20 g-12 g)∶(20 g-18 g)=4∶1。(3)丙在反应前后 质量不变,可能是催化剂,反应后乙质量增加,是生成物,该反 应符合“多变一”的特征,属于化合反应;乙是化合反应的生 成物,故乙一定是化合物;乙和甲中至少含有一种相同的元 素,丁可能是单质,也可能是化合物。三、实验探究题(共14分)18.(学科素养·科学探究与实践)(2024甘肃白银期末)(14分)质 量守恒定律是自然界的基本定律之一,化学兴趣小组以“探 究质量守恒定律”为主题开展实验探究。【提出问题】化学反应前后各物质的质量总和是否相等?【猜想与假设】猜想1:不相等;猜想2:相等。【实验探究】(1)甲、乙两组同学用托盘天平分别称量反应前后装置的质 量。产生蓝色沉淀向右(2)方案一中发生反应的化学方程式为 ;请讨论分析导致方案二实验结果的原因: 。【得出结论】(3)同学们经过讨论分析,得出猜想2正确。请从微观角度解 释原因: 。【反思评价】(4)通过以上实验,在选有气体参加或生成的化学反应来验证2NaOH+CuSO4 Na2SO4+Cu(OH)2↓反应生成的二氧化碳逸出装置化学反应前后原子的种类、个数和质量都不变 质量守恒定律时应在 装置中进行。【拓展延伸】 (5)小华同学设计了如图实验来验证质量守恒定律,小刚同学 认为该实验设计是不正确的,其原因是 。密闭酒精与蒸馏水混合发生的是物理变化解析 (1)氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸 钠,会观察到烧杯中产生蓝色沉淀;稀盐酸和大理石中的碳酸 钙反应生成氯化钙、水和二氧化碳,生成的二氧化碳逸出装 置,因此会观察到天平的指针向右偏转。四、计算题(共16分)19.[答案含评分细则](情境素材·传统工艺)(2023江苏宿迁中 考)(8分)我们的祖先很早就掌握了炼铜的工艺,他们将孔雀 石[主要成分是Cu2(OH)2CO3]和木炭一起加热就可得到红色 的铜。兴趣小组为测定某孔雀石中Cu2(OH)2CO3的质量分 数,进行如下实验:称取25 g孔雀石样品,粉碎后放入烧杯,向 其中加入200 g稀硫酸(稀硫酸过量),充分反应后称量,烧杯内 物质的总质量为220.6 g(假设杂质都不与稀硫酸发生反 应)。(1)Cu2(OH)2CO3+2H2SO4 2CuSO4+CO2↑+3 。(2)生成气体的质量是 g。(3)求该孔雀石中Cu2(OH)2CO3的质量分数。(写出计算过程)H2O(1分)4.4(1分)该孔雀石中Cu2(OH)2CO3的质量分数为 ×100%=88.8%答:该孔雀石中Cu2(OH)2CO3的质量分数为88.8%。【评分细则】 已知量不带单位或设为“x g”共扣1分;缺 少解、设或答共扣1分;合理解法均可得分。解析 (1)由反应的化学方程式可知,反应物中Cu、O、H、C、S的原子个数分别为2、13、6、1、2,已知的生成物中Cu、O、H、C、S的原子个数分别为2、10、0、1、2,根据化学反应前后原子的种类和数目不变,未知物的化学式为H2O。(2)根据质量守恒定律可知,生成气体的质量是25 g+200 g-220.6 g=4.4 g。20.[答案含评分细则](2024山东济南钢城期末改编)(8分)实 验室用过氧化氢溶液和二氧化锰制取氧气(过氧化氢溶液由 过氧化氢和水两部分组成,只有过氧化氢参与反应),反应前, 将68 g过氧化氢溶液放入烧杯中,再向其中加入2 g二氧化锰, 烧杯中物质的总质量随时间的变化关系如图所示,请回答: (1)该反应完成后,二氧化锰的质量为 g。(2)反应生成氧气的质量是 g。(3)计算过氧化氢溶液中溶质的质量分数。(写出计算过程)2(1分)3.2(1分)【评分细则】 已知量不带单位或设为“x g”共扣1分;缺 少解、设或答共扣1分;因化学方程式错误导致计算错误的, 酌情给分;合理解法均可得分。解析 (1)二氧化锰是催化剂,反应前后质量不变。(2)由质量 守恒定律可知,反应生成氧气的质量是70 g-66.8 g=3.2 g。
第五单元 素养综合检测(满分100分, 限时45分钟)C解析 化学反应前后原子的种类、数目不变,反应物中含有 4个氢原子、4个氮原子、12个氧原子,已知的生成物中含有 4个氢原子、4个氮原子、10个氧原子,所以X的化学式是O2。2.(2023四川德阳中江期末)铝在氧气中燃烧生成氧化铝,参加反应的铝、氧气与生成的氧化铝之间的质量比为 ( )A.27∶32∶102 B.108∶96∶204C.4∶3∶2 D.27∶32∶59B解析 在4Al+3O2 2Al2O3反应中,参加反应的铝、氧气与反应生成的氧化铝的质量比为108∶96∶204。3.(2023山东济南槐荫期中)(多选)下列关于2CO+O2 2CO2的说法中,不正确的是 ( )A.参加反应的一氧化碳与氧气的质量比为2∶1B.反应前后分子、原子的个数均保持不变C.表示一氧化碳加氧气等于二氧化碳D.表示一氧化碳与氧气在点燃的条件下反应生成二氧化碳ABC解析 参加反应的一氧化碳与氧气的质量比为(2×28)∶32= 7∶4;题中化学反应前后原子的个数不变,分子的个数减少; 在化学方程式中,“+”读作“和”,“ ”读作“生成”。4.(2024广西贵港覃塘期中改编)下列现象不能用质量守恒定 律解释的是 ( )A.石蜡熔化前后,其质量不变B.氢氧化钠溶液和硫酸铜溶液反应,反应前后物质的总质量 不变C.木材在空气中燃烧后化为灰烬,灰烬的质量比木材的质量小D.铜丝在空气中加热,生成物的质量比原来铜丝的质量大A解析 石蜡熔化属于物理变化,不能用质量守恒定律解释。5.(2023山东青岛西海岸新区期中改编)下列实验能够直接用 于验证质量守恒定律的是 ( ) D解析 酒精与蒸馏水混合属于物理变化,不能用质量守恒定 律解释;蜡烛燃烧有二氧化碳生成,二氧化碳会逸散到空气 中,不能直接用于验证质量守恒定律;红墨水与水混合属于物 理变化,不能用质量守恒定律解释。A解析 题中反应是一种化合物与一种单质在一定条件下反 应生成另一种化合物的反应,故选A。7.【模型法】(2023江苏宿迁中考)乙醇作为一种清洁能源, 已成为各国可再生能源的发展重点之一。如图为乙醇充分 燃烧的微观示意图,下列有关该反应的说法正确的是 ( )A.反应生成丙和丁的分子个数比是2∶3B.反应前后原子种类发生改变AC.反应前后各元素的化合价均没有变化D.该反应中共涉及三种氧化物解析 由反应的微观示意图可知,乙醇与氧气在点燃的条件 下反应生成二氧化碳和水,反应的化学方程式为C2H5OH+3O2 2CO2+3H2O。反应前后原子种类不发生改变;反应物中氧气是一种单质,氧气中氧元素的化合价为零,而生成物均为 氧化物,其中氧元素的化合价均为-2价,因此该反应前后一定 存在元素化合价的改变;该反应中涉及的氧化物有二氧化碳 和水。8.(2024四川达州宣汉期末)在反应A+3B 2C+3D中,已知23 g A和48 g B恰好完全反应,生成44 g C,又知D的相对分子 质量为18,则A的相对分子质量为 ( )A.96 B.23C.92 D.46D解析 由质量守恒定律可知,反应生成D的质量为23 g+48 g- 44 g=27 g。设A的相对分子质量为x。A+3B 2C+3Dx 3×1823 g 27 g = x=46。9.(2024山东济南平阴期中)(多选)氯气经常用于自来水消毒, 也可用于制造盐酸、漂白粉和漂粉精等。实验室通常用二 氧化锰固体和浓盐酸在加热的条件下制取氯气。反应的化 学方程式为MnO2+xHCl(浓) MnCl2+2H2O+Y↑。下列有关此反应的说法中,正确的是 ( )A.该反应涉及的氧化物有两种B.物质Y的化学式为Cl2C.MnO2是这个反应的催化剂D.x的数值是4ABD解析 化学反应前后原子的种类、数目不变,分析题中化学 方程式可知,反应后含有4个H原子,故x=4,故物质Y的化学式 为Cl2;该反应中二氧化锰和水属于氧化物;二氧化锰是该反 应的反应物。10.(2020广西梧州中考)一定条件下,在密闭容器中发生了某 反应,测得反应过程中各物质的质量如表:下列说法正确的是 ( )A.x的值一定等于30B.该反应是分解反应C.丙可能是该反应的催化剂D.反应后甲、乙的质量比为2∶1A解析 反应5分钟时,甲的质量增加了6 g,乙的质量减少了4g,则参加反应的甲、乙的质量比为3∶2,则(28-10)∶(19-z)=3∶2,z=7。由质量守恒定律可知,x=(28+7+2+22)-(4+23+2)=30,y=(28+7+2+22)-(10+19+7)=23。反应后甲、丁质量增加,是反应物,乙、丙质量减少,是生成物,该反应不符合“一变多”的特征,不属于分解反应;反应后甲、乙的质量比为28g∶7 g=4∶1。11.(一题多解)(2024四川巴中期末)在某一密闭容器中有10 g 氢气和氧气的混合气体,充分燃烧后,生成9 g水,则原混合气 体中氢气和氧气的质量比可能是 ( )A.1∶8 B.4∶1 C.2∶1 D.1∶9D解析 方法一:设生成9 g水需要氢气的质量为x,氧气的质量 为y。2H2+O2 2H2O4 32 36x y 9 g = x=1 g = y=8 g①如果剩余气体为氢气,则原混合气体中氢气的质量为10 g-12.(2023山东济南市中期中)(双选)4.6 g某纯净物完全燃烧后 生成8.8 g CO2和5.4 g水。则对该物质及其反应的相关判断 中,正确的是( )A.该物质中只含碳、氢两种元素B.该物质中,碳、氢元素的质量比为4∶1C.该物质的1个分子中碳原子和氢原子的个数比为1∶3D.参加反应的O2的质量为3.2 gBC解析 由质量守恒定律可知,反应前后元素的种类、质量不 变,8.8 g二氧化碳中碳元素的质量为8.8 g× =2.4 g,5.4 g水中氢元素的质量为5.4 g× =0.6 g,该物质中碳、氢元素的质量之和为2.4 g+0.6 g=3 g<4.6 g,因此该物质由碳、氢、氧三 种元素组成;该物质中碳、氢元素的质量比为2.4 g∶0.6 g= 4∶1;该物质的1个分子中碳原子和氢原子的个数比为 ∶ =1∶3;参加反应的O2的质量为8.8 g+5.4 g-4.6 g=9.6 g。二、填空题(共34分)13.(4分)质量守恒定律的发现,使得化学科学由定性研究走 向定量研究,促进了化学科学的发展。(1)一定质量的镁条在空气中完全燃烧后,生成的固体质量 (填“<”“>”或“=”)镁条的质量,这与质量守恒定律 (填“矛盾”或“不矛盾”)。(2)现有化学反应A+3B C+2D,已知A为a g,B为b g,恰好完全反应后生成的D为d g,则生成C的质量为 g。(3)某纯净物X在氧气中燃烧的化学方程式为2X+5O2 4CO2+2H2O,则X的化学式为 。>不矛盾(a+b-d)C2H2 解析 (1)参加反应的镁和氧气的质量之和等于生成的氧化 镁的质量,故生成的固体的质量>镁条的质量,该反应符合质 量守恒定律。(2)参加反应的各物质的质量总和等于反应后 生成的各物质的质量总和,故生成C的质量为(a+b-d)g。(3) 根据质量守恒定律可知,化学反应前后原子的种类和数目不 变,已知的反应物中碳、氢、氧原子的个数分别为0、0、10, 反应后的生成物中碳、氢、氧原子的个数分别为4、4、10, 则物质X的化学式为C2H2。14.(2024山东栖霞期中)(6分)化学方程式是重要的化学用语, 是学好化学必备的语言工具。配平是书写化学方程式非常 关键的一个环节,请将下列反应的化学方程式配平。(化学计 量数为1也要填上)(1) C2H2+ O2 H2O+ CO2;(2) Al+ HCl AlCl3+ H2↑;(3) Fe2O3+ CO Fe+ CO2。25242623132315.(2023山东淄博张店期中)(6分)写出下列反应的化学方程式。(1)常温下,铝和氧气发生反应,在铝表面形成致密的氧化铝 薄膜: 。(2)氧化铜和碳在高温条件下反应生成铜和二氧化碳: 。(3)碳单质包括金刚石、石墨和C60等,它们的化学性质相似, 写出C60在空气中完全燃烧的化学方程式: 。16.【模型法】(2023山东济宁任城期中)(10分)天然气是我们 生活中最常用的燃料之一。天然气燃烧反应的微观示意图 如图。请回答: (1)天然气的主要成分是甲烷,构成1个甲烷分子的微粒是 。(2)该反应前后,不变的是 (填序号)。1个碳原子和4个氢原子①②④⑥①元素种类 ②物质总质量③物质种类 ④原子种类⑤分子种类 ⑥原子个数(3)该反应的化学方程式为 ,反应中的能量转化过程是 。(4)甲烷除了可以作燃料外,在工业上还利用甲烷与水在一定 条件下生产水煤气(一氧化碳和氢气的混合气体),该反应的 化学方程式为 。化学能转化为热能解析 (2)根据质量守恒定律可知,化学反应前后,原子的种 类、原子的数目、物质的总质量、元素的种类均保持不变, 化学反应涉及新物质的生成,故物质的种类和分子的种类一 定发生改变。(1)图中待测值x= ,该反应中反应物是 。(2)反应过程中甲和丁的质量变化之比为 (填最简整数 比)。(3)下列说法正确的是 (填字母)。A.该反应是分解反应B.该反应中丙一定是催化剂C.乙一定是化合物D.丁一定是单质E.乙和甲中至少含有一种相同的元素30甲和丁4∶1CE解析 (1)由质量守恒定律可知,x=20×4-12-20-18=30;反应后 甲、丁质量减少,是反应物。(2)反应过程中甲和丁的质量变 化之比为(20 g-12 g)∶(20 g-18 g)=4∶1。(3)丙在反应前后 质量不变,可能是催化剂,反应后乙质量增加,是生成物,该反 应符合“多变一”的特征,属于化合反应;乙是化合反应的生 成物,故乙一定是化合物;乙和甲中至少含有一种相同的元 素,丁可能是单质,也可能是化合物。三、实验探究题(共14分)18.(学科素养·科学探究与实践)(2024甘肃白银期末)(14分)质 量守恒定律是自然界的基本定律之一,化学兴趣小组以“探 究质量守恒定律”为主题开展实验探究。【提出问题】化学反应前后各物质的质量总和是否相等?【猜想与假设】猜想1:不相等;猜想2:相等。【实验探究】(1)甲、乙两组同学用托盘天平分别称量反应前后装置的质 量。产生蓝色沉淀向右(2)方案一中发生反应的化学方程式为 ;请讨论分析导致方案二实验结果的原因: 。【得出结论】(3)同学们经过讨论分析,得出猜想2正确。请从微观角度解 释原因: 。【反思评价】(4)通过以上实验,在选有气体参加或生成的化学反应来验证2NaOH+CuSO4 Na2SO4+Cu(OH)2↓反应生成的二氧化碳逸出装置化学反应前后原子的种类、个数和质量都不变 质量守恒定律时应在 装置中进行。【拓展延伸】 (5)小华同学设计了如图实验来验证质量守恒定律,小刚同学 认为该实验设计是不正确的,其原因是 。密闭酒精与蒸馏水混合发生的是物理变化解析 (1)氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸 钠,会观察到烧杯中产生蓝色沉淀;稀盐酸和大理石中的碳酸 钙反应生成氯化钙、水和二氧化碳,生成的二氧化碳逸出装 置,因此会观察到天平的指针向右偏转。四、计算题(共16分)19.[答案含评分细则](情境素材·传统工艺)(2023江苏宿迁中 考)(8分)我们的祖先很早就掌握了炼铜的工艺,他们将孔雀 石[主要成分是Cu2(OH)2CO3]和木炭一起加热就可得到红色 的铜。兴趣小组为测定某孔雀石中Cu2(OH)2CO3的质量分 数,进行如下实验:称取25 g孔雀石样品,粉碎后放入烧杯,向 其中加入200 g稀硫酸(稀硫酸过量),充分反应后称量,烧杯内 物质的总质量为220.6 g(假设杂质都不与稀硫酸发生反 应)。(1)Cu2(OH)2CO3+2H2SO4 2CuSO4+CO2↑+3 。(2)生成气体的质量是 g。(3)求该孔雀石中Cu2(OH)2CO3的质量分数。(写出计算过程)H2O(1分)4.4(1分)该孔雀石中Cu2(OH)2CO3的质量分数为 ×100%=88.8%答:该孔雀石中Cu2(OH)2CO3的质量分数为88.8%。【评分细则】 已知量不带单位或设为“x g”共扣1分;缺 少解、设或答共扣1分;合理解法均可得分。解析 (1)由反应的化学方程式可知,反应物中Cu、O、H、C、S的原子个数分别为2、13、6、1、2,已知的生成物中Cu、O、H、C、S的原子个数分别为2、10、0、1、2,根据化学反应前后原子的种类和数目不变,未知物的化学式为H2O。(2)根据质量守恒定律可知,生成气体的质量是25 g+200 g-220.6 g=4.4 g。20.[答案含评分细则](2024山东济南钢城期末改编)(8分)实 验室用过氧化氢溶液和二氧化锰制取氧气(过氧化氢溶液由 过氧化氢和水两部分组成,只有过氧化氢参与反应),反应前, 将68 g过氧化氢溶液放入烧杯中,再向其中加入2 g二氧化锰, 烧杯中物质的总质量随时间的变化关系如图所示,请回答: (1)该反应完成后,二氧化锰的质量为 g。(2)反应生成氧气的质量是 g。(3)计算过氧化氢溶液中溶质的质量分数。(写出计算过程)2(1分)3.2(1分)【评分细则】 已知量不带单位或设为“x g”共扣1分;缺 少解、设或答共扣1分;因化学方程式错误导致计算错误的, 酌情给分;合理解法均可得分。解析 (1)二氧化锰是催化剂,反应前后质量不变。(2)由质量 守恒定律可知,反应生成氧气的质量是70 g-66.8 g=3.2 g。
相关资料
更多









