




- 第02讲 热化学方程式 燃烧热(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 1 次下载
- 第03讲 反应热的计算(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 0 次下载
- 第05讲 影响化学反应速率的因素(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 1 次下载
- 第06讲 活化能(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 1 次下载
- 第07讲 化学平衡状态的建立(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 1 次下载
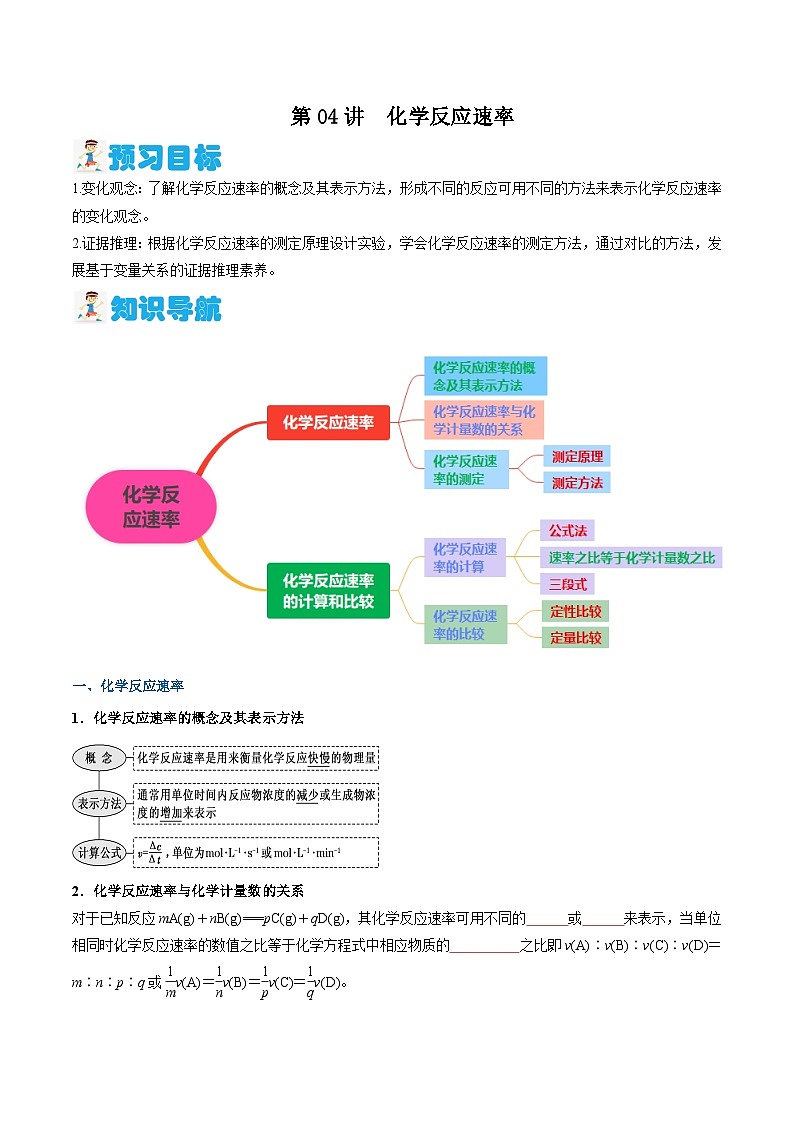
第04讲 化学反应速率(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1)
展开1.变化观念:了解化学反应速率的概念及其表示方法,形成不同的反应可用不同的方法来表示化学反应速率的变化观念。
2.证据推理:根据化学反应速率的测定原理设计实验,学会化学反应速率的测定方法,通过对比的方法,发展基于变量关系的证据推理素养。
一、化学反应速率
1.化学反应速率的概念及其表示方法
2.化学反应速率与化学计量数的关系
对于已知反应mA(g)+nB(g)===pC(g)+qD(g),其化学反应速率可用不同的 或 来表示,当单位相同时,化学反应速率的数值之比等于化学方程式中相应物质的 之比,即v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q或eq \f(1,m)v(A)=eq \f(1,n)v(B)=eq \f(1,p)v(C)=eq \f(1,q)v(D)。
3.化学反应速率的测定
(1)测定原理
利用化学反应中任何一种与物质 有关的可观测量进行测定。
(2)测定方法
①直接观察测定:如释放出气体的体积和体系的压强等。
②科学仪器测定:如反应体系颜色的变化。在溶液中,当反应物或生成物本身有较明显的颜色时,可利
用 和 间的比例关系来跟踪反应的过程和测量反应速率。
【易错警示】化学反应速率的理解应注意的问题
(1)误认为对于在不同条件下进行的同一反应,同一反应物或生成物的物质的量的变化量大,反应速率就一定快。化学反应速率是用单位时间内浓度的变化量来表示的,物质的量的变化量大,单位时间内浓度的变化量不一定大。
(2)误认为用不同的物质表示化学反应速率意义不同。在同一个化学反应里,虽然用不同物质表示的化学反应速率数值不一定相同,但是它们的实际意义完全相同,即一种物质的化学反应速率也就代表了整个化学反应的化学反应速率。
(3)固体或纯液体的浓度记为常数,Δc=0,因此不用固体或纯液体表示化学反应速率。
(4)化学反应速率是一段时间内的平均反应速率,而不是瞬时反应速率。
二、化学反应速率的计算和比较
1.化学反应速率的计算
(1)公式法:
v=eq \f(Δc,Δt)=eq \f(Δn,VΔt)
【特别提醒】
①如果题目中给出的是物质的量的变化量,在计算速率时应先除以体积,转化为浓度的变化量。
②浓度的变化量Δc=c(某时刻)-c(初始)
所以一般Δc(反应物)为负值,Δc(生成物)为正值,
而v是标量,只有正值,所以在计算反应速率时,
v(反应物)=-eq \f(Δc反应物,Δt)
v(生成物)=eq \f(Δc生成物,Δt)。
(2)运用同一反应中“速率之比等于化学计量数之比”的规律进行计算。
对于一个化学反应:mA+nB===pC+qD,v(A)=-eq \f(ΔcA,Δt),v(B)=-eq \f(ΔcB,Δt),v(C)=eq \f(ΔcC,Δt),v(D)=eq \f(ΔcD,Δt),且有:eq \f(vA,m)=eq \f(vB,n)=eq \f(vC,p)=eq \f(vD,q)。
(3)“三段式”法
①求解化学反应速率计算题的一般步骤:
a.写出有关反应的化学方程式;
b.找出各物质的起始量、转化量、某时刻量;转化量之比等于化学计量数之比;
c.根据已知条件列方程计算。
反应: mA(g)+ nB(g) pC(g)
起始/(ml·L-1) a b c
转化/(ml·L-1) x eq \f(nx,m) eq \f(px,m)
某时刻(t s)/(ml·L-1) a-x b-eq \f(nx,m) c+eq \f(px,m)
再利用化学反应速率的定义求算
v(A)=eq \f(x,t) ml·L-1·s-1;
v(B)=eq \f(nx,mt) ml·L-1·s-1;
v(C)=eq \f(px,mt) ml·L-1·s-1。
②计算中注意以下量的关系:
对反应物:c(起始)-c(转化)=c(某时刻);
对生成物:c(起始)+c(转化)=c(某时刻);
转化率=eq \f(c转化,c起始)×100%。
2.化学反应速率的比较
(1)定性比较
通过明显的实验现象,如反应的剧烈程度、产生气泡或沉淀的快慢、固体消失或气体充满所需时间的长短等来定性判断化学反应的快慢。如K与水反应比Na与水反应剧烈,则反应速率:K>Na。
(2)定量比较
对于同一化学反应速率用不同物质表示的数值可能不同,但比较反应速率的大小不能只看数值的大小,而要进行一定的转化,具体比较方法如下:
归一法:将不同物质的化学反应速率转化成同一物质的化学反应速率。
比值法:比较同一物质化学反应速率的数值或分别除以相应物质的化学计量数之后的数值。数值越大,反应进行得越快。
如反应:aA+bB=== cC,比较 eq \f(vA,a)与eq \f(vB,b),若eq \f(vA,a)>eq \f(vB,b),则A的反应速率比B大。
【方法技巧】
①“一看”:看化学反应速率的单位是否一致,若不一致,转化为同一单位。
②“二化”:将不同物质的化学反应速率转化成同一物质的化学反应速率,或分别除以相应物质的化学计量数。
③“三比较”:标准统一后比较数值大小,数值越大,反应速率越大。
考点01 化学反应速率及其表示方法
【例1】将5.6g铁粉投入的硫酸中,2min后铁恰好完全溶解。下列有关该反应速率的表示正确的是(忽略溶液体积的变化)
A.用铁表示的反应速率为
B.用硫酸表示的反应速率为
C.用硫酸亚铁表示的反应速率为
D.用氢气表示的反应速率为
【变式1-1】下列关于化学反应速率的说法中,正确的是
A.化学反应速率是指某一时刻,某种反应物的瞬时反应速率
B.化学反应速率为0.8ml·L-1·s-1是指反应1s时某物质的浓度为0.8ml·L-1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.化学反应速率可用反应体系中任何一种物质浓度的变化来表示
【变式1-2】一定条件下,在容积为1 L的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),2 min后测得生成0.06 ml NH3,则该段时间内用NH3来表示的化学反应速率为
A.0.01 ml·L-1·min-1B.0.02 ml·L-1·min-1
C.0.03 ml·L-1·min-1D.0.06 ml·L-1·min-1
考点02 化学反应速率与化学计量数关系的应用
【例2】对于可逆反应A(g)+3B(s)2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=0.5ml/(L•min)B.v(B)=1.2ml/(L•s)
C.v(C)=0.1ml/(L•s)D.v(D)=0.4ml/(L•min)
【变式1-1】在容积不变的密闭容器中,A与B反应生成C,其化学反应速率分别用、、表示。已知:、,则该反应可表示为
A.B.
C.D.
【变式1-2】在反应中,表示的反应速率最快的是
A.B.
C.D.
考点03 化学反应速率图像分析
【例3】臭氧是理想的烟气脱硝试剂,可逆反应在体积固定的密闭容器中进行,反应过程中测得的浓度随时间1的变化曲线如图所示
下列叙述错误的是
A.a-c段反应速率加快的原因可能是反应放热
B.若向容器内充入一定体积的,化学反应速率加快
C.向反应体系中通入氢气,反应速率降低
D.2~8min的化学反应速率
【变式1-1】在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如下图,则下列叙述正确的是
A.该反应的化学方程式为
B.时刻,反应物A的转化率为60%
C.0→这段时间内,A的反应速率为
D.在→内,
【变式1-2】一定温度下,向容积为4L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,下列对反应的推断合理的是
A.该反应的化学方程式为3B+4C6A+2D
B.反应进行到1s时,v(A)=v(C)
C.反应进行到6s时,B的平均反应速率为0.1ml/(L•s)
D.反应进行到6s时,各物质的反应速率相等
1.在的反应中,2s后,的物质的量浓度增加了,用来表示反应速率为
A.B.C.D.
2.在容积不变的密闭容器中,A和B反应生成C和D,其化学反应速率分别用v(A)、v(B)、v(C)、v (D)表示。已知2 v (A)= v (C)、 3v (B)=4 v (D)、3 v (A)=2 v (D),则此反应可表示为
A.3A+4B=2C+3DB.3A+4B=4C+2D
C.2A+4B=4C+3DD.A+4B=3C+3D
3.在2L密闭容器中,3mlA和1mlB发生反应:3A(g)+B(g)⇌2C(g)+2D(g),10s末时,生成0.6ml/LC,下列说法正确的是
A.10s内,v(D)=0.12ml/(L·s)B.10s末时,物质A的转化率为40%
C.10s末时,B的物质的量为0.4mlD.10s末时,C的物质的量分数为15%
4.恒温密闭容器中的反应,经2min,M的浓度减少了。下列叙述错误的是
A.2min内M的平均反应速率为
B.M、P、Q表示的反应速率之比为4∶2∶1
C.用N表示的反应速率是
D.2~4min内M的平均反应速率小于
5.某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL2.5ml/L的稀硫酸溶液,将产生的H2收集在一个注射器中,0~10s内收集到气体的体积为50mL(折合成0℃、101kPa条件下的H2体积为44.8mL)。下列说法不正确的是
A.将题述中的稀硫酸改为浓硫酸,生成H2的速率变快
B.忽略锥形瓶内溶液体积的变化,用H+来表示10s内该反应的速率为0.01 ml∙L−1∙s−1
C.忽略锥形瓶内溶液体积的变化,用Zn2+来表示10s内该反应的速率为0.3ml∙L−1∙min−1
D.可通过测定溶液的pH来测定反应速率
6.某温度下,把一定量的NH4Cl置于密闭容器中发生反应:NH4Cl(s) NH3(g)+HCl(g),2HCl(g) Cl2(g)+H2(g)。2 min后,测得H2的浓度为0.5 ml·L-1,HCl的浓度为4 ml·L-1,若上述反应速率用v(NH3)表示,则下列反应速率正确的是
A.2.5 ml·L-1·min-1B.2.0 ml·L-1·min-1
C.1.25 ml·L-1·min-1D.0.5 ml·L-1·min-1
7.下列不同条件下发生化学反应:A+B=C+D,反应速率由大到小的顺序正确的一组是
①常温下,20mL溶液中含A和B各0.001ml;
②常温下,100mL溶液中含A和B各0.01ml;
③常温下,向10mL含A和B各0.0005ml的溶液中再加入蒸馏水30mL;
④常温下,100mL溶液中含A0.01ml和B0.005ml。
A.①②③④B.④③②①C.②④①③D.②①④③
8.在2L密闭容器中,发生如下反应:2A(g)+B(g)→ C(g)+D(g),若开始时加入A和B都是4ml,在10min时测得A的浓度为0.8ml/L,则10min时B的平均反应速率v(B)为
A.0.06ml/(L·min)B.0.16ml/(L·min)
C.0.08ml/(L·min)D.0.04ml/(L·min)
9.反应A+3B=2C+D在四种不同情况下的反应速率分别为①v(A)=0.15 ml·L-1·s-1 ②v(B)=0.6 ml·L-1·s-1 ③v(C)=0.5 ml·L-1·s-1 ④v(D)=0.45 ml·L-1·s-1,则反应速率由快到慢的顺序为
A.④>③>①>②B.②>④>③>①
C.②>③>④>①D.④>③>②>①
10.反应在密闭容器中进行,下列反应速率中最快的是
A.v(X)=0.5ml/(L·min) B. v(Y)=0.3ml/(L·min)
C.v(Z)=0.4ml/(L·min)D.
11.在4个均为密闭容器中不同投料下进行合成氨反应:,根据在相同时间内测定的结果,判断该反应速率最大的是
A.B.
C.D.
12.在容积恒定的容器中发生反应,0~15 min内测得反应速率,下列叙述正确的是
A.0~15 min内反应消耗氨气5.4 ml
B.0~15 min内用的浓度变化表示的反应速率
C.0~15 min内,
D.15 min时氧气浓度下降到
13.反应4A(s)+3B(g)2C(g)+D(g),经2min,B的浓度减少0.6ml·L-1.对此反应速率的表示正确的是
A.用A表示的反应速率是0.4ml/(L·min)
B.若相同时间,分别用B、C表示的反应速率均为0.3ml/(L·min),但这两段时间反应速率不相等
C.在2min末的反应速率,用B表示是0.3ml/(L·min)
D.前2min,正(B)和逆(C)表示的反应速率的值都是逐渐减小
14.室温下按如图所示的装置进行实验(实验过程中反应体系温度保持不变),5 s内消耗锌0.01 ml。下列说法正确的是
A.可用长颈漏斗替换分液漏斗
B.5 s内:
C.5 s内:
D.若药品足量,再消耗0.65g Zn的时间超过5 s
15.一定温度下,向容积为4L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,下列对反应的推断合理的是
A.该反应的化学方程式为
B.反应进行到1s时,
C.反应进行到6s时,B的平均反应速率为
D.反应进行到6s时,各物质的反应速率相等
第25讲 电解原理的应用 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1): 这是一份第25讲 电解原理的应用 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),文件包含第25讲电解原理的应用原卷版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx、第25讲电解原理的应用解析版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
第24讲 电解原理(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1): 这是一份第24讲 电解原理(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),文件包含第24讲电解原理原卷版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx、第24讲电解原理解析版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx等2份试卷配套教学资源,其中试卷共37页, 欢迎下载使用。
第23讲 化学电源(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1): 这是一份第23讲 化学电源(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),文件包含第23讲化学电源原卷版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx、第23讲化学电源解析版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx等2份试卷配套教学资源,其中试卷共48页, 欢迎下载使用。












