


所属成套资源:【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1)
- 第14讲 电离平衡常数 强酸与弱酸比较 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 0 次下载
- 第15讲 水的电离(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 0 次下载
- 第17讲 酸碱中和滴定(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 0 次下载
- 第18讲 盐类的水解 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 0 次下载
- 第19讲 影响盐类水解的主要因素及盐类水解的应用 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 0 次下载
第16讲 溶液的酸碱性与pH(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1)
展开
这是一份第16讲 溶液的酸碱性与pH(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),文件包含第16讲溶液的酸碱性与pH原卷版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx、第16讲溶液的酸碱性与pH解析版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
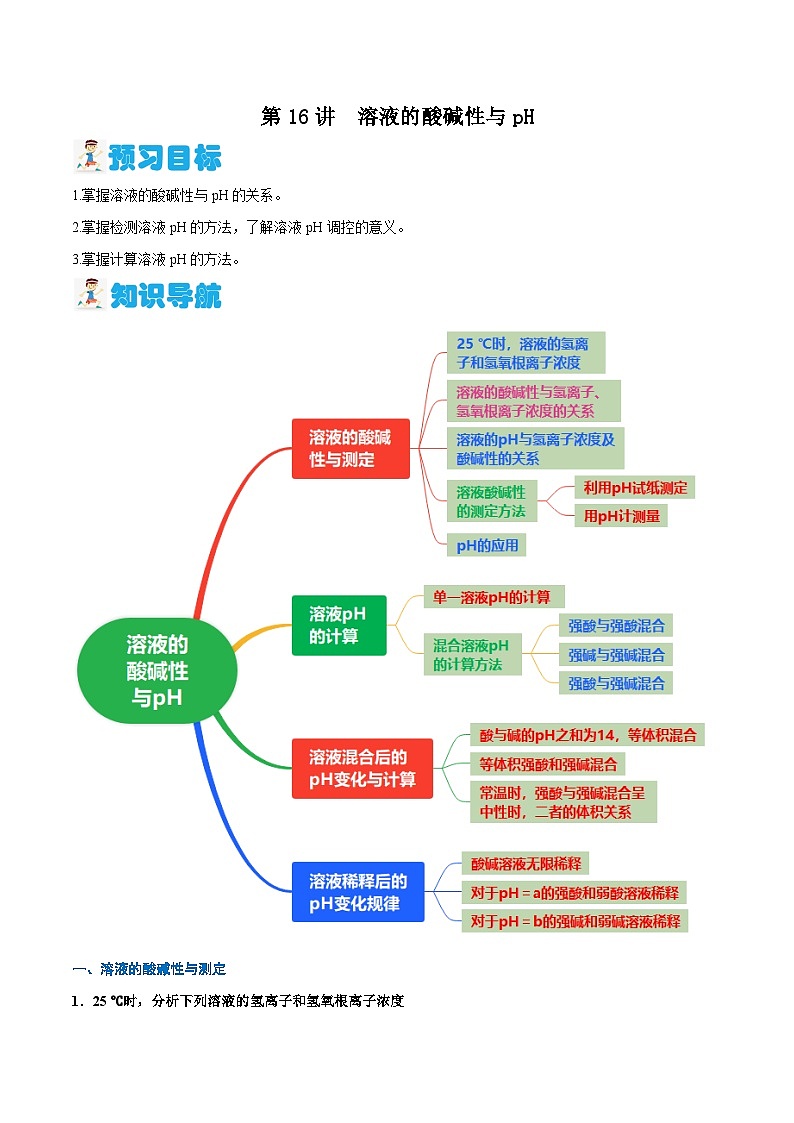
1.掌握溶液的酸碱性与pH的关系。
2.掌握检测溶液pH的方法,了解溶液pH调控的意义。
3.掌握计算溶液pH的方法。
一、溶液的酸碱性与测定
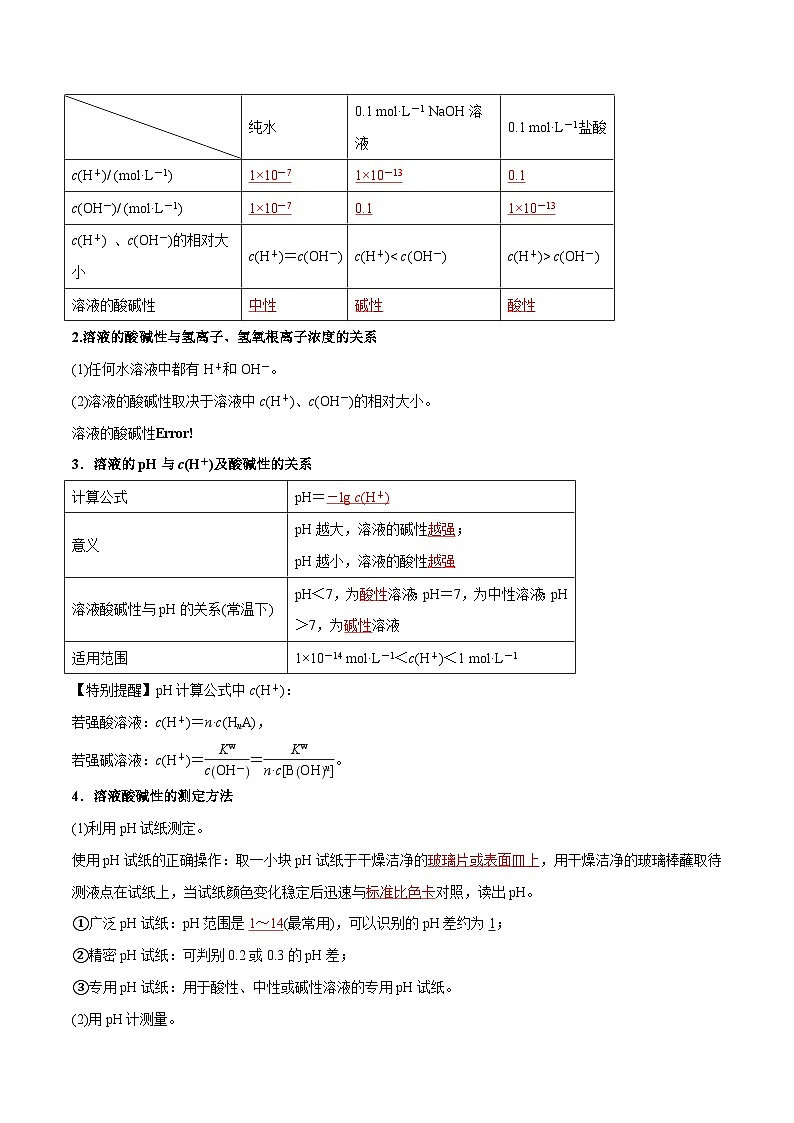
1.25 ℃时,分析下列溶液的氢离子和氢氧根离子浓度
2.溶液的酸碱性与氢离子、氢氧根离子浓度的关系
(1)任何水溶液中都有H+和OH-。
(2)溶液的酸碱性取决于溶液中c(H+)、c(OH-)的相对大小。
溶液的酸碱性eq \b\lc\{\rc\ (\a\vs4\al\c1(酸性溶液:cH+>cOH- ,中性溶液:cH+=cOH-,碱性溶液:cH+1 ml·L-1或c(OH-)>1 ml·L-1的溶液的pH。
二、溶液pH的计算
1.单一溶液pH的计算
(1)c ml·L-1 HnA强酸溶液的pH (25 ℃)
①c(H+)= ;
②pH=
(2)c ml·L-1 B(OH)n强碱溶液的pH (25 ℃)
①c(OH-)= ;
②c(H+)=eq \f(Kw,cOH-)=eq \f(10-14,nc) ml·L-1;
③pH=14+lg nc。
2.混合溶液pH的计算方法
(1)强酸与强酸混合(稀溶液体积变化忽略)
c混(H+)=eq \f(c1H+·V1+c2H+·V2,V1+V2),然后再求pH。
(2)强碱与强碱混合(稀溶液体积变化忽略)
先计算c混(OH-)=eq \f(c1OH-·V1+c2OH-·V2,V1+V2),
再求c混(H+)=eq \f(Kw,c混OH-),最后求pH。
(3)强酸与强碱混合(稀溶液体积变化忽略)
①恰好完全反应,溶液呈中性,pH=7 (25 ℃)。
②酸过量:
先求c余(H+)=eq \f(cH+·V酸-cOH-·V碱,V酸+V碱),再求pH。
③碱过量:
先求c余(OH-)=eq \f(cOH-·V碱-cH+·V酸,V酸+V碱),再求c(H+)=eq \f(Kw,c余OH-),最后求pH。
【方法技巧】
三、溶液混合后的pH变化与计算
1.酸与碱的pH之和为14,等体积混合
常温时eq \b\lc\{\rc\ (\a\vs4\al\c1(若为强酸与强碱,则pH=7,若为强酸与弱碱,则pH>7,若为弱酸与强碱,则pH<7))
2.等体积强酸(pH1)和强碱(pH2)混合
常温时eq \b\lc\{\rc\ (\a\vs4\al\c1(若pH1+pH2=14,则溶液呈中性,pH=7,若pH1+pH2>14,则溶液呈碱性,pH>7,若pH1+pH2<14,则溶液呈酸性,pH<7))
3.常温时,强酸(pH1)与强碱(pH2)混合呈中性时,二者的体积关系有如下规律:
(1)若pH1+pH2=14,则V酸=V碱。
(2)若pH1+pH2≠14,则eq \f(V酸,V碱)=。
四、溶液稀释后的pH变化规律
1.酸碱溶液无限稀释
常温下,pH只能无限 ,酸溶液pH不可能 ,碱溶液pH不可能 。
2.对于pH=a的强酸和弱酸溶液稀释
常温下,每稀释到原溶液体积的10n倍,强酸的pH就增大 个单位,即pH= ,弱酸的pH范围是: ,可用如图表示。
3.对于pH=b的强碱和弱碱溶液稀释
常温下,每稀释到原溶液体积的10n倍,强碱的pH减小 个单位,即pH= ,弱碱的pH范围是: ,可用如图表示。
4.对于物质的量浓度相同的强酸和弱酸稀释到原溶液体积的相同倍数
强酸pH变化程度比弱酸 (强碱和弱碱类似)。
弱酸、弱碱在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范围。
c相等的酸或碱溶液稀释后溶液pH的变化如图所示。
考点01 溶液酸碱性的判断与pH
【例1】关于溶液的说法正确的是
A.c(OH-)=c(H+)的溶液一定呈中性B.pH=7的溶液一定呈中性
C.盐溶液中水的电离不会被抑制D.能使甲基橙指示剂变黄的溶液一定呈碱性
【变式1-1】下列说法中正确的是( )
A.某溶液中c(H+)=c(OH-)=10-6ml·L-1,该溶液呈中性
B.溶液中若c(H+)>10-7ml·L-1,则c(H+)>c(OH-),溶液显酸性
C.c(H+)越大,则pH越大,溶液的酸性越强
D.pH为0的溶液,其中只有H+,无OH-
【变式1-2】将pH=3的某一元酸与pH=11的NaOH溶液等体积混合。下列说法正确的是
A.溶液可能呈碱性B.溶液一定呈酸性
C.两者的浓度可能相同D.两者一定完全反应
考点02 溶液pH的计算
【例2】已知:25℃时,Kw=1.0×10-14;100℃时,K w=1×10-12,下列说法正确的是
A.25℃时,0.2ml·L-1 Ba(OH)2溶液和0.2ml·L-1 HCl等体积混合,所得溶液的 pH=7
B.25℃时,0.2ml·L-1NaOH溶液与0.2ml·L-1CH3COOH恰好中和,所得溶液的pH=7
C.100℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7
D.25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7
【变式2-1】常温时,浓度为的稀盐酸用蒸馏水稀释倍,则稀释后溶液的pH约为
A.2B.7C.10D.12
【变式2-2】下列叙述正确的是
A.95℃纯水的pH②>①>④>⑤
C.⑤>④>③>①>②D.②>①>③>⑤>④
13.常温下,①pH=2的CH3COOH溶液;②pH=2的H2SO4溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是( )
A.水电离的c(H+):①=②=③=④
B.将②、④溶液混合后,pH=7,消耗溶液的体积:②④>①>②
14.常温下,有下列四种溶液:
下列说法正确的是
A.由水电离出的浓度:①>③
B.将④加蒸馏水稀释至原来的100倍时,所得溶液的
C.①与③混合,若溶液,则体积:
D.①与②等体积混合,混合溶液的
15.25℃时的三种溶液:①pH=2的醋酸;②pH=2的硫酸;③pH=12的氢氧化钠溶液。下列有关说法正确的是
A.将①溶液用蒸馏水稀释,使体积扩大100倍,所得溶液pH变为4
B.①与②两溶液的物质的量浓度相等
C.①与③两溶液等体积混合,混合液的pH=7
D.V1 L ②溶液和V2L ③溶液混合,若混合后溶液pH=3,则V1∶V2=11∶9
纯水
0.1 ml·L-1 NaOH溶液
0.1 ml·L-1盐酸
c(H+)/ (ml·L-1)
c(OH-)/ (ml·L-1)
c(H+) 、c(OH-)的相对大小
c(H+)=c(OH-)
c(H+)< c(OH-)
c(H+)> c(OH-)
溶液的酸碱性
计算公式
pH=
意义
pH越大,溶液的碱性 ;
pH越小,溶液的酸性
溶液酸碱性与pH的关系(常温下)
pH<7,为 溶液;pH=7,为中性溶液;pH>7,为 溶液
适用范围
1×10-14 ml·L-1<c(H+)<1 ml·L-1
①
②
③
④
0.1ml/L的NaOH溶液
pH=11的NaOH溶液
0.1ml/L的CH3COOH溶液
pH=3的CH3COOH溶液
相关试卷
这是一份第12讲 化学反应的调控 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),文件包含第12讲化学反应的调控原卷版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx、第12讲化学反应的调控解析版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
这是一份第11讲 化学反应的方向 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),文件包含第11讲化学反应的方向原卷版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx、第11讲化学反应的方向解析版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx等2份试卷配套教学资源,其中试卷共18页, 欢迎下载使用。
这是一份第08讲 化学平衡常数 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),文件包含第08讲化学平衡常数原卷版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx、第08讲化学平衡常数解析版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。









