



所属成套资源:全套人教版高中化学必修第一册课时教学课件
高中化学人教版 (2019)必修 第一册第一节 钠及其化合物课文配套ppt课件
展开
这是一份高中化学人教版 (2019)必修 第一册第一节 钠及其化合物课文配套ppt课件,共48页。PPT课件主要包含了知识点二焰色试验,目录索引等内容,欢迎下载使用。
知识点一 碳酸钠和碳酸氢钠
基础落实•必备知识全过关
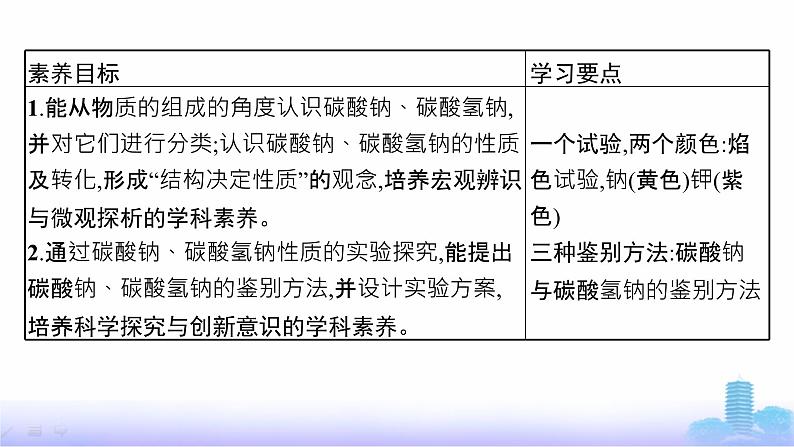
1.用途 从性质看用途
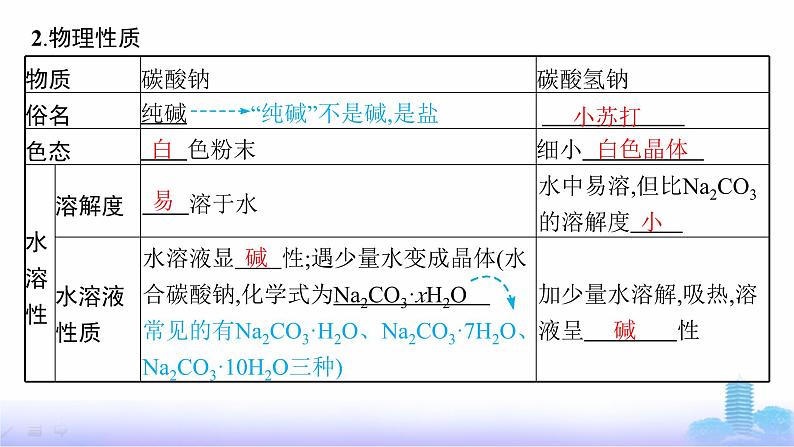
3.化学性质(1)装置(如图)
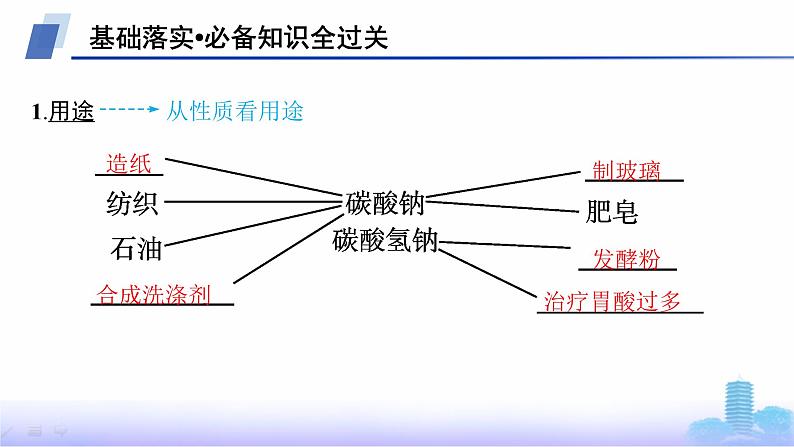
名师点拨(1)Na2CO3溶解放热,NaHCO3溶解吸热;(2)Na2CO3、NaHCO3溶液都呈碱性,溶液浓度相等时,Na2CO3溶液的碱性稍强。深度思考教材中描述“碳酸钠晶体在干燥空气里逐渐失去结晶水变成碳酸钠粉末”,该变化是物理变化还是化学变化?
科学史话侯德榜和侯氏制碱法。其制备流程如图。
(1)沉淀池中发生的反应为NH3+NaCl+CO2+H2O ══ NaHCO3↓+NH4Cl。(2)产生Na2CO3的化学方程式为2NaHCO3 Na2CO3+CO2↑+H2O。(3)侯氏制碱法中先通氨气(极易溶于水)至饱和再通二氧化碳的优点是:氨气易溶于水,且溶于水后显碱性,有助于吸收二氧化碳,从而析出更多的碳酸氢钠。
重难突破•能力素养全提升
探究角度1 碳酸钠、碳酸氢钠的性质比较与应用例1 如图所示是某化学兴趣小组根据教材知识设计的能说明Na2CO3与NaHCO3热稳定性的套管实验。下列叙述中不正确的是( )
A.甲为Na2CO3,乙为NaHCO3B.要证明NaHCO3受热能产生水,可在小试管内放置粘有少量无水硫酸铜粉末的棉花球C.加热不久就能看到B烧杯中的澄清石灰水变浑浊D.整个实验过程中A烧杯中的澄清石灰水无明显变化
解析 乙处温度高于甲处,甲为NaHCO3,乙为Na2CO3,故A错误;无水硫酸铜遇水变成蓝色的CuSO4·5H2O,故B正确;NaHCO3不稳定,受热分解产生的CO2进入B中,使石灰水变浑浊,故C正确;Na2CO3稳定,受热不分解,所以A中的石灰水不会变浑浊,故D正确。
归纳总结 碳酸钠与碳酸氢钠化学性质比较
[对点训练1](2024·河南三门峡高一检测)除去下列物质中所含的杂质(括号内为杂质),选用试剂或方法正确的是( )A.NaHCO3溶液(Na2CO3):Ca(OH)2溶液B.CO2(HCl):饱和的Na2CO3溶液C.Na2CO3固体(NaHCO3):NaOHD.Na2O2(Na2O):与氧气共热
解析 NaHCO3溶液和Na2CO3溶液均能与Ca(OH)2溶液反应,故A错误;CO2能与Na2CO3溶液反应生成NaHCO3,应选用饱和的NaHCO3溶液除去CO2中的HCl,故B错误;Na2CO3固体中的NaHCO3可通过加热的方法除去,故C错误;氧化钠与氧气发生反应:2Na2O+O2 2Na2O2,故D正确。
思维模型 碳酸钠与碳酸氢钠的相互转化及应用Na2CO3 NaHCO3
探究角度2 碳酸钠、碳酸氢钠的鉴别例2 (教材改编题)有两支试管分别装有Na2CO3和NaHCO3溶液,下列操作和判断正确的是( )
解析 A项中发生的反应分别为Na2CO3+Ca(OH)2 ══ CaCO3↓+2NaOH, 2NaHCO3+Ca(OH)2 ══ CaCO3↓+Na2CO3+2H2O,两者现象相同(产生白色沉淀);B项滴加等浓度的稀盐酸时,NaHCO3溶液反应更剧烈;C项Na2CO3与BaCl2发生反应:Na2CO3+BaCl2 ══ BaCO3↓+2NaCl,产生白色沉淀, NaHCO3与BaCl2不反应;D项逐滴加入等浓度的盐酸时,NaHCO3立即产生气泡,Na2CO3开始无气泡产生,过一会儿才产生气泡。
【变式设问】(1)若将A项改为分别加入氢氧化钡溶液,能否鉴别?
(2)上题D项,滴加顺序颠倒,即将两种溶液分别滴入盐酸中,能否鉴别?
提示 不能。因为Na2CO3和NaHCO3均与Ba(OH)2反应生成白色沉淀BaCO3,不能鉴别。
提示 否。将两种溶液滴入稀盐酸中,盐酸过量,都立即产生气体,无法鉴别。
[对点训练2]现有两瓶无标签的无色溶液,分别装有Na2CO3和NaHCO3,用下列试剂或方法能将两者区分的是( )①Ca(OH)2 ②盐酸 ③BaCl2 ④NaOH ⑤加热A.②③B.①③C.③④D.②⑤
解析 ①二者均与石灰水反应生成白色沉淀,现象相同,不能鉴别。②加入盐酸,碳酸钠开始不生成气体,而碳酸氢钠立即生成气体,现象不同,可鉴别。③碳酸钠与氯化钡反应生成沉淀,而碳酸氢钠与氯化钡不反应,现象不同,可以鉴别。④碳酸氢钠与NaOH反应生成碳酸钠和水,现象不明显,而碳酸钠与NaOH不反应,不能鉴别。⑤在溶液中加热,都不分解,没有明显现象,不能鉴别。
归纳总结 Na2CO3、NaHCO3的鉴别(1)利用热稳定性不同:
(2)利用和酸反应生成气体的速率不同(相同条件下):
(3)利用与BaCl2溶液反应:
探究角度3 数形结合分析Na2CO3、NaHCO3与盐酸的反应例3 (2023·山东潍坊高一检测)向NaOH和Na2CO3混合溶液中滴加稀盐酸, CO2生成的体积与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
A.在O~a范围内,只发生中和反应B.ab段发生反应的离子方程式为 +2H+ ══ H2O+CO2↑C.a>0.2D.向原混合溶液中通入过量的CO2,得到Na2CO3溶液
【变式设问】(1)若溶液的溶质只有Na2CO3,a= 。 (2)若混合溶液的溶质为Na2CO3和NaHCO3,a的取值范围为 。
提示 0.2 碳酸钠生成碳酸氢钠消耗的盐酸与碳酸氢钠再生成气体消耗盐酸相等。
提示 0c(Na2CO3)C.M中只有一种溶质的只有(1)D.M中有两种溶质的有(2)和(4)
解析 CO2与NaOH反应为①CO2+2NaOH ══ Na2CO3+H2O,②CO2+NaOH ══ NaHCO3,如果溶液M中只有NaHCO3,向M中逐滴加入盐酸,开始就产生气体,产生气体的体积V(CO2)与加入盐酸的体积V(HCl)的关系为图(1);如果溶液M中只有Na2CO3,向M中逐滴加入盐酸,开始无气体产生,产生气体的体积V(CO2)与加入盐酸的体积V(HCl)的关系为图(3);(2)图溶液M中的溶质是NaHCO3和Na2CO3的混合物;(4)图溶液M中的溶质是NaOH和Na2CO3的混合物。
思维模型 依据图像特点判断CO2与氢氧化钠溶液反应后溶液成分的方法
1.焰色试验 焰色试验是元素的性质很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色,根据火焰呈现的 ,可以判断试样所含的 元素,化学上把这样的定性分析操作称为焰色试验。
2.操作步骤 两者在焰色试验时,火焰为无色。焰色试验一般采用铂丝或光洁无锈的铁丝
3.几种常见金属元素的焰色 重点记忆钠和钾的焰色
4.应用(1)检验金属元素的存在,如鉴别NaCl和KCl溶液。(2)利用焰色试验制节日烟火。
名师点拨(1)不是所有的金属都可呈现焰色,金属单质与它的化合物的焰色颜色相同。(2)观察钾的焰色时,要透过蓝色钴玻璃观察,这样可以滤去黄光,避免其中含钠杂质所产生的黄色光的干扰。特别提醒用稀盐酸清洗铂丝而不用稀硫酸的原因:铂丝表面的杂质与盐酸反应生成沸点较低的氯化物易汽化挥发,而硫酸盐的沸点较高不易汽化挥发。记忆技巧焰色记忆口诀钠黄(色)钙砖红(色)锂紫红(色),钾紫色钡黄绿(色),锶为洋红最美丽。
探究角度 焰色试验及应用例题 (2024·江苏苏州高一检测)焰色试验过程中铂丝的清洗和灼烧与钾的焰色试验的观察两项操作如图所示。下列叙述中正确的是( )
A.焰色试验是一种化学变化B.铁丝会和盐酸反应,所以它不能代替铂丝进行焰色试验C.焰色试验可以检验所有的金属元素D.若某无色溶液的焰色试验不用蓝色钴玻璃直接观察到焰色为浅紫色,则说明该溶液只含K+无Na+
解析 焰色试验不是一种化学变化,故A错误;铁的焰色几乎为无色,铁丝能代替铂丝进行焰色试验,故B错误;焰色反应只能用来检验某些有特征焰色的金属元素的存在,不能检验所有金属元素,故C错误;若某无色溶液的焰色试验不用蓝色钴玻璃直接观察到焰色为浅紫色,说明无Na+干扰,则说明该溶液只含K+无Na+,故D正确。
[对点训练]进行焰色试验时,通常用来洗涤铂丝的是( )A.硫酸B.烧碱溶液C.稀盐酸D.蒸馏水
解析 清洗是为了洗去杂质氧化膜,用稀盐酸洗过之后通常都要在酒精灯火焰上灼烧,因为金属氯化物沸点低,容易汽化,易挥发,所以杂质离子就一并挥发了。而硫酸是难挥发性酸,不能达到目的。
学以致用•随堂检测全达标
题组1焰色试验1.下列有关焰色试验叙述错误的是( )A.氯化钠在火焰上灼烧时,火焰呈黄色B.焰色试验是金属单质的特性C.连续做两个样品时,应将铂丝用盐酸洗净并灼烧至无色D.可用洁净的铁丝代替铂丝做焰色试验
解析 钠元素的焰色试验为黄色,A正确;焰色试验是元素的性质(单质和化合物均可以),B错误;在焰色试验操作中洗净铂丝时用盐酸,C正确;在实验室中可以用铁丝代替铂丝,D正确。
2.(2024·山东临沂高一检测)小明同学用洁净的铂丝蘸取某无色溶液在酒精灯外焰上灼烧,火焰呈黄色,通过该实验现象,下列四位同学对该溶液中存在的金属离子判断正确的是( )
解析 钠元素的焰色试验为黄色,钾元素的焰色试验为紫色,观察钾元素的焰色试验时需透过蓝色钴玻璃。根据题中现象只能确定有Na+,而不能确定K+的存在。
题组2碳酸钠、碳酸氢钠的鉴别3.(2024·广东珠海高一检测)有两瓶失去标签的Na2CO3溶液和NaHCO3溶液,它们的浓度相同,下列一定不可用于区别这两种溶液的是( )A.酚酞溶液B.pH试纸C.盐酸D.澄清石灰水
解析 浓度相同的Na2CO3溶液和NaHCO3溶液,Na2CO3溶液的碱性强,滴入酚酞溶液,颜色更深,故可以用酚酞溶液鉴别,故A不符合;Na2CO3溶液的碱性强,用pH试纸鉴别时,滴有Na2CO3溶液的pH试纸颜色更深,可鉴别,故B不符合;分别向Na2CO3溶液和NaHCO3溶液中逐滴加入盐酸时,Na2CO3溶液中开始时没有气泡产生,后有气泡产生,NaHCO3溶液中立即有气泡产生,可鉴别,故C不符合;向Na2CO3溶液中加入澄清石灰水发生反应Ca2++ ══ CaCO3↓,生成碳酸钙白色沉淀,向NaHCO3溶液中加入澄清石灰水,氢氧根离子与碳酸氢根离子先反应生成碳酸根离子,再发生反应Ca2++ ══ CaCO3↓,生成碳酸钙白色沉淀,不能鉴别,故D符合。
题组3碳酸钠、碳酸氢钠的性质比较与应用4.为使以面粉为原料的面包松软可口,通常用碳酸氢钠作膨松剂,因为它①热稳定性差、②增加甜味、③产生二氧化碳、④提供钠离子。其中合理的是( )A.②③B.①③C.①④D.③④
解析 从题意中面包松软可口,作膨松剂可得出热稳定性差,产生二氧化碳气体,故B正确。
5.除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是( )A.通入二氧化碳气体B.加入氢氧化钡溶液C.加入澄清石灰水D.加入稀盐酸
解析 碳酸钠在溶液中能吸收CO2生成碳酸氢钠,所以可采取的方法是通入二氧化碳气体。
6.Na2CO3和NaHCO3是重要的化工原料,请回答:(1)两物质的水溶液分别与足量盐酸混合,反应的离子方程式分别为 、 。 (2)除去NaHCO3溶液中少量Na2CO3的方法,写出化学方程式: 。 (3)Na2CO3和NaHCO3的焰色试验分别为 色、 色。 (4)检验某盐中含有钾元素的方法是 ,具体操作为 。
Na2CO3+CO2+H2O ══ 2NaHCO3
用洁净的铂丝蘸取样品,在无色火焰上灼烧,透过蓝色钴玻璃观察,有紫色火焰则证明样品含有钾元素
相关课件
这是一份高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第一节 钠及其化合物作业课件ppt,共37页。PPT课件主要包含了答案D,答案A,NaHCO3,NH3,稀盐酸,稀硫酸等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第一节 钠及其化合物教学演示课件ppt,共23页。PPT课件主要包含了夯基提能·一遍过,浅红色,制玻璃,焙制糕点,答案B,答案D,小苏打,焰色试验等内容,欢迎下载使用。
这是一份人教版 (2019)第二章 海水中的重要元素——钠和氯第一节 钠及其化合物教案配套课件ppt,共33页。PPT课件主要包含了第一节钠及其化合物,碳酸钠和碳酸氢钠,白色粉末,结块变成晶体,变浅红,不变浑浊,不易发生,变浑浊,不稳定,发酵粉等内容,欢迎下载使用。









