




鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质章末复习课课件
展开
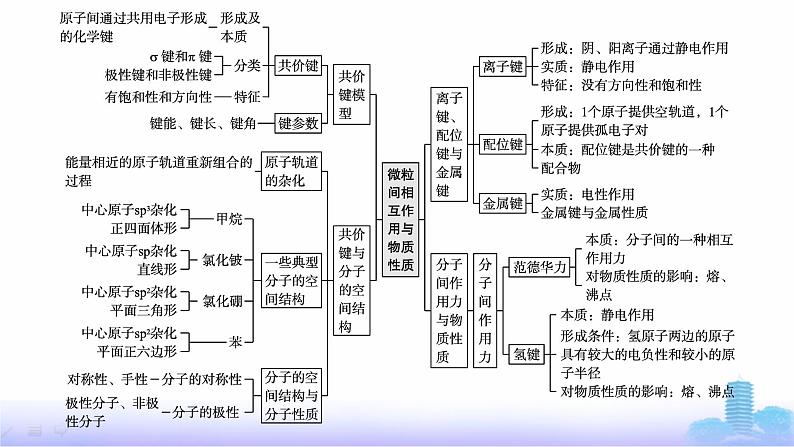
这是一份鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质章末复习课课件,共15页。
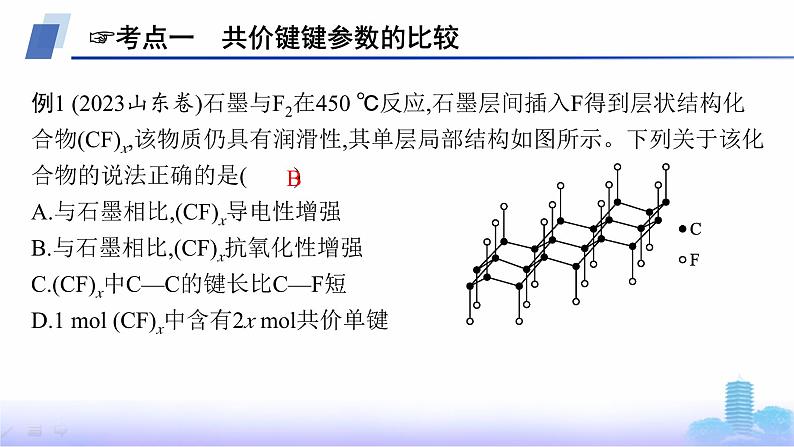
章 末 复 习 课知识整合体系构建综合提升高考体验目 录 索 引 知识整合体系构建综合提升高考体验☞考点一 共价键键参数的比较例1 (2023山东卷)石墨与F2在450 ℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具有润滑性,其单层局部结构如图所示。下列关于该化合物的说法正确的是( )A.与石墨相比,(CF)x导电性增强B.与石墨相比,(CF)x抗氧化性增强C.(CF)x中C—C的键长比C—F短D.1 mol (CF)x中含有2x mol共价单键B解析 石墨导电的原因是石墨层间有自由移动的电子,石墨层间插入F得到层状结构化合物(CF)x后,可自由移动的电子减少,导电性减弱,A错误;石墨层间插入F后形成的C—F键极短,键能极大,分子结构稳定性增强,抗氧化性增强,B正确;随原子序数递增,同周期主族元素的原子半径逐渐减小,因此(CF)x中C—C的键长比C—F长,C错误;由题图知,(CF)x中每个碳原子形成3个C—C键、1个C—F键,其中每个C—C键被2个碳原子共用,则1 mol (CF)x中含有2.5x mol共价单键,D错误。☞考点二 中心原子杂化类型判断例2 (2023福建卷改编)抗癌药物CADD522的结构如图。关于该药物的说法错误的是( )A.分子式为C15H13Cl2NO3B.含有2个手性碳原子C.能使Br2的CCl4溶液褪色D.碳原子杂化方式有sp2和sp3B解析 由结构可知,A正确; 标注*这4个碳原子各连有4个各不相同的原子或基团,因此为手性碳原子,B错误;分子中含有碳碳双键,因此能使Br2的CCl4溶液褪色,C正确;分子中双键碳原子为sp2杂化,饱和碳原子为sp3杂化,D正确。☞考点三 分子的空间结构判断例3 (2023广东卷)化合物XYZ4ME4可做肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为nsn-1,X与M同周期,E在地壳中含量最多。下列说法正确的是( )A.元素电负性:E>Y>ZB.氢化物沸点:M>Y>EC.第一电离能:X>E>YD.YZ3和 的空间结构均为三角锥形A解析 E在地壳中含量最多为氧元素,X的基态原子价层电子排布式为nsn-1,所以n-1=2,n=3,X为镁或者n=2,X为锂,Y的基态原子价层p轨道半充满,所以可能为氮或磷,Y和M同族所以为磷或氮,根据X与M同周期、5种元素在每个短周期均有分布,可确定Z为氢元素,又仅有Y和M同族,可知M为磷元素、X为镁元素、E为氧元素、Y为氮元素。元素电负性:氧大于氮大于氢,A正确;氨、水中都存在氢键沸点高,磷化氢没有氢键沸点低,所以氢化物沸点:E>Y>M,B错误;同周期第一电离能自左向右总趋势逐渐增大,当出现ⅡA族和ⅤA族时比左右两侧元素电离能都要大,所以氮大于氧大于镁,C错误;NH3中心原子价电子对数为3+1=4,有一对孤电子对,空间结构为三角锥形, 中心原子价电子对数为3+0=3,没有孤电子对, 空间结构为平面三角形,D错误。☞考点四 分子的极性判断例4 (2023山东卷)下列分子属于极性分子的是( )A.CS2 B.NF3C.SO3 D.SiF4B解析 CS2与CO2分子的空间结构一样,为直线形,且二者正电重心和负电重心重合,故属于非极性分子,A项不符合题意;NF3与NH3结构类似,其空间结构为三角锥形,属于极性分子,B项符合题意;SO3分子中,中心S原子采取sp2杂化,SO3分子的空间结构为平面正三角形,属于非极性分子,C项不符合题意;SiF4分子的空间结构为正四面体形,属于非极性分子,D项不符合题意。☞考点五 配位键的判断 中的中心原子S的价电子对数为4,无孤电子对,不能做配位原子;端基S原子含有孤电子对,能做配位原子☞考点六 氢键的判断例6 (2023山东卷)抗生素克拉维酸的结构简式如图所示,下列关于克拉维酸的说法错误的是( )A.存在顺反异构B.含有5种官能团C.可形成分子内氢键和分子间氢键D.1 mol该物质最多可与1 mol NaOH反应D解析 该有机物分子中碳碳双键的两个碳原子上分别连有两个不同的原子或原子团,存在顺反异构,A项正确;该有机物分子中含有酰胺基、羧基、羟基、碳碳双键、醚键5种官能团,B项正确;该有机物分子中含有羟基和羧基,因此可以形成分子内氢键和分子间氢键,C项正确;因为该有机物分子中含有的羧基和酰胺基均能与NaOH发生反应,所以1 mol该物质最多可与2 mol NaOH反应,D项错误。





