






中职化学高教版(2021)化学通用类第二节 常见金属单质及其化合物一等奖教学ppt课件
展开4.1 金属的共性
金属具有共性是因为在金属晶体内部存在一种特殊的化学键——金属键。金属元素原子结构的特点是最外层电子数较少(一般为1~3个,少数除外),容易失去电子,这样金属内部就交替排列着金属原子和金属阳离子。从金属原子上脱落的能够自由移动的电子在金属原子和金属阳离子之间来回移动,当遇到金属阳离子时会与其结合形成金属原子;而金属原子在外界能量和金属阳离子的作用下又会失去电子形成自由电子,这种过程不断循环,使金属原子和金属阳离子紧密结合在一起而形成金属晶体。我们把这种通过自由电子的移动,使金属原子和金属阳离子相互连接在一起的化学键,称为金属键。
4.1.1 金属的物理性质
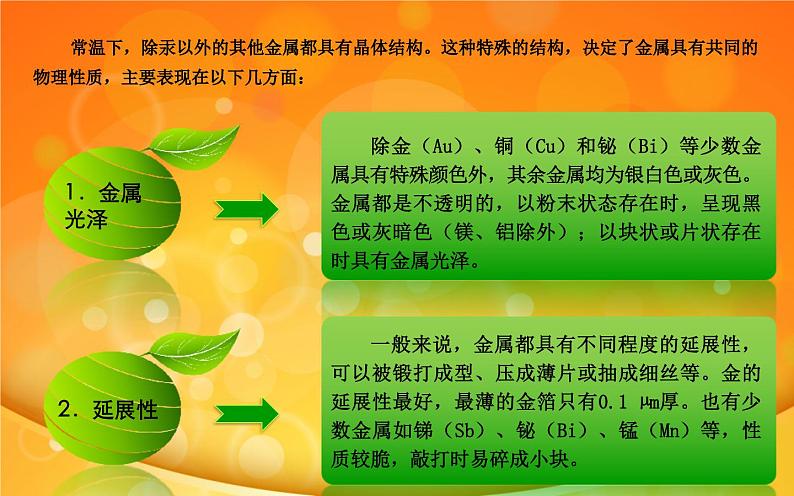
常温下,除汞以外的其他金属都具有晶体结构。这种特殊的结构,决定了金属具有共同的物理性质,主要表现在以下几方面:
除金(Au)、铜(Cu)和铋(Bi)等少数金属具有特殊颜色外,其余金属均为银白色或灰色。金属都是不透明的,以粉末状态存在时,呈现黑色或灰暗色(镁、铝除外);以块状或片状存在时具有金属光泽。
一般来说,金属都具有不同程度的延展性,可以被锻打成型、压成薄片或抽成细丝等。金的延展性最好,最薄的金箔只有0.1 µm厚。也有少数金属如锑(Sb)、铋(Bi)、锰(Mn)等,性质较脆,敲打时易碎成小块。
大多数金属都具有良好的导电导热性。一般导电性好的金属,导热性也好。导电导热性排在前4位的金属是银(Ag)、铜(Cu)、金(Au)和铝(Al)。银的导电性最好,但其价格过高、产量也低,所以电气工业上常用的是铜和铝。铜和铝也是很好的导热材料,广泛应用于热交换器、散热材料及日用炊具等。
大多数金属的密度和硬度较大,熔点较高。
4.1.2 金属的化学性质金属最重要的化学性质就是易失去外层电子,变成金属阳离子而表现出还原性。例如,金属可以与非金属、氧气和酸等发生反应。由于金属失去电子的难易程度不同,所以各种金属还原性的强弱也不同,化学活动性强弱自然也不同。对于金属的化学性质,后面将结合不同物质进行具体分析判断。
4.2 常见金属单质
钠是一种银白色的金属,熔沸点低,密度小(0.97 g/cm3),属于轻金属。钠质地柔软,可以用小刀切割,具有良好的导电、导热性。钠可以作为还原剂,用于冶炼稀有金属,也广泛应用于电光源上。例如,高压钠灯发出的黄光射程非常远,透雾能力强,用作路灯时,亮度比高压水银灯高好几倍。
4.2.1 钠1.钠的物理性质
用镊子取一小块金属钠,用滤纸吸干其表面的煤油,然后用刀切去一端的外皮,观察钠断面的光泽和颜色。
2.钠的化学性质(1)与氧的反应观察上页PPT的实验可以看到,新切开的光亮的金属钠的断面很快失去光泽并变暗,这主要是生成了一层薄氧化物的缘故。过氧化钠可用于航空、航天器等呼吸面具中作为氧气的来源,这是因为过氧化钠能与人们呼出的二氧化碳反应生成氧气,这样可以减少因缺氧而引发的窒息。
(2)与水的反应碱金属都能与水反应,锂与水的反应较为缓和,并且不熔化;钠与水反应较剧烈,反应放出的热使钠熔化成一个白色的小球(如下图为钠与水反应的情况);钾与水的反应更剧烈,产生的氢气能燃烧。
通过观察实验现象可以看出:钠的密度比水小(浮在水面上);钠的化学性质比较活泼,能与水发生剧烈的反应,并放出热量,放出的热量使钠块熔成小球;反应后得到的溶液呈碱性(溶液显红色),并有气体生成。
将绿豆大小的金属钠投入滴有酚酞的水中(下图),观察反应现象和溶液颜色的变化。
实验室里一般将钠保存在密度较小的煤油中,以隔绝氧气和水。
单质铝是银白色金属,密度为2.7 g/cm3,较软,熔点为660℃,具有良好的导电、导热性,工业上常用铝代替铜做导线、热交换器和散热材料等。铝的延展性也非常好,可抽成细丝,也可压成薄片成为铝箔,用来包装糖果、烟等。铝还能跟许多元素形成合金,因铝合金轻而坚韧,常被用于汽车、飞机和火箭等制造业和日常生活中。
4.2.2 铝1.铝的物理性质
2.铝的化学性质(1)与氧气反应(2)与酸反应(3)与碱反应(4)与金属氧化物的反应
4.2.3 铁1.铁的物理性质
铁是一种光亮的银白色金属,密度为7.86 g/cm3,相对原子质量55.847,熔点1 535℃,沸点2 750℃,有良好的延展性和导热性,也能导电。纯铁既能磁化,又可去磁,且均很迅速。铁是制造发电机和电动机必不可少的材料。铁也是生命过程所必需的元素,是红细胞(血红蛋白)的主要成分。
2.铁的化学性质纯铁化学性质比较活泼,常见化合价为+2和+3价。(1)与非金属反应 (2)与水反应在潮湿空气中,铁在H2O、O2、CO2等的共同作用下,易发生腐蚀而生锈,铁锈的主要成分是Fe2O3·nH2O。
(3)与盐溶液反应铁可从盐溶液中还原金(Au)、铂(Pt)、银(Ag)、汞(Hg)、铋(Bi)、锡(Sn)、镍(Ni)或铜(Cu)等离子。(4)与酸反应铁溶于非氧化性的酸(如盐酸或稀硫酸)中,形成二价铁离子并放出氢气;在冷的过量稀硝酸中则形成三价铁离子和硝酸铵。
4.3 常见金属化合物
4.3.1 常见金属氧化物和氢氧化物1.过氧化钠和氢氧化钠(1)过氧化钠过氧化钠(Na2O2)易吸潮,熔点约460℃熔化时仍然很稳定,但遇到棉花、纸张等有机物或镁粉、铝粉等还原性物质时,易发生燃烧或爆炸。过氧化钠遇水、稀酸或二氧化碳时会发生反应放出氧气。
(2)氢氧化钠硅酸钠的水溶液俗称水玻璃,能将玻璃黏合在一起。实验室存放氢氧化钠溶液的试剂瓶一般不用磨口玻璃塞,而用橡胶塞或软木塞。氢氧化钠是重要的化工原料之一,广泛用于造纸、肥皂、化学纤维、纺织和化工生产中。工业上通常使用电解食盐水的方法生产氢氧化钠。
氢氧化钠(NaOH),俗称烧碱、火碱、苛性钠,常温下是一种白色晶体,具有强腐蚀性。氢氧化钠易溶于水,溶解时放出大量热,其水溶液呈强碱性,能使酚酞变红。氢氧化钠在空气中易吸收水蒸气而潮解,所以常将氢氧化钠固体用作干燥剂。
2.氧化铝和氢氧化铝(1)氧化铝
Al2O3不溶于水,但新制的Al2O3能与酸或碱反应,生成盐和水。在上述两个反应中,Al2O3分别表现出了碱性氧化物和酸性氧化物的性质,所以Al2O3是两性氧化物。 (2)氢氧化铝氢氧化铝[Al(OH)3]是一种难溶于水的白色胶状物质,是典型的两性氢氧化物。它能凝聚水中的悬浮物,又有吸附色素的性能。
反应中得到的白色胶状沉淀是Al(OH)3,该反应的反应式为:
向一支盛有20 mL 0.5 ml/L Al2(SO4)3溶液的试管中,逐滴加入氨水,生成白色胶状沉淀,持续滴加氨水,直到不再产生沉淀为止。
实验发现,氢氧化铝能溶于酸,也能溶于碱,这说明它既能跟酸反应,又能跟碱反应,所以Al(OH)3是两性氢氧化物。它在溶液中以下列方式解离:
把实验1制得的Al(OH)3沉淀分成两份,分别装在2支试管中,在1支试管中滴加2 ml/L HCl溶液,在另一支试管中滴加2 ml/L NaOH溶液,振荡并观察实验现象。
3.铁的氧化物和氢氧化物(1)铁的氧化物
铁的氧化物有氧化亚铁(FeO)、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)等。氧化亚铁是一种黑色粉末,不稳定,在空气里加热即迅速被氧化成四氧化三铁。氧化铁是一种红棕色粉末,俗称铁红,可用作油漆的颜料。四氧化三铁是具有磁性的黑色带瓦蓝色晶体,俗称磁性氧化铁,是磁铁矿的主要成分。在四氧化三铁晶体里存在着铁的两种不同价态的离子,其中1/3是Fe2+,2/3是Fe3+。因此,四氧化三铁可以看成是氧化亚铁和氧化铁组成的化合物,化学式可写成“FeO·Fe2O3”。四氧化三铁是一种复杂的化合物,可以由铁在纯氧气中燃烧得到,耐高温,耐腐蚀,通常作为枪炮内镗的涂层。
(2)铁的氢氧化物氢氧化铝铁有两种氢氧化物,氢氧化亚铁[Fe(OH)2]和氢氧化铁[Fe(OH)3]。纯氢氧化亚铁是白色难溶于水的弱碱,可以由亚铁盐和碱反应得到。由于溶液中溶解有氧气且反应体系(开放性的体系)与外界存在着物质交换与能量交换,不断有空气中的氧气溶解到溶液中,新生成的氢氧化亚铁很快就被氧化成氢氧化铁。 Fe(OH)3为棕红色难溶于水的弱碱,也可以由铁盐和碱反应得到。 Fe(OH)3不稳定,受热易失水生成红棕色的Fe2O3粉末。
4.3.2 盐类1.碳酸钠和碳酸氢钠
碳酸钠(Na2CO3)俗名苏打或纯碱,普通情况下为白色粉末,为强电解质,易溶于水,具有盐的通性。碳酸氢纳(NaHCO3)俗名小苏打,为白色粉末或不透明细微结晶,可溶于水,微溶于乙醇。一般情况下,酸式盐比相应的正盐更易溶于水,但Na2CO3和NaHCO3则相反,Na2CO3比NaHCO3更易溶于水。它们的水溶液都因水解而呈碱性,但Na2CO3溶液的碱性比NaHCO3强。
(1)与酸反应(2)与碱反应Na2CO3不能与碱反应,但NaHCO3可与碱反应。(3)受热分解NaHCO3不稳定,受热易分解,一般利用此反应来区别Na2CO3和NaHCO3。
硫化氢氯化铁(FeCl3),又名三氯化铁,是黑棕色结晶,熔点282℃、沸点315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。FeCl3从水溶液析出时带六个结晶水,化学式为FeCl3·6H2O(六水合三氯化铁),是橘黄色晶体。
2.氯化铁和硫酸亚铁(1)氯化铁氯化铁在水溶液中易水解生成氢氧化铁沉淀。FeCl3具有氧化性,与较强的还原剂反应会被还原成亚铁盐;亚铁盐在较强氧化剂的作用下,又会被氧化成铁盐。例如:
硫酸亚铁,又名绿矾、七水硫酸亚铁、铁矾和青矾等,蓝绿色或颗粒,无气味,易溶于水。绿矾在干燥空气中会风化,在潮湿空气中表面会逐步被氧化成棕色的碱式硫酸铁,所以需保存在密闭容器中。绿矾可用于制铁盐、氧化铁颜料、媒染剂、净水剂、防腐剂和消毒剂等;医药上可作抗贫血药、局部收敛剂及补血剂,可用于子宫肌瘤引起的慢性失血;农业上可用作农药,防治小麦黑穗病、苹果和梨的疤痂病和果树的腐烂病等,也可用作肥料,作为植物铁元素的补充剂,防治植物因缺铁而发生生理性病害,如植物叶色失绿等。工业上可用于水的絮凝净化,以及从城市和工业污水中去除磷酸盐,以防止水体的富营养化,另外可被用作还原剂,还原水泥中的铬酸盐。
4.4 常见金属离子的检验
4.4.1 焰色反应
很多金属或其化合物在无色火焰中灼烧时,都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应。节日或有庆祝活动时燃放的焰火中,就含有金属钠、钾、钙、锶和钡等的化合物,由于不同金属的焰色反应呈现出不同的色彩,使焰火看起来五彩缤纷,煞是好看,如右图所示。
隔着蓝色钴玻璃观察,可以发现含有钠离子的溶液火焰呈黄色;含有钾离子的溶液火焰呈紫色。利用焰色反应所呈现的特殊颜色,可以检验金属或金属离子的存在,下表列出了几种常见金属或金属离子焰色反应的颜色。
取含有钾离子和钠离子的溶液各1滴,分别滴入点滴板的两个凹槽中,各加入1滴浓HCl。用洁净的铂丝分别蘸取试液,于无色灯焰中灼烧。
4.4.2 铁离子的检验(1) Fe3+与KSCN(硫氰化钾)溶液反应 (2)Fe3+与NaOH溶液反应
Fe3+遇到KSCN溶液会变成血红色,Fe2+遇到KSCN溶液不显红色。我们可以利用这一反应检验Fe3+的存在。
Fe3+ 与NaOH溶液反应产生红褐色沉淀,Fe2+遇NaOH溶液则产生白色沉淀。利用这一反应也可以检验Fe3+的存在。
中职化学高教版(2021)化学通用类第二节 常见金属单质及其化合物背景图ppt课件: 这是一份中职化学高教版(2021)化学通用类<a href="/hx/tb_c4034931_t3/?tag_id=26" target="_blank">第二节 常见金属单质及其化合物背景图ppt课件</a>,共41页。PPT课件主要包含了一金属氧化物,氧化钠与过氧化钠,观察与认知,氧化铝,铁的氧化物,二金属氢氧化物,氢氧化钠,氢氧化铝,铁的氢氧化物,三碳酸钠和碳酸氢钠等内容,欢迎下载使用。
高教版(2021)化学通用类第二节 常见金属单质及其化合物备课课件ppt: 这是一份高教版(2021)化学通用类<a href="/hx/tb_c4034931_t3/?tag_id=26" target="_blank">第二节 常见金属单质及其化合物备课课件ppt</a>,共38页。PPT课件主要包含了学习目标,观察与认知,一金属的通性,金属的物理性质,金属的分类,Na保存在煤油中,实验与探究,钠的用途,制Na2O2,核反应堆导热剂等内容,欢迎下载使用。
高教版(2021)化学通用类第一节 常见非金属单质及其化合物教学演示ppt课件: 这是一份高教版(2021)化学通用类<a href="/hx/tb_c4034930_t3/?tag_id=26" target="_blank">第一节 常见非金属单质及其化合物教学演示ppt课件</a>,共39页。PPT课件主要包含了学习目标,情境与问题,容易得到电子,具有氧化性,观察与认知,氯气的发现,初识氯气,①黄绿色气体,③比空气重15倍,1氯气的物理性质等内容,欢迎下载使用。












