


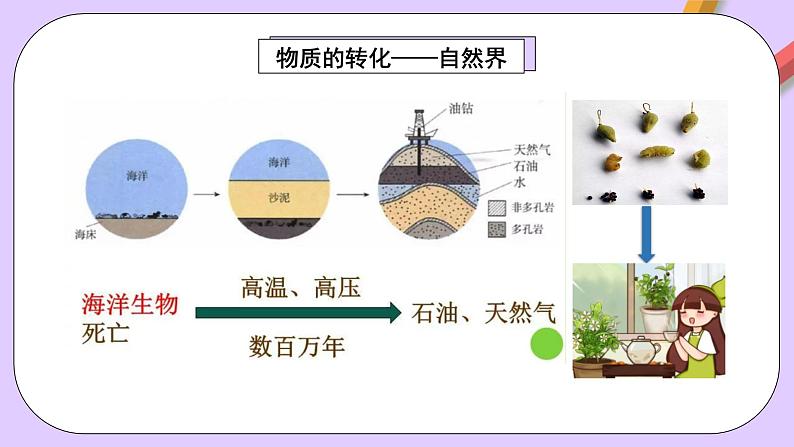
高中化学人教版 (2019)必修 第一册第一节 物质的分类及转化试讲课ppt课件
展开1.通过回顾初中酸、碱、盐的性质荷反应类型,结合教材中的“思考与讨论”等,进一步理解物质分类法的应用,更深入研究物质的制取方法。 2.通过对化学物质按组成和性质进行分类法的学习,进一步掌握酸、碱、盐、氧化物的概念及性质,理解化工生成过程中条件的选择原则,会预测在一定条件下某种物质能发生的化学变化。
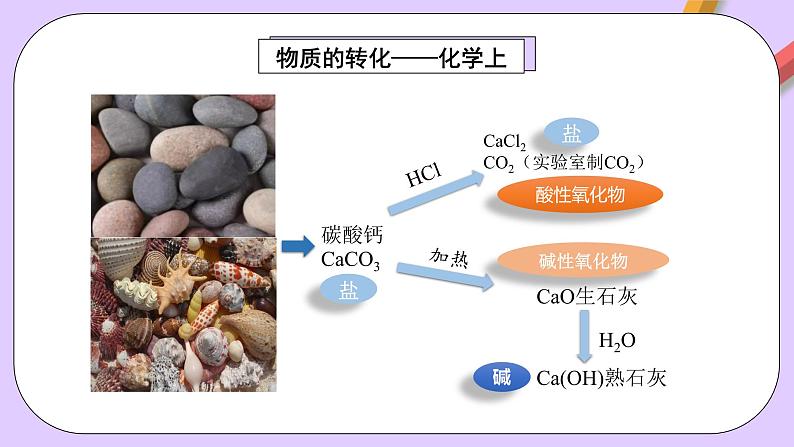
CaCl2CO2(实验室制CO2)
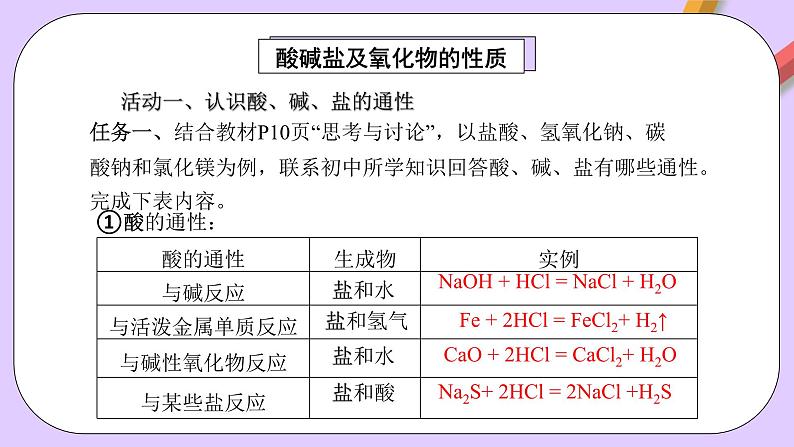
活动一、认识酸、碱、盐的通性
任务一、结合教材P10页“思考与讨论”,以盐酸、氢氧化钠、碳酸钠和氯化镁为例,联系初中所学知识回答酸、碱、盐有哪些通性。完成下表内容。
NaOH + HCl = NaCl + H2O
Fe + 2HCl = FeCl2+ H2↑
CaO + 2HCl = CaCl2+ H2O
Na2S+ 2HCl = 2NaCl +H2S
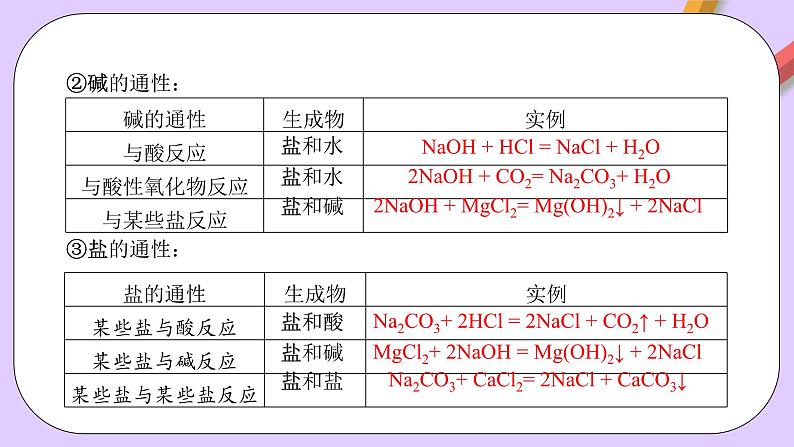
2NaOH + CO2= Na2CO3+ H2O
2NaOH + MgCl2= Mg(OH)2↓ + 2NaCl
Na2CO3+ 2HCl = 2NaCl + CO2↑ + H2O
MgCl2+ 2NaOH = Mg(OH)2↓ + 2NaCl
Na2CO3+ CaCl2= 2NaCl + CaCO3↓
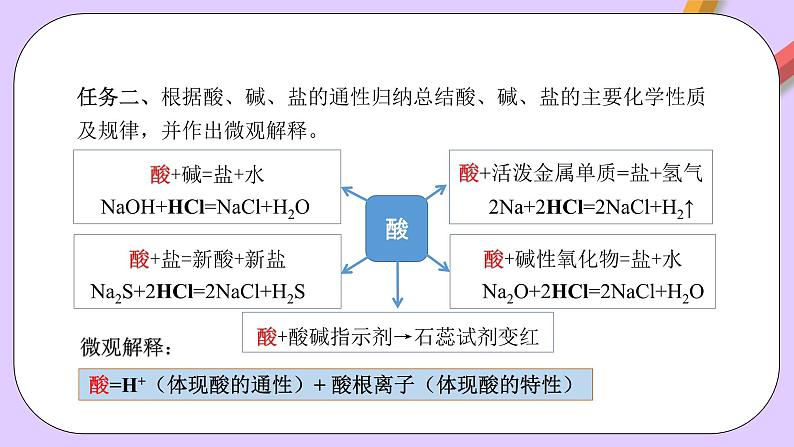
任务二、根据酸、碱、盐的通性归纳总结酸、碱、盐的主要化学性质及规律,并作出微观解释。
酸+活泼金属单质=盐+氢气 2Na+2HCl=2NaCl+H2↑
酸+碱性氧化物=盐+水 Na2O+2HCl=2NaCl+H2O
酸+碱=盐+水 NaOH+HCl=NaCl+H2O
酸+盐=新酸+新盐 Na2S+2HCl=2NaCl+H2S
酸+酸碱指示剂→石蕊试剂变红
酸=H+(体现酸的通性)+ 酸根离子(体现酸的特性)
碱+酸性氧化物=盐+水 2NaOH+SO2=2Na2SO3+H2O
碱+酸=盐+水 NaOH+HCl=NaCl+H2O
碱+盐=新碱+新盐 NaOH+CaCl2=Ca(OH)2+2NaCl
碱+酸碱指示剂→石蕊试剂变蓝或酚酞变红
碱=OH—(体现碱的通性)+金属离子或铵根离子(体现碱的特性)
盐+盐=两种新盐 Na2CO3+BaCl2=2NaCl+ BaCO3↓
盐+酸=新盐+新酸 Na2S+2HCl=2NaCl+H2S↑
盐+金属单质=新盐+新金属单质 CuCl2+Fe=FeCl2+Cu
盐+碱=新盐+新碱MgCl2+2NaOH=Mg(OH)2↓ + 2NaCl
盐=酸根离子+金属离子或铵根离子
【探究】不同的酸、碱、盐具有相似的化学性质的原因是什么?
HClH2SO4HNO3
NaOHKOHBa(OH)2
Na2CO3 K2CO3(NH4)2CO3
【典例1】下列性质中,不属于碱的通性的是( ) A.能与酸反应生成盐和水 B.能与酸性氧化物反应生成盐和水 C.能与某些盐反应生成新碱和新盐 D.能与金属反应放出氢气
【解析】能与酸反应生成盐和水,属于碱的通性,故A不符合;能与酸性氧化物反应生成盐和水,属于碱的通性,故B不符合;能与某些盐反应生成新碱和新盐,属于碱的通性,故C不符合;能与金属反应放出氢气,不属于碱的通性,故D符合;答案选D。
【典例2】盐是一种常见物质,下列物质通过反应可直接形成盐的是( )①金属单质 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸 A.①②③ B.①④⑥ C.②⑤⑥ D.①②③④⑤⑥
【解析】①金属单质与酸或某些盐溶液反应可直接生成盐,如铁与盐酸反应生成盐为氯化亚铁,①符合题意;②碱性氧化物能与酸反应可直接生成盐,如氧化钠与盐酸反应可直接生成氯化钠,②符合题意;③碱与酸、酸性氧化物、某些盐等可反应生成盐,如氢氧化钠与二氧化碳反应可直接生成碳酸钠,③符合题意;④非金属单质能与碱反应生成盐,如氯气与氢氧化钠反应生成氯化钠、次氯酸钠,④符合题意;⑤酸性氧化物能与碱反应生成盐,如二氧化碳与氢氧化钾反应生成碳酸钾,⑤符合题意;⑥酸能与碱、某些盐、碱性氧化物等反应生成盐,如盐酸与氢氧化钠反应生成氯化钠,⑥符合题意;综上所述,全部都能在一定条件下直接生成盐,答案为D。
活动二、探究氧化物的化学性质
任务一、讨论交流:酸性氧化物和碱性氧化物有哪些通性?
碱性氧化物+酸性氧化物→含氧酸盐 Na2O+SO3=Na2SO4
碱性氧化物+酸→含氧酸盐+水 CuO+2HNO3=Cu(NO3)2+H2O
碱性氧化物(易溶)+H2O→碱(易溶)K2O+H2O=2KOH CaO+H2O=Ca(OH)2
酸性氧化物+碱性氧化物→含氧酸盐 SO3+Na2O=Na2SO4
酸性氧化物+碱(可溶)→盐+水 CO2+2NaOH=Na2CO3+H2O
酸性氧化物(溶于水)+H2O→酸SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4
【讨论交流】酸性氧化物、碱性氧化物与金属氧化物和非金属氧化物有 何关系?
【温馨提示】①碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化物)。 ②酸性氧化物不一定是非金属氧化物(如Mn2O7是酸性氧化物);非金属氧化物也不一定是酸性氧化物(如CO、NO都不是酸性氧化物)。 ③酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、Fe2O3都不与水反应)。 ④与水反应生成酸的氧化物不一定是酸性氧化物(如NO2不是酸性氧化物);与水反应生成碱的氧化物不一定是碱性氧化物(如Na2O2不是碱性氧化物)。
任务二、问题探究:结合教材P10页“思考与讨论”(3),思考酸、碱、盐的主要化学性质中,涉及哪些化学反应?
AB+C=A+CB:Fe+CuSO4=Cu+FeSO4
AB+CD=AD+CB:NaOH+HCl=NaCl+H2O
酸+碱、盐+酸、盐+碱、盐+盐。
【温馨提示】①四种基本反应类型的分类方法是从形式上划分的,它不能较深入地反映化学反应的本质,也不能包括所有的化学反应。如:CO+CuO Cu+CO2不属于任何一种基本反应类型。 ②水溶液中复分解反应发生的条件:两种物质在溶液中能相互交换离子,只要有沉淀析出或有气体放出或有水生成这三个条件之一,就能发生复分解反应。注意:酸性氧化物与碱的反应,不属于复分解反应。如: Ca(OH)2+CO2=CaCO3↓+H2O(看着像却不是);碳酸盐与酸反应虽然生成了三种化合物,却属于复分解反应。
【典例1】下列有关氧化物的判断正确的是( ) A.凡是含氧的化合物均可称为氧化物 B.依据性质不同氧化物只能分为酸性氧化物和碱性氧化物 C.酸性氧化物都能与碱反应生成盐和水 D.金属氧化物一定是碱性氧化物
【解析】氧化物是指有两种元素组成,其中一种元素为氧元素,故A错误;依据性质不同氧化物只能分为酸性氧化物、碱性氧化物、两性氧化物,故B错误;能与碱反应生成盐和水的氧化物为酸性氧化物,故C正确;金属氧化物不一定是碱性氧化物,如五氧化二钒为酸性氧化物,故D错误;故选C。
【典例2】北京冬奥会或第24届冬季奥林匹克运动会将在2022年2月4日至2022年2月20日在中华人民共和国北京市和河北省张家口市联合举行。某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型是( ) A.分解反应 B.复分解反应 C.化合反应 D.置换反应
【解析】Fe与稀盐酸发生置换反应;稀盐酸与NaOH溶液发生复分解反应;NaOH溶液与CO2发生反应,可认为CO2先与水化合成碳酸,再与NaOH发生复分解反应; CO2与C发生化合反应生成CO,所以没有涉及的基本反应类型为分解反应,选A。
活动一、探究物质转化的规律
任务一、讨论交流:根据物质的性质和分类,结合教材P10页“思考与讨论”(1),请设计出将金属和非金属单质转化为盐的基本流程。
任务二、根据任务一的转化流程,以金属单质Na到Na2CO3、非金属单质S到CuSO4的转化为例,用图示归纳总结金属和非金属单质转化为盐及单质、氧化物、酸、碱、盐之间转化的基本规律。
②以硫、钠单质为例,归纳单质、氧化物、酸、碱、盐之间的转化关系。
任务三、讨论交流:根据任务二中各类物质的转化关系,思考化学物质在转化过程中要注意哪些问题?
①物质间发生转化往往需要一定的条件,一般为光照、加热(或高温)、催化剂、高压、点燃等。
②物质的通性不仅要注意一般情况,也要注意特殊情况。如金属+酸―→盐+氢气,但铜与盐酸就不反应,与其他酸反应也不产生氢气。
③盐和盐反应、盐和碱反应,反应物都必须是可溶性的。
④金属单质与盐溶液能够发生置换反应的条件是:活泼性强的金属置换活泼性弱的金属,前提条件是该活泼金属不与水反应。
【典例1】从物质类别的视角认识物质间的转化关系是学习化学的重要方 法之一。单质X经下图所示过程可转化为含氧酸W。下列说法正确的是( )A.X是金属钠 B.Y一定能使品红溶液褪色 C.W的浓溶液见光一定会分解 D.Z中氧元素的质量分数一定高于Y
【解析】X可能为C、S、N2。A项,若X是金属钠,则W为碱,故A项错误;若X为S,则Y为二氧化硫,能使品红溶液褪色,但是X不一定为S,故B项错误;若X为N2,则W为硝酸,浓硝酸见光分解,但X不一定为氮气,故C项错误;若X为C,则Y为一氧化碳,Z为二氧化碳;若X为S,则Y为二氧化硫,Z为三氧化硫;若X为N2,则Y为一氧化氮,Z为二氧化氮;故Z中氧元素的质量分数都高于Y,故D项正确;故选D。
【典例2】推理是学习化学的一种重要方法。以下推理正确的是( ) A.酸碱中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 B.碱中都含有氢氧根,所以碱中一定含有氢元素 C.酸能使紫色石蕊溶液变红,CO2通入紫色石蕊溶液后溶液变红,所以CO2是酸 D.碱能使无色酚酞溶液变红,所以能使无色酚酞溶液变红的都是碱
【解析】CuO与HCl反应,生成CuCl2和H2O,虽然产物为盐和水,但反应不属于中和反应,A项不正确;碱中含有氢氧根,氢氧根由氢元素和氧元素组成,所以碱中一定含有氢元素,B项正确;CO2通入紫色石蕊溶液后溶液变红,是由CO2与水反应生成的碳酸引起的,CO2不是酸,C项不正确;能使无色酚酞溶液变红的物质呈碱性,可能是碱,也可能是强碱弱酸盐(如碳酸钠),D项不正确;故选B。
活动二、物质转化的应用
任务一、阅读教材P11页第二自然段,思考如何利用物质间的转化关系制备所需要的物质?
①碱性氧化物与水反应②盐与另一种碱反应
①金属单质与非金属单质反应 ②盐与盐反应③酸性氧化物与碱性氧化物反应 ④酸与盐反应⑤碱与盐反应。
①酸性氧化物与水反②应盐与另一种酸反应
任务二、阅读教材P11页第三自然段,以制备氢氧化钠为例,说明在具体的生产过程中怎样选择更合适的途径。
①氧化钠与水反应②碳酸钠与氢氧化钙反应③电解饱和食盐水等④盐 (如 Na2CO3)与 碱 [如 Ca(OH)2]反应
反应的可能性、原料来源、成本高低、设备要求等方面来选择物质制备的适宜方法。
【典例1】下列物质中不能用化合反应的方法生成的是( ) ①Fe3O4 ②H2SiO3 ③Fe(OH)3 ④Cu(OH)2 ⑤FeCl2 ⑥CaSiO3 A.①③④⑥ B.②④ C.②④⑤ D.①②④
【解析】①可由铁在氧气中燃烧制得;② SiO2 不与水反应,无法通过化合反应制得硅酸;③Fe(OH)3 可由Fe(OH)2 氧化得到;④无法通过化合反应得到;⑤可由SiO2 和 CaO高温下反应得到;因此②④无法通过化合反应得到,答案选B。
【典例2】已知:物质X与Ca(OH)2在水溶液中能发生反应,反应的化学方程式如下:X+Ca(OH)2=Y+Cu(OH)2↓。下列分析错误的是( ) A.X肯定不可能是酸 B.X和Y的相对分子质量之差为24 C.X可能是单质,也可能是化合物 D.Y可以是CaCl2或Ca(NO3)2
【解析】反应X+Ca(OH)2=Y+Cu(OH)2↓为复分解反应,则X为可溶性铜盐,Y为X的酸根离子和钙离子结合而成的盐,据此回答。反应物中有酸时不可能生成Cu(OH)2沉淀, X肯定不可能是酸,A项正确;X为可溶性铜盐,Y为X的酸根离子和钙离子结合而成的盐,X和Y的相对分子质量之差为铜和钙的相对原子质量之差=64-40=24,B项正确;据分析,X不可能是单质,只可能是化合物,C项不正确;X为可溶性铜盐,Y为X的酸根离子和钙离子结合而成的盐, Y可以是CaCl2或Ca(NO3)2,D项正确;答案选C。
1.下列物质的分类以及性质分析正确的是( )
【解析】Na2O2为过氧化物,与酸反应生成盐、氧气和水,A项错误;Ca(ClO)2为盐,次氯酸的酸性弱于碳酸,则其水溶液与二氧化碳反应生成HClO,B项正确;Na2CO3为盐,C项错误;H2SO4与Ba(OH)2溶液发生中和反应和生成硫酸钡沉淀,D项错误;答案为B。
2.下列各选项中,不能满足如图一步关系选项是( )A.X为铜、Y为氧化铜、Z为硫酸铜 B.X为二氧化碳、Y氧气、Z为一氧化碳 C.X为碳酸钙、Y氧化钙、Z为氢氧化钙 D.X为氢氧化钠、Y氯化钠、Z为碳酸钠
【解析】铜与氧气反应生成氧化铜,氧化铜能与硫酸反应生成硫酸铜,硫酸铜溶液与铁反应生成铜,故A项不选;二氧化碳发生光合作用生成氧气,氧气与碳反应可生成一氧化碳,CO继续燃烧生成CO2,故B项不选;碳酸钙高温分解生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙与CO2反应生成碳酸钙,故C项不选;D.氢氧化钠与盐酸反应生成氯化钠,氯化钠不能直接转化生成碳酸钠,故D项选。故选D。
3.对于化学反应A+B===C+D的下列说法中,正确的是( )A.若生成物C、D有一种为单质,该反应一定是置换反应B.若生成物C、D分别为两种沉淀,A、B有可能为盐和碱C.若生成物C、D是盐和水,则A、B一定是酸和碱D.若生成物C、D是两种化合物,则A、B一定是化合物
【解析】由反应CO+CuO=CO2+Cu知,A项错误;由反应Ba(OH)2+CuSO4===BaSO4↓+Cu(OH)2↓知,B项正确;由反应CuO+H2SO4===CuSO4+H2O知,C项错误;由反应CH4+2O2=CO2+2H2O知,D项错误。
4.构建知识网络是一种重要的学习方法。如图是关于盐酸化学性质的知识网络图:“﹣”表示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质。若A、B、C分别属于不同类别的化合物,则A、B、C可能是( )A.CuO、Ba(OH)2、CuSO4 B.NaOH、HNO3、K2CO3C.KOH、FeCl3、Na2CO3 D.NaOH、Ba(NO3)2、H2SO4
【解析】盐酸不与硫酸铜反应,盐酸不能转化为氢氧化钡,氢氧化钡不与氧化铜反应,故A不符合题意;盐酸和氢氧化钠、碳酸钾都能反应,和硝酸银反应生成硝酸,硝酸和氢氧化钠、碳酸钾都能反应,故B符合题意;氯化铁和碳酸钠均为盐,属于相同类别的化合物,故C不符合题意;盐酸不能转化为硝酸钡,盐酸不与硫酸反应,氢氧化钠与硝酸钡不反应,故D不符合题意;故答案:B。
酸+碱=盐+水;酸+活泼金属单质=盐+H2;酸+碱性氧化物=盐+水;酸+某些盐=盐+酸;
碱+酸=盐+水;碱+酸性氧化物=盐+水;碱+某些盐=盐+碱;
某些盐+酸=盐+酸;某些盐+碱=盐+碱;某些盐+某些盐=盐+盐;
高中人教版 (2019)第一节 物质的分类及转化优质课件ppt: 这是一份高中人教版 (2019)<a href="/hx/tb_c161971_t3/?tag_id=26" target="_blank">第一节 物质的分类及转化优质课件ppt</a>,共33页。PPT课件主要包含了物质的性质,酸的通性,碱的通性,盐的通性,氧化物的主要性质,物质的转化等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 物质的分类及转化优秀课件ppt: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161971_t3/?tag_id=26" target="_blank">第一节 物质的分类及转化优秀课件ppt</a>,共33页。PPT课件主要包含了物质的性质,酸的通性,碱的通性,盐的通性,氧化物的主要性质,物质的转化等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 物质的分类及转化教学ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第一节 物质的分类及转化教学ppt课件,文件包含第1课时初步认识比热容pptx、加热水和煤油mp4、比较水沙石的比热容mp4、比较金属的比热熔冰mp4、水和煤油的吸热能力对比mp4、水和煤油的吸热能力对比swf等6份课件配套教学资源,其中PPT共23页, 欢迎下载使用。













