




人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应优质课ppt课件
展开1.通过微观动画演示,联系强酸、强碱和盐与弱酸、弱碱溶液电离方程式的不同书写,认识不同电解质在溶液中的电离程度不同,从而将电解质分为强电解质和弱电解质,理解强弱电解质与物质类别的关系,能识别强弱电解质及应用。 2.通过回顾电解质在溶液中发生复分解反应的条件,小组讨论交流,了解离子共存的本质及条件,掌握复分解型离子共存与不共存的判断方法。 3.通过问题探究、归纳总结、教师引导,能利用离子的特征反应和共存规律(或典型代表物的性质和反应),初步学会鉴别和推断一些常见离子的基本方法。
近期,环境保护组织对某市相邻甲、乙两企业排出的废水进行了检测,发现甲企业的废水中含有下列几种离子:K+、SO42-、CO32-、Cl-。乙企业的废水中含有大量Ba2+、NO3-,若将这两种废水混合,废水的污染性明显降低,这是什么原因呢?通过本节课的学习,我们就可以回答这一问题。
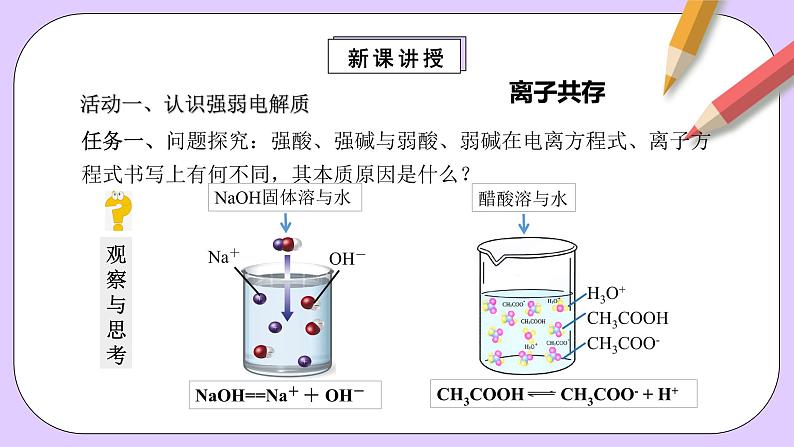
任务一、问题探究:强酸、强碱与弱酸、弱碱在电离方程式、离子方程式书写上有何不同,其本质原因是什么?
活动一、认识强弱电解质
NaOH==Na+ + OH-
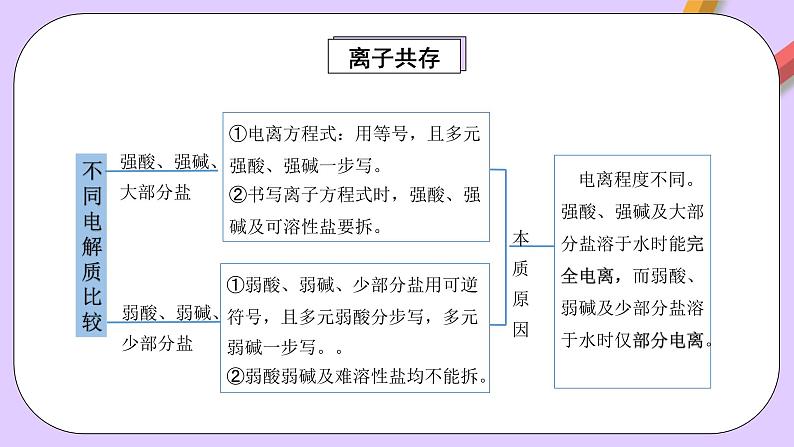
①电离方程式:用等号,且多元强酸、强碱一步写。②书写离子方程式时,强酸、强碱及可溶性盐要拆。
①弱酸、弱碱、少部分盐用可逆符号,且多元弱酸分步写,多元弱碱一步写。。②弱酸弱碱及难溶性盐均不能拆。
电离程度不同。强酸、强碱及大部分盐溶于水时能完全电离,而弱酸、弱碱及少部分盐溶于水时仅部分电离。
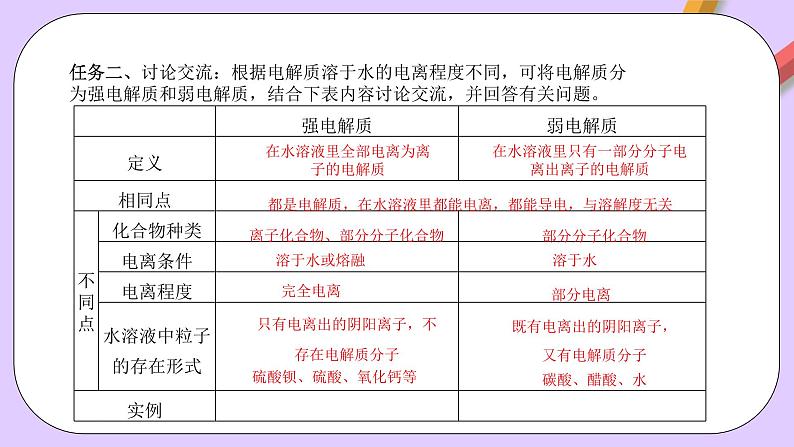
任务二、讨论交流:根据电解质溶于水的电离程度不同,可将电解质分为强电解质和弱电解质,结合下表内容讨论交流,并回答有关问题。
在水溶液里全部电离为离子的电解质
在水溶液里只有一部分分子电离出离子的电解质
都是电解质,在水溶液里都能电离,都能导电,与溶解度无关
离子化合物、部分分子化合物
只有电离出的阴阳离子,不存在电解质分子
既有电离出的阴阳离子,又有电解质分子
硫酸钡、硫酸、氧化钙等
①电解质的强弱由物质的内部结构决定,与其溶解性无关。某些难溶于水的化合物,如BaSO4、AgCl,虽然它们的溶解度很小,但溶解的部分是完全电离的,所以是强电解质。 ②电解质的强弱与溶液的导电性无直接联系。溶液导电能力强的,溶质不一定是强电解质,导电能力差的,溶质未必是弱电解质,溶液的导电能力与溶液中离子浓度及离子所带电荷数有关。 ③强酸、强碱、大部分盐(不论难溶、易溶)都是强电解质;弱酸、弱碱、少部分盐都是弱电解质。
【典例1】关于强、弱电解质叙述正确的是( ) A.强电解质都是离子形成的化合物,弱电解质都是共价化合物 B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 D.强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱
【解析】A项,部分共价化合物是强电解质;B项强电解质有些是难溶性的,如BaSO4;C项,强电解质在水中完全电离无溶质分子,弱电解质在水中部分电离,有溶质分子。D项,水溶液的导电能力取决于溶液中离子浓度大小,与电解质的强弱无关。
【典例2】下列物质中的分类组合正确的是( )
【解析】CaCO3应为强电解质,Cu既不是电解质,也不是非电解质,H2O是极弱的电解质。
活动二、探究离子的共存
任务一、思考交流:结合离子反应发生的条件,想一想离子共存的本质及不共存的条件是什么?
几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
①离子间反应生成沉淀(难溶物或微溶物)的离子不能大量共存。②离子间反应生成气体也不能大量共存。③离子间反应有难电离的物质生成,则不能大量共存。
任务二、拓展探究:在判断离子是否大量共存时,还可能有哪些条件需要考虑?
离子能否大量共存的判断
③无色透明溶液中,不存在有色离子。如Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、MnO4-(紫红色)等。“透明溶液”意味着无难溶物和微溶物,但并不意味着溶液无色。弱酸的酸式酸根离子在较强的酸性与碱性环境中都不能大量共存。
②(强)酸性溶液(pH=1、pH<7、紫色石蕊试液变红等)中,不能存在与H+起反应的离子。
①(强)碱性溶液(pH=13、pH>7、紫色石蕊试 液变蓝、酚酞变红)中,不能存在与OH-起反应的离子。
任务三:应用探究:甲(含K+、SO42-、CO32-、Cl-等离子)、乙(含Ba2+、NO3-等离子)两企业排出的废水混合,废水的污染性明显降低了吗?
【结论】SO42-、Ba2+两种离子不能共存,会生成BaSO4白色沉淀,可有效降低重金属Ba2+的浓度:Ba2++SO42-==BaSO4↓;CO32-与H+不能共存,反应生成了CO2气体:CO32-+2H+==CO2↑+H2O,可有效降低H+的浓度(酸污染)。因此,甲、乙两企业排出的废水混合,可以降低或消除环境污染。
【典例1】下列各组离子在溶液中可大量共存的是( ) A.Ba2+、NO3-、H+、SO42- B.K+、Cl-、CO32-、Na+ C.H+、NO3-、Na+、CO32- D.NH4+、SO42-、K+、OH-
【解析】选项A中的Ba2+与SO42-反应生成硫酸钡沉淀,二者不能大量共存;选项C中的H+与CO32-反应生成二氧化碳气体和水,二者不能大量共存;选项D中的NH4+与OH-反应生成难电离的弱碱一水合氨,二者不能大量共存。
【典例2】常温下,下列各组离子能在指定条件下大量共存的是( ) A.透明的溶液中:K+、SO42-、Mg2+、OH- B.滴加石蕊试液变红的溶液中:H+、Na+、Cl-、CO32- C.无色溶液中:NH4+、MnO4-、K+、Cl- D.使酚酞变红的溶液中:Ba2+、Na+、OH-、Cl-
【解析】A.Mg2+和OH-会产生沉淀,故A不符合题意;B.H+和CO32-会产生气体,故B不符合题意;C.MnO4-是紫色,故C不符合题意;D.使酚酞变红的溶液中:Ba2+、Na+、OH-、Cl-都共存,故D符合题意。综上所述,答案为D。
活动一、探究离子的检验方法
任务一、思考讨论:离子的检验有哪些基本的方法,应遵循什么原则?
根据性质不同实验现象不同分三种类型:①生成沉淀(如检验SO42-)、②生成气体(如检验SO32-)、③显现特殊颜色(如检验有色离子或生成特殊颜色物质)等。
做某溶液的焰色反应实验,火焰呈黄色,溶液中一定存在Na+,也可能存在K+,因为钾的焰色反应必须透过蓝色钴玻璃才能观察到。
四原则:肯定性原则:根据题干或实验现象确定物质;否定性原则:根据已确定的物质结合反应排除不存在的物质;引入性原则:实验过程中物质的引入对推断物质的干扰。电中性原则:溶液中一定为电中性,阴、阳离子带的电荷数相等。
任务二、讨论交流:根据离子的检验方法,联系物质的性质,讨论交流如何检验Cl-、SO42-、CO32-、SO32-、NH4+、Cu2+、Fe3+等离子?并完成下表内容。
AgNO3溶液和稀HNO3
产生白色沉淀:Ag++Cl-==AgCl↓(白色)
稀盐酸和BaCl2溶液
加盐酸无明显现象,加BaCl2溶液产生白色沉淀:Ba2++SO42-==BaSO4↓(白色)
稀H2SO4和品红溶液
CaCl2溶液和稀盐酸
①NaOH溶液;②KSCN溶液♦
①产生红褐色沉淀:Fe3++3OH-==Fe(OH)3↓(红褐色) ②溶液呈色:Fe3++3SCN-==Fe(SCN)3(红色)
产生蓝色沉淀:Cu2++2OH-==Cu(OH)2↓(蓝色)
加CaCl2溶液产生白色沉淀,再加盐酸沉淀溶解,产生无色无色无味的气体:Ca2++CO32-==CaCO3↓(白色)、CaCO3+2H+==Ca2++CO2↑+H2O
加硫酸产生有刺激性气味的气体,且气体能使品红溶液褪色:SO32-+2H+==SO2↑+H2O
任务三、应用探究:如何除去粗盐中的Ca2+、Mg2+、SO42-?写出实验步骤所加试剂及离子方程式。
【基本思路】第①步:加NaOH溶液过滤 :Mg2++2OH-===Mg(OH)2↓ ; 第②步:加BaCl2溶液过滤:SO42-+Ba2+===BaSO4↓;第③步:加Na2CO3溶液过滤:CO32-+Ba2+===BaCO3↓,CO32-+Ba2+===BaCO3↓;第④步:加盐酸:CO32-+2H+===CO2↑+H2O、H++OH- === H2O。
【基本原则】① 除杂试剂应过量;②过量试剂要在后续步骤中除去,不能引入新杂质;③BaCl2溶液应加在Na2CO3溶液之前,盐酸最后加。
【典例1】下列对离子检验的实验过程的评价正确的是( ) A.向溶液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀,则该溶液中一定含有SO42- B.向溶液中先滴加BaCl2溶液,再滴加盐酸,生成白色沉淀,则该溶液中一定含有SO42- C.向溶液中滴加稀硫酸,产生气泡,则该溶液中一定含有CO32- D.向溶液中先滴加硝酸酸化,再滴加AgNO3溶液,生成白色沉淀,则该溶液中一定含有Cl-
【解析】A.向溶液中滴加盐酸酸化的BaCl2溶液,无法排除Ag+的干扰,A错误;B.向溶液中先滴加BaCl2溶液,再加盐酸,无法排除Ag+的干扰,B错误;C.向溶液中滴加稀硫酸,产生气泡,则该溶液也可能含有HCO3(-) ,C错误;D.向溶液中先滴加硝酸酸化,再滴加 AgNO3 溶液,生成白色沉淀,则该溶液中一定含有 Cl-,D正确;答案选D。
【典例2】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
【解析】本题主要考查常见离子的鉴别,意在考查学生的实验能力。A项,加入BaCl2溶液得到白色沉淀,原溶液中可能含有SO42-或SO32-或Ag+;B项,溶于CCl4呈紫色的为I2,即原溶液中含有I-;C项,观察K+的焰色反应应透过蓝色钴玻璃,排除Na+的干扰;D项,检验NH4+应加入浓NaOH溶液,且需要加热。
活动二、探究离子的推断
任务一、讨论交流:假设我们要确定溶液中是否存在某种离子,你认为在设计方案时应注意哪些问题(原则)?
①肯定原则:根据实验现象推出溶液中肯定存在或肯定不存在的离子(记住几种常见的有色离子:Fe2+、Fe3+、Cu2+、MnO4-、CrO42-、Cr2O72-。
②互斥原则:在肯定某些离子存在的同时,结合离子共存规律,否定一些离子的存在(注意题目中的隐含条件,如酸性、碱性、指示剂的颜色变化等)。
③电中性原则:溶液呈电中性,溶液中有阳离子,必有阴离子,且溶液中阳离子所带正电荷总数与阴离子所带负电荷总数相等。
④进出原则:通常是在实验过程中使用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。
任务二、结合离子检验的方法,归纳总结离子推断的依据、步骤及基本思路是什么?
依据物理性质、化学性质的差异—颜色的变化、是否有气体产生、能否溶解、有无沉淀、能否产生某个现象(或产生某个现象的快慢)、有无吸热或放热等现象来判断。
观察物理性质→取少量样品→加入某种试剂→加热、振荡等→现象→结论
根据实验操作和现象,判断一定含有的离子→根据离子共存,判断一定不含的离子→根据电荷守恒,判断还含有的离子或可能含有的离子。
【典例1】检验下列物质所选用的试剂错误的是( )
【解析】为检测氯水中的Cl-,可取少许溶液于试管中,滴加稀硝酸,无明显变化后再加硝酸银溶液,若溶液有白色沉淀生成,则可检测出氯水中含有Cl-,故A正确;氢氧化钡中的OH-与HCO3-反应生成CO32-和H2O,CO32-与Ba2+反应生成BaCO3白色沉淀,无法确定原溶液中存在CO32-还是HCO3-,无法达到检验的目的,故B错误;为检测未知溶液中的SO42-,可取少许溶液于试管中,滴加稀盐酸,无明显变化后再加氯化钡溶液,若溶液有白色沉淀生成,则可检测出未知溶液中含有SO42-,故C正确;酚酞试液可检测碱性物质,因此为检验钠与水反应有OH-生成,可滴加几滴酚酞试液,若溶液变红,则证明反应产物中有OH-,故D正确。
【典例2】除去粗盐中的杂质MgCl2、CaCl2和Na2SO4,过程如下: 下列有关说法中不正确的是( ) A.试剂①②③分别是NaOH、Na2CO3、BaCl2 B.除去Ca2+的主要反应:Ca2++CO32-==CaCO3↓ C.检验SO42-是否除净的方法:取适量滤液,加稀盐酸酸化,再加 BaCl2溶液 D.加稀盐酸调节pH后,采用蒸发结晶的方法得到NaCl固体
【解析】由实验流程可知,粗盐溶解后,可先加NaOH除去MgCl2,再加BaCl2除去Na2SO4,然后加Na2CO3除去CaCl2及过量的BaCl2,且Na2CO3一定在BaCl2之后加入,过滤后,滤液中加盐酸,最后蒸发结晶得到NaCl固体。
1.下列说法中正确的是( ) A.氯化钠水溶液在电流的作用下电离出Na+和Cl- B.二氧化碳的水溶液能够导电,故二氧化碳属于弱电解质 C.硫酸钡难溶于水,但硫酸钡属于强电解质 D.氧化钠在水中反应的离子方程式为4Na++2O2-+2H2O===4Na++4OH-
【解析】电解质电离的条件是溶于水或熔融,A项错误;二氧化碳不能发生电离,其溶液导电是因为二氧化碳与水反应生成碳酸,碳酸电离产生了自由移动的离子,二氧化碳属于非电解质,B项错误;硫酸钡在水中溶解的部分能够完全电离,属于强电解质,C项正确;Na2O是固体,不能拆分,D项错误。
2.在强碱性溶液中不能大量共存的离子组是( ) A.Ba2+、Na+、NO3-、Cl- B.K+、Na+、CO32-、S2- C.K+、Na+、NO3-、SO42- D.NH4+、Cu2+、Cl-、NO3-
【解析】铜离子在强碱性条件下可生成氢氧化铜沉淀,铵根离子在强碱性条件下可生成一水合氨(或氨气和水)。
3.某无色溶液既可能是强酸性又可能是强碱性,在该溶液中一定能大量共存的离子是( ) A.H+ Na+ MnO4- SO42- B.Na+ CO32- Al3+ Cl- C.K+ Na+ Cl- SO42- D.K+ Cl- Ba2+ HCO3-
【解析】A项,MnO4-是紫红色;B项,酸性时CO32-+2H+==CO2↑+H2O,碱性时Al3+生成沉淀;D项,酸性时HCO3-+H+==CO2↑+H2O,碱性时HCO3-+OH-==CO32-+H2O。
4.重金属离子有毒性。实验室有甲、乙两种废液,均有一定毒性。甲 废液经化验呈碱性,主要有毒离子为Ba2+,若将甲、乙两废液按一定比例混合,毒性明显降低。乙废液中可能含有的离子是( ) A.Cu2+和SO42− B.Cu2+和Cl- C.K+和SO42− D.Ag+和NO3−
【解析】甲废液中主要毒性物质可看作是Ba(OH)2,乙废液有一定毒性且与甲废液按一定比例混合后毒性明显降低,可推知乙废液中的重金属离子可与甲废液中的OH-结合形成沉淀,同时乙废液中含有能沉淀甲废液中Ba2+的SO42-或CO32-,A正确。
①生成沉淀②生成气体③生成难电离的物质。
①肯定原则②互斥原则③电中性原则④进出原则
①肯定性原则②否定性原则③引入性原则④电中性原则
高中人教版 (2019)第二节 离子反应精品ppt课件: 这是一份高中人教版 (2019)<a href="/hx/tb_c161973_t3/?tag_id=26" target="_blank">第二节 离子反应精品ppt课件</a>,共19页。PPT课件主要包含了必修一物质及其变化,离子反应,离子反应方程式,“拆迁”,“写”拆字,“拆”墙等,清理建筑垃圾,领导“检查”等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1实验活动3 盐类水解的应用试讲课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002431_t3/?tag_id=26" target="_blank">实验活动3 盐类水解的应用试讲课课件ppt</a>,共32页。PPT课件主要包含了学习目标,复习导入,新课讲解,盐类水解的应用,答案C,课堂检测,答案B,答案D等内容,欢迎下载使用。
化学必修 第一册第二章 海水中的重要元素——钠和氯第二节 氯及其化合物完整版课件ppt: 这是一份化学必修 第一册<a href="/hx/tb_c161981_t3/?tag_id=26" target="_blank">第二章 海水中的重要元素——钠和氯第二节 氯及其化合物完整版课件ppt</a>,共39页。PPT课件主要包含了氯气泄漏事件福建,氯水的多重性及检验,理论分析,含氯物质的性质及应用,几种含氯物质及应用等内容,欢迎下载使用。













