






人教版 (2019)必修 第一册第二节 离子反应精品课件ppt
展开1.通过探究几组物质的导电性实验形成电离的概念,能从宏微结合的角度进一步对物质进行分类,以探究的方式建构电离模型。 2.通过合作探究对溶液导电性的分析,知道电解质、非电解质的概念,认识常见的电解质,能从微观的角度(电离)认识酸、碱和盐,并能用电离方程式表示酸、碱、盐的电离过程。 3.通过化学实验认识电解质的电离及电离条件,建立电离方程式的认知模型,激发学习化学的兴趣,培养严谨求实、勇于探索的科学精神。
活动一、认识电解质和非电解质
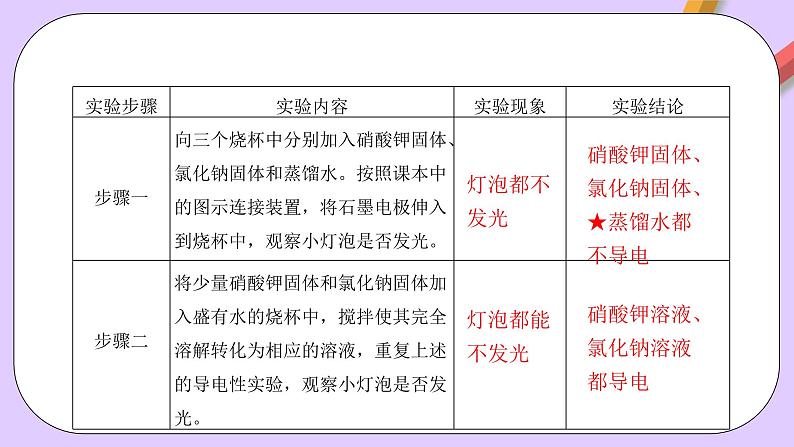
任务一、实验探究:阅读教材P14页内容,根据实验1-2,完成下列实验,并填写表格内容。
【温馨提示】严格说蒸馏水也能导电,但是其导电能力很微弱,用上述的实验装置无法测出。
硝酸钾固体、氯化钠固体、★蒸馏水都不导电
硝酸钾溶液、氯化钠溶液都导电
观看视频:熔融盐的导电性实验
【结论】熔融的氯化钠也能导电。
任务二、结合教材P14页最后自然段,思考下列物质哪些能导电,哪些本身不能导电,但在一定条件下可以导电?硫酸溶液、Cu、熔融NaOH、MgCl2、KOH固体、H2SO4 、Fe2(SO4)3、Na2CO3、硫酸钡、蔗糖、酒精。
硫酸溶液、Cu、熔融NaOH
MgCl2、KOH固体、H2SO4 、Fe2(SO4)3、Na2CO3、硫酸钡
蔗糖、酒精(忽略水导电)
任务三、讨论交流:根据物质的导电性规律,思考如何对化合物进行再分类?电解质和非电解质的概念是什么?
电解质:在水溶液里或在熔融状态下能够导电的化合物。如HCl、NaOH、NaCl等。
非电解质:在水溶液里或在熔融状态下不能够导电的化合物。如酒精、蔗糖等。
【温馨提示】酸、碱、盐、活泼金属氧化物、水等都是电解质,大多数非金属氧化物、部分有机物、SO2、NH3等属于非电解质。
【典例1】下列物质不能导电的是( ) A.KNO3固体 B.NaCl溶液 C.铜丝 D.熔融MgCl2
【解析】A.KNO3固体为离子化合物,但固体时,阴阳离子不能自由移动,不能导电,故A符合题意;B.氯化钠溶液中含有自由移动氯离子和钠离子,氯化钠溶液能导电,故B不符合题意;C.铜丝中有自由移动的电子,能导电,故C不符合题意;D.熔融氯化镁中含有自由移动氯离子和镁离子,所以熔融氯化镁能导电,故D不符合题意;故选:A。
【典例2】下列说法中不正确的是( ) ①将硫酸钡放入水中不能导电,硫酸钡是非电解质; ②氨溶于水得到氨水溶液能导电,氨水是电解质;③固态氯化氢不导电,液态氯化氢可以导电;④硫酸氢钠电离出的阳离子有H+,硫酸氢钠是酸;⑤电解质放在水中一定能导电,非电解质放在水中一定不导电。 A.仅①④ B.仅①④⑤ C.仅②③ D.①②③④⑤
【解析】①将硫酸钡放入水中不能导电,是因为溶液中离子浓度太小,溶于水的硫酸钡能完全电离出离子,硫酸钡是电解质,①错误;②氨溶于水得到氨水溶液能导电,是因为生成的一水合氨电离出离子,一水合氨是电解质,氨气是非电解质,氨水是混合物,不是电解质,也不是非电解质,②错误;③固态氯化氢不导电,液态氯化氢不导电,也不导电,氯化氢溶于水可以导电,③错误;④硫酸氢钠溶于水电离出的阳离子有钠离子和H+,硫酸氢钠是酸式盐,不是酸,④错误;⑤电解质放在水中不一定能导电,例如难溶性电解质,非电解质放在水中也可能导电,例如氨气溶于水,⑤错误。答案选D。
活动二、探究化合物与电解质和非电解质的关系
任务一、思考交流:结合NaCl固体、NaCl溶液、HCl、金属铜等物质的导电性,谈谈你对电解质和非电解质有哪些更深入的理解。
①电解质和非电解质都必须是化合物。单质和混合物既不属于电解质,也不属于非电解质。如盐酸(混合物)和金属单质都能导电。
②电解质不一定能导电,如固态NaCl、液态HCl等;能导电的物质不一定是电解质,如石墨、金属单质等。
③电解质自身不一定能导电,但在水溶液中或熔融状态下能导电。如NaCl晶体不导电,但其溶于水或者在熔融状态下能导电。
④非电解质不导电,但不导电的物质不一定是非电解质,如金刚石、单质硫等一些非金属单质。
任务二、问题探究:已知Na2O、SO3水溶液、盐酸、氯化钠溶液能导电, BaSO4、AgCl难溶于水,它们都是电解质吗?
Na2O+H2O=NaOH→Na++OH-SO3+H2O=H2SO4→ 2H++SO42-
盐酸溶液→ H++Cl-氯化钠溶液→ Na++Cl-
溶于水的BaSO4→(少)Ba2++SO42-溶于水的AgCl→ (少)Ag++Cl-
【结论】导电的原因是其水溶液能产生自由移动的阴阳离子。但Na2O、SO3是间接产生,其它四种是直接(本身)产生。
①SO3水溶液、盐酸、氯化钠溶液,因为都是混合物,因此均不是电解质。SO3与水反应生成H2SO4导电,而不是SO3自身电离而导电。
②BaSO4、AgCl都属于难溶盐,虽其水溶液的导电能力很弱,但能导电,且熔融状态下能导电,所以它们均属于电解质。即电解质和非电解质与物质的溶解性无关。
③电解质导电必须是电解质自身在水溶液中或熔融状态下电离产生离子,而不是与水反应的产物电离出离子。因此SO3不属于电解质,而是非电解质。但活泼金属氧化物Na2O在熔融态时可以产生自由移动的钠离子和氧离子,所以Na2O是电解质。
【典例1】下列说法中,正确的是( ) A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均是非电解质 B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质 C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们是 非电解质 D.铜、石墨均导电,所以它们是电解质
【解析】该题主要考查电解质、非电解质的判断标准。判断某化合物是否为电解质,应从其水溶液或熔融状态下能否导电判断;另外从物质分类来看,酸、碱、盐均为电解质。
【典例2】下列说法正确的是( ) A.铜、石墨均能导电,所以它们都是电解质 B.氨、二氧化碳的水溶液都能导电,所以它们都是电解质 C.液态氯化氢、固体氯化钠都不能导电,所以它们都是非电解质 D.蔗糖、酒精在水溶液里和熔融状态下都不能导电,所以它们都 是非电解质
【解析】判断物质是否为电解质,一看物质类别必须是化合物(酸、碱、盐、水等),选项A不正确;二看溶于水或熔融状态下能否导电,选项C不正确,选项D正确;三看溶于水时若与水反应,其溶液导电可能是非电解质,选项B不正确。
活动一、认识电解质的电离
任务一、阅读教材P15页第3、4、5自然段,观察图1-10、1-11、1-12,探究固体NaCl的溶解及熔化的微观过程,回答NaCl固体溶于水或熔融状态能导电的原因是什么?
【动画】NaCl固体溶于水的微观过程
【结果】NaCl溶于水,产生了自由移动的水合钠离子和水合氯离子。
【结果】NaCl固体熔化时,产生了自由移动的钠离子和氯离子。
【结论】因此,NaCl固体溶于水或熔融状态能导电的原因是因为在水溶液或熔融状态下均能产生了自由移动的钠离子和氯离子。
【问题探究】为什么蔗糖溶液、酒精不导电?
【结论】蔗糖、酒精本身或溶于水均以分子形式存在,无自由移动的离子。
任务二、根据上面电解质导电的微观探析,思考电解质导电与离子有何关系,什么是电解质的电离?
②电解质溶于水或熔融时,生成了自由移动的带电离子。
①电解质在水溶液中或熔融状态下,离解成自由移动离子的过程叫电离。可用电离方程式表示,且遵循守恒定律。
③与溶液中离子的浓度及离子所带电荷多少有关,离子浓度越大,离子所带电荷越多,溶液导电能力越强。
【典例1】下列物质中,含有自由移动的Cl-的是( ) A.KClO3溶液 B.CaCl2溶液 C.KCl晶体 D.液态氯化氢
【解析】A中KClO3电离出K+和ClO3-;B中电离出Ca2+和Cl-;C中KCl不电离;D中HCl为液态不是溶液中,不电离。
【典例2】下列说法中正确的是( ) A.金属铜、石墨碳棒、氯化钠晶体都能导电 B.电解质溶液和金属在外电场作用下,定向移动的粒子不同C.电解质在水溶液中通电后才能发生电离,产生移动的离子D.硫酸钡沉淀不能导电,所以它是非电解质
【解析】氯化钠晶体和硫酸钡沉淀都不能导电,但它们都是电解质;电解质溶于水时即可发生电离产生自由移动的离子,与是否通电无关。
活动二、电解质的电离方程式及书写
任务一、阅读教材P16页第二自然段,什么叫电离方程式?如何从电离的角度理解酸、碱、盐的本质?
酸、碱、盐电解质的电离:
酸=氢离子(H+)+酸根离子
注意:H+半径很小,也可写成H3O+
碱=氢氧根离子(OH-)+金属阳离子或铵根离子
盐=金属阳离子或铵根离子+酸根离子
任务二、讨论交流:联系酸、碱、盐的本质,请尝试写出HNO3、H3PO4、Ba(OH)2、NH3‧H2O、Na2SO4、Fe2(SO4)3、(NH4)2SO4的电离方程式。
任务三、归纳总结书写电离方程式应注意的问题。
②左边是化学式,右边是阴阳离子,且酸电离出的阳离子只有氢离子,碱电离出的阴离子只有氢氧根离子,盐电离出金属阳离子(或铵根离子)和酸根离子。
①符合客观事实,不能随意书写离子符号,要注意正确标注离子所带的电荷种类及其数目。
③要遵循质量守恒(电离方程式左右两侧元素的种类、原子或原子团的个数相等)和电荷守恒(电离方程式右侧的正负电荷数相等,溶液呈电中性)。
④弱酸、弱碱、少部分盐的电离用可逆符号,强酸、强碱、大部分盐用等号。且多元弱酸分步写,多元弱碱一步写。
【典例1】下列在水溶液中的电离方程式,错误的是 ( ) A.Na2CO3=2Na++CO32- B.H2SO4=2H++SO42- C.NaHCO3=Na++H++CO32- D.NaHSO4=Na++H++SO42-
【解析】碳酸钠、硫酸为强电解质,完全电离,A、B两项正确;碳酸氢钠为强电解质,完全电离,HCO3-为弱酸的酸式酸根,不能分开,电离方程式为NaHCO3=Na++HCO3-,C错误;硫酸氢钠在水溶液中完全电离生成Na+、H+和SO42-,D正确。
【典例2】下列物质在指定条件下电离方程式正确的是( ) A.Na2CO3溶于水:Na2CO3===Na22++CO32- B.Fe(OH)3部分溶与水电离:Fe(OH)3===Fe3++3OH- C.NaHS溶于水HS-的电离:HS-+H2O H2S+OH- D.NaHSO4加热熔化:NaHSO4===Na++HSO4-
1.下列各组物质,前者属于电解质,后者属于非电解质的是( ) A.NaCl晶体、BaSO4 B.铜、二氧化硫 C.液态的醋酸、酒精 D.熔融的KNO3、硫酸溶液
【解析】A.NaCl溶液是混合物,既不是电解质也不是非电解质;硫酸钡属于电解质,故A错误;B.铜是单质,既不是电解质也不是非电解质;二氧化硫属于非电解质,故B错误;C.液态的醋酸的水溶液能导电,属于电解质;酒精在水溶液中和熔融状态下均不能导电,属于非电解质,故C正确;D.熔融的KNO3属于电解质;硫酸溶液是混合物,既不是电解质也不是非电解质,故D错误;故选C。
2.下列关于化合物、单质、混合物、电解质和非电解质的正确组合是( )
【解析】冰水混合物的成分仍然是水,是纯净物,A项错误;胆矾是CuSO4·5H2O,是纯净物,氯气是单质,不是电解质,也不是非电解质,B项错误;空气是混合物,小苏打是碳酸氢钠,属于纯净物,硫酸钡是电解质,D项错误。
3.下列说法或者有关化学用语的描述正确的是( )A.NaCl溶于水在电流作用下电离成Na+和Cl-B.NH4NO3电离时产生了NH4+ 和 NO3- 无金属离子,所以NH4NO3不是盐C.HCl、H2SO4液态时都不导电,因此它们都是非电解质D.Ba(OH)2在水中的电离方程式为Ba(OH)2==Ba2++2OH-
【解析】NaCl固体溶于水,在水分子的作用下,电离出自由移动的Na+和Cl-,而不是电流的作用,A项错误; 的性质与金属离子相似,NH4NO3是铵盐,B项错误;HCl、H2SO4液态时虽不导电,但在溶液中能导电,所以HCl和H2SO4都是电解质,C项错误。
4.向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线表示是( )A.曲线a B.曲线bC.曲线c D.曲线d
【解析】开始发生反应:Ba(OH)2+H2SO4===BaSO4 ↓+2H2O,使自由移动的离子浓度逐渐减小,溶液的导电性逐渐减弱。当氢氧化钡和硫酸恰好完全反应时,沉淀达到最大值,这时自由移动的离子浓度最小,导电能力最弱。随后,随着硫酸的加入,这时溶液为硫酸溶液,自由移动的离子浓度又逐渐增大,导电能力逐渐增强。
(Na2O,Al2O3等)
人教版 (2019)必修 第一册第二节 离子反应课文课件ppt: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161973_t3/?tag_id=26" target="_blank">第二节 离子反应课文课件ppt</a>,共39页。PPT课件主要包含了离子反应,电解质,电离和电离方程式等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 离子反应图片课件ppt: 这是一份人教版 (2019)必修 第一册第二节 离子反应图片课件ppt,共20页。PPT课件主要包含了实验现象,实验结论,解决问题等内容,欢迎下载使用。
高中化学必修一 专题1.2.1 电解质的电离备课堂课件)) (共18张): 这是一份高中化学必修一 专题1.2.1 电解质的电离备课堂课件)) (共18张),共18页。














