






化学人教版 (2019)第三节 物质的量优秀ppt课件
展开1.通过创设生活情境,引出并理解物质的量概念,知道物质的量是一个基本物理量,其单位是摩尔,建立宏观辨识与微观探析的化学核心素养。 2.通过问题探究、利用对比、类比、归纳、演绎等多种思维活动,理解物质的量概念的应用,了解摩尔质量的含义,体会从物质的量层次定量研究化学问题的意义。 3.能基于物质的量认识物质组成及其化学变化,知道阿伏伽德罗常数含义,建立物质的量、质量、微粒数与阿伏伽德罗常数之间的关系及简单计算的思维模型。
小王和小李比赛喝水,小王一口气喝了36克水,小李一口气喝了6020万亿亿个水分子,于是小李很自豪地宣布他获得胜利,而小王确坚持认为是自己获胜?那么,你能判定他们谁胜谁负吗?
一滴水中的水分子,若14亿人每人每秒数一个,需要数5.3万年。
化学家在研究中发现,虽然参加化学反应的微粒质量很小,但实际参加反应的微粒数往往很大。如何将质量和微粒数联系起来呢?
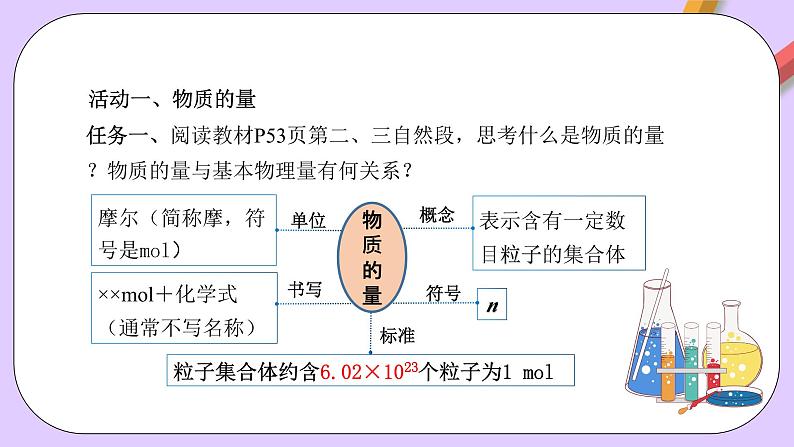
任务一、阅读教材P53页第二、三自然段,思考什么是物质的量?物质的量与基本物理量有何关系?
表示含有一定数目粒子的集合体
摩尔(简称摩,符号是ml)
粒子集合体约含6.02×1023个粒子为1 ml
××ml+化学式(通常不写名称)
曹冲称象故事,体现什么思想?
用直尺测量纸张厚度,体现什么思想?
单个水分子不能称量,许许多多个水分子,可以称量 !
任务二、讨论交流:物质的量是7个基本物理量之一,它有哪些基本特征呢?
国际单位制(SI)的7个基本单位
物质的量是一个专用名词,在表述时是一个整体,不可拆分,不能说成“物质量”“物质的质量”或“物质的数量”等。
物质的量的单位是摩尔,只用于表示分子、原子、离子、质子、中子、电子等微观粒子的多少,不适合表示宏观物质的数量。
在使用物质的量表示物质时,必须具体指明粒子的种类。如1 ml H2表示1摩尔氢分子,1 ml H表示1摩尔氢原子,1 ml H+表示1摩尔氢离子。
微粒个数的数值只能是正整数,而物质的量表示的是很多个微粒的集合体,其数值可以是整数或小数。例:5 ml H2O、0.5 ml H2O。
【典例1】下列说法中正确的是( ) A.摩尔是表示物质质量的单位 B.物质的量适用于计量分子、原子、离子等粒子的集合体 C.摩尔是表示物质所含微粒个数的物理量 D.物质的量就是指物质的质量
【解析】A项,摩尔是物质的量的单位,错误;B项,物质的量是表示一定数目粒子的集合体的物理量,适用于计量分子、原子、离子等粒子的集合体,正确;C项,摩尔是物质的量的单位,不是物理量,错误;D项,物质的量是表示一定数目粒子的集合体的物理量,不是物质的质量,错误。
【典例2】有NO、CO2、N2O4三种气体,它们分別都含有0.5 ml氧原子,则三种气体的物质的量之比为( ) A.1∶4∶2 B.1∶1∶1 C.4∶2∶1 D.1∶2∶4
【解析】NO含有0.5 ml氧原子,则n(NO)=0.5 ml;CO2含有0.5 ml氧原子,则n(CO2)=0.25 ml、N2O4含有0.5 ml氧原子,则n(N2O4)=0.125 ml,所以三种气体的物质的量之比为n(NO)∶n(CO2)∶n(N2O4)=0.5 ml∶0.25 ml∶0.125 ml=4∶2∶1;答案选C项。
活动二、阿伏加德罗常数
任务一、物质的量的单位是摩尔,显然摩尔一定是一个庞大的数量单位,那么1ml代表的数量到底是多少呢?
国际上科学家们规定:1ml任何物质所含的粒子数量叫做阿伏加德罗常数,符号为NA,其数值与0.012kg12C中所含的原子个数相等,NA大约为6.02×1023ml-1。
出生:1776年出生于意大利
经历:1792年进都灵大学读法律系,1796年获得法学博士学位,1800年起,开始学习数学和物理学。
成就:1819年被都灵科学院选为院士,担任过意大利教育委员会和度量衡学会会长。
为纪念他,把1 ml任何粒子的粒子数叫做阿伏加德罗常数
在化学上的重大贡献是建立分子学说
1 ml任何粒子的粒子数
6.02×1023用于定量计算
0.012kg12C中所含的碳原子个数,约为6.02×1023个
n=N/NA或N=n‧NA如0.5 ml H2O中分子数为 3.01×1023
NA。要指明粒子的种类,1mlH2O含NA个水分子。
任务二、归纳小结:如何正确理解物质的量、摩尔及阿伏加德罗常数概念?完成下表内容。
“物质的量”是一个整体,不能拆开,也不能添字,如不能说成“物质量”或“物质的数量”等,只用来描述微观粒子的物理量
只用来描述微观粒子,如原子、分子、离子、中子、质子、电子等,也可以是特定组合,使用时要用化学式指明粒子种类,如1 ml NaCl
①NA的基准是0.012 kg 12C中的原子个数,约为6.02×1023
②12C不仅是物质的量的基准对象,而且还是相对原子质量的基准
③NA是一个实验值,现阶段常取6.02×1023的近似值进行有关计算
④阿伏加德罗常数与6.02×1023的关系就像π与3.14的关系,计算时通常使用6.02×1023这个近似值,而在叙述或定义“摩尔”的概念时要用NA
【典例1】下列有关物质的量及摩尔的叙述正确的是( ) A.1.5 ml CH4中含有1.5 ml C、6 ml H B.1 ml是6.02×1023个粒子的集合体,如1 ml大米、1 ml苹果等 C.物质的量与物质的数量、物质的质量是等价的 D.摩尔是7个基本物理量之一,它既是物质的量的单位又是粒子数目的单位
【解析】A项,1 ml CH4中含有1 ml C、4 ml H,故1.5 ml CH4中含有1.5 ml C、6 ml H,正确;B项,摩尔不可用于宏观物体,错误;C项,物质的量是国际单位制中7个基本物理量之一,它并不是物质的数量或物质的质量,错误;D项,物质的量是国际单位制中7个基本物理量之一,摩尔不是粒子数目的单位,错误。
【典例2】在0.05 ml Al2(SO4)3中含有的Al3+、SO42-的数目分别为( ) A.6.02×1022个,3.01×1022个B.6.02×1022个,9.03×1022个 C.9.03×1022个,6.02×1022个D.3.01×1022个,3.01×1022个
【解析】Al2(SO4)3电离方程式为:Al2(SO4)3=2Al3++3SO42-,1个Al2(SO4)3电离产生2个Al3+、3个SO42-,因此在0.05 ml Al2(SO4)3中含有的Al3+0.1 ml,含有SO42-0.15 ml,则根据N=n·NA可知含有的Al3+、SO42-的数目分别为6.02×1022个、9.03×1022个,故合理选项是B项。
作为相对原子质量标准的碳12,当碳原子的质量为12 g时,则碳原子约为6.02×1023 。
1 ml C 的质量为12 g
1 ml C其质量为12 g
C的相对原子质量为12
以克为单位,两者在数值上相等
活动一、摩尔质量的定义
任务一、阅读教材P54页,观察分析图2-19和图2-20,回答摩尔质量的定义及特征是什么?并填写下表内容。
①质量、相对质量和摩尔质量的比较:
③定义:摩尔质量是单位物质的量的物质所具有的质量,符号为M,单位为g/ml。
②规律:1ml任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。1ml任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。1ml任何离子的质量(以克为单位)在数值上等于这种离子的式量
【结论】1ml任何微粒或物质的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
任务二、应用探究:根据教材P55页【例题1】计算49克H2SO4的物质的量是多少?1.50mlNa2CO3的质量是多少?
【解】H2SO4的相对分子质量为98,摩尔质量为98g/ml n(H2SO4)=m(H2SO4)/M(H2SO4) =49g/98g/ml =0.50ml Na2CO3的相对分子质量为106,摩尔质量为106g/ml m(Na2CO3)=n(Na2CO3)‧M(Na2CO3) =1.50ml×106g/ml =159g答:49克H2SO4的物质的量为0.50ml,1.50mlNa2CO3的质量是159g。
【典例1】下列叙述中正确的是( ) A.CO2的摩尔质量为44 g B.1 ml CO2的质量为44 g/ml C.CO2的摩尔质量等于CO2的相对分子质量 D.NA个CO2的质量(以g为单位)与CO2的相对分子质量在数值上相同
【解析】摩尔质量的单位是g/ml,质量的单位是g,A、B错误;摩尔质量在数值上等于其相对分子质量,C错误;NA个CO2即1 ml,其质量以g为单位与CO2的相对分子质量在数值上相同,D正确。
【典例2】3.6g某物质含有的分子数目为1.204×1023,则该物质的 摩尔质量为( ) A.18g B.18g•ml-1 C.36g D.36g•ml-1
活动二、物质的量、质量、摩尔质量、相对质量的关系
任务一、讨论交流:摩尔质量具有哪些特征?并请对小王和小李比赛的结果作出判定?
摩尔质量以g·ml-1作单位时,在数值上与相对式量相等。
离子的摩尔质量以g·ml-1为单位时,其数值近似等于该离子的式量。
指定的物质的摩尔质量是一个定值,不随物质的物质的量多少而改变
④36克水,物质的量n=36g/(18g/ml)=2ml,6020万亿亿个水分子,其物质的量n=6.02×1020/(6.02×1023) ≈10-3ml。显然是小王获胜。
任务二、归纳小结:以水为例,思考物质的量、质量、摩尔质量有何关系?
①1 ml H2O的质量是18g,n ml H2O的质量是18ng。18g H2O的物质的量是1ml,36g H2O的物质的量是2ml;,72g H2O的物质的量是4ml。
②物质的量(n)、质量(m)、摩尔质量(M)三者之间的关系M=m/n,由该关系进行变式可得m=n.M等。
③以g·ml-1为单位时,任何粒子的摩尔质量在数值上等于该粒子的相对分子(或原子)质量,如CO2的摩尔质量为44 g·ml-1,CO2的相对分子质量为44,两者数值相等。
【典例1】下列叙述正确的是( ) A.摩尔是基本物理量之一 B.1 ml CO2的质量为44 g·ml-1 C.SO42-的摩尔质量为96 g·ml-1 D.1 ml任何物质都含有NA个原子
【解析】A项,物质的量是七个基本物理量之一,而摩尔是物质的量的单位,错误;B项,1 ml CO2的质量是m=nM=44 g·ml-1×1 ml=44 g,错误;C项,SO42-的相对分子质量为96,所以摩尔质量为96 g·ml-1,正确;D项,物质的组成可以是分子、原子、离子,1 ml任何物质都含有NA个微粒,错误。
【典例2】下列说法正确的是( ) A.1ml NaCl的质量是58.5g/ml B.64g氧气中含有2ml氧 C.4g氦气中含有2ml氦原子 D.4.4g 中含有个分子
【解析】A.NaCl的摩尔质量是58.5g/ml,1ml NaCl的质量是58.5g,故A错误;B.未指明微粒的种类,故B错误;C.氦气是单原子分子,4g氦气中应含有1ml氦原子,故C错误;D.4.4gCO2即0.1ml CO2,0.1ml CO2中所含CO2分子数N(CO2)=6.02×1023/ml×0.1ml=6.02×1022,故D正确;故答案为D。
1.下列说法正确的是( )A.摩尔是表示粒子多少的物理量B.物质的量是指物质所含微粒的数目C.物质的量是度量物质所含微粒集合体多少的物理量D.物质的量的单位——摩尔只适用于分子、原子和离子
【解析】物质的量是七大基本物理量之一,它表示的是含有一定数目粒子的集合体,摩尔是物质的量的单位,适用于所有微观粒子。
2.下列叙述错误的是( ) A.1 ml SO2中含有2 ml氧原子和1 ml硫原子 B.1 ml N2中约含有1.204×1024个氮气分子 C.0.1 ml H2O中含有的原子数目约为0.3×6.02×1023 D.3.01×1023个CO2分子中氧原子的物质的量约为1 ml
【解析】1 ml N2中含有2 ml氮原子,即约含有1.204×1024个氮原子,B错误。
3.设NA代表阿伏加德罗常数的值。下列说法正确的是( ) A.2.4 g金属镁变成镁离子时失去的电子数目为0.1NA B.18 g水中含有0.1NA个水分子 C.1 ml氮气所含的电子数目为NA D.17 g氨气所含电子数目为10NA
【解析】镁的物质的量为0.1ml,0.1ml镁变成镁离子失去0.2ml电子,失去的电子数目为0.2NA,故A错误;B.18g水的物质的量为1ml,则水分子为NA 个,故B错误; C.一个氮气分子的电子为14个,则1ml氮气含电子数目为14NA,故C错误;D.17g氨气的物质的量为1ml,1ml氨气含有10ml电子,所含电子数目为10NA,故D正确;综上所述,本题选D。
4.关于“物质的量”、“摩尔”和“摩尔质量”的叙述中正确的是( ) A.物质的摩尔质量等于其相对分子(原子)质量 B.“物质的量”是国际单位制中的一个基本单位 C.0.012 kg12C中所含的碳原子数为NA D.1ml任何物质都含有约6.02×1023个原子
【解析】A.摩尔质量的单位为g/ml,以克为单位时,摩尔质量在数值上等于其相对分子(原子)质量,二者表示的意义不同,A错误;B.物质的量是物理量,摩尔是国际单位制中的一个基本单位,B错误;C.0.012 kg12C中所含碳原子的数目即为阿伏加德罗常数,可用NA表示,C正确;D.1ml任何物质所含的微粒数在数值上都约为6.02×1023个,由于构成物质的粒子有分子、原子、离子等,所以1ml任何物质不一定都含有约6.02×1023个原子,D错误;故选C。
符号: M 单位:g/ml或g‧ml-1概念:单位物质的量的物质所具有的质量。规律:以g·ml-1为单位时,任何粒子的摩尔质量在数值上等于该粒子的相对分子(或原子)质量
高中化学第三节 物质的量优质ppt课件: 这是一份高中化学<a href="/hx/tb_c161983_t3/?tag_id=26" target="_blank">第三节 物质的量优质ppt课件</a>,共32页。PPT课件主要包含了物质的量的单位摩尔,摩尔质量,mol,gmol,求啥先求n等内容,欢迎下载使用。
人教版 (2019)必修 第一册第三节 物质的量一等奖课件ppt: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161983_t3/?tag_id=26" target="_blank">第三节 物质的量一等奖课件ppt</a>,共16页。PPT课件主要包含了物质的量,微观粒子,宏观物质,物理量,单位名称,单位符号,电流强度,热力学温度,发光强度,开尔文等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 物质的量备课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161983_t3/?tag_id=26" target="_blank">第三节 物质的量备课课件ppt</a>,共31页。PPT课件主要包含了素养目标,物质的量,物质的量的表示方法,阿伏伽德罗常数,02×1023,mol,3mol,摩尔质量等内容,欢迎下载使用。













