





化学必修 第一册第三章 铁 金属材料第一节 铁及其化合物评优课ppt课件
展开1.通过学习铁的氧化物和氢氧化物,学会从物质类别和元素价态的视角认识具有变价元素物质间的转化关系,并建立认识模型,丰富研究物质的思路和方法。 2.通过实验探究铁的氢氧化物的化学性质,并能用化学方程式或离子方程式正确表示。体会实验对认识和研究物质性质的重要作用,形成证据意识。 3.结合应用实例,将铁的氧化物和氢氧化物性质的知识运用于解决生产、生活中简单的化学问题,强化性质决定用途的观念。
红砖和青砖都是生活中用到的建筑材料,两者都含的铁的氧化物。红砖的成分是粘土(主要是硅酸盐),红色来自于三氧化二铁。其中的主要反应是焦炭和水在高温下反应生成一氧化碳和氢气(又叫水煤气),两种气体都有还原性,在高温下降三价铁还原成二价得到氧化亚铁是黑色的—是青砖。出窑前不加水则得到三价铁的氧化物是红棕色的—是红砖。
活动一、探究铁的氧化物分类及物理性质
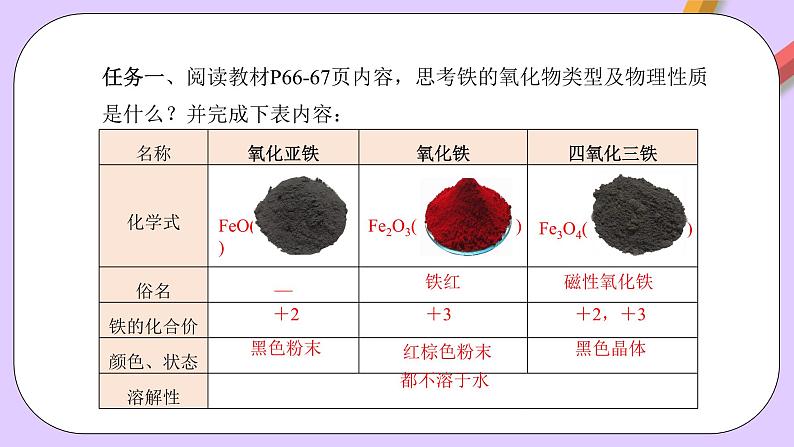
任务一、阅读教材P66-67页内容,思考铁的氧化物类型及物理性质是什么?并完成下表内容:
FeO( )
Fe2O3( )
Fe3O4( )
任务二、问题探究:结合铁的氧化物的物理性质,思考烧制砖瓦时,向窑内添加大量的煤炭后封窑1天,从窑顶向下慢慢浇水7天的目的是什么?红砖和青砖两者颜色不同的原因是什么?
①烧制砖瓦时,从窑顶向下慢慢浇水的目的是水蒸气和窑内高温的炭发生化学反应产生大量的还原气体(氢气和一氧化碳),它们把氧化铁又逐渐还原成为四氧化三铁,而制得青砖。
②两者颜色不同的原因是两者所含的铁的氧化物是不一样,红砖中含的是氧化铁,青砖中含的是四氧化三铁。
【典例1】“秦砖汉瓦”是我国传统建筑文化的一个缩影。同是由黏土烧制的砖瓦,有的是黑色的,有的却是红色的,你猜测其中的原因可能是( ) A.土壤中含有铁粉、二氧化锰等 B.黑砖瓦是煅烧过程中附着了炭黑,红砖瓦则是添加了红色耐高温 染料 C.土壤中含有的铜元素经过不同工艺煅烧,分别生成了黑色CuO和 红色Cu D.土壤中含有的铁元素经过不同工艺煅烧,分别生成了黑色Fe3O4或 FeO和红色Fe2O3
【典例2】下列说法正确的是( ) A.赤铁矿的主要成分是Fe3O4 B.Fe2O3为碱性氧化物,可与水反应生成Fe(OH)3 C.铁锈的主要成分是Fe2O3 D.Fe3O4中铁元素有+2价和+3价,Fe3O4是混合物
【解析】赤铁矿、铁锈的主要成分均是Fe2O3,A错误,C正确;Fe2O3为碱性氧化物,但不与水反应,B错误;Fe3O4为化合物,不是混合物,D错误。
活动二、探究铁的氧化物的化学性质
任务一、铁元素可以形成三种氧化物,分别是氧化亚铁( FeO )、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)。分别从物质类别和元素价态两方面推测这三种氧化物的化学性质有什么异同?
①从分类的角度分析,三者都是金属氧化物,都能与酸反应。三者都难溶于水,不与水反应。
②从价态的角度分析, FeO、 Fe3O4既有氧化性又有还原性, Fe2O3主要有氧化性。
任务二、阅读教材P57第三自然段,根据各类物质的通性和氧化还原反应规律,结合下表回答铁的氧化物具有哪些主要化学性质?
FeO+2H+ =Fe2+ +H2O
Fe2O3+6H+ =2Fe3+ +3H2O
Fe3O4+8H+ =2Fe3+ + Fe2++4H2O
红色油漆和涂料;赤铁矿是炼铁原料
任务三、归纳总结铁的三种氧化物组成、性质各有何特点及主要用途有哪些?
①化合态铁的常见化合价只有+2价和+3价,Fe3O4可以看成由FeO和Fe2O3按物质的量之比1∶1组合而成的复杂氧化物,通常也可写成FeO·Fe2O3的形式。
③Fe3O4与盐酸反应可分别看作Fe2O3、FeO与盐酸反应,然后两反应式相加。
④FeO、Fe3O4遇氧化性酸(如HNO3)发生氧化还原反应,+2价的铁均被氧化成+3价。
【典例1】下列关于铁的氧化物说法错误的是 ( ) A.铁的氧化物在通常状况下都是有色固体 B.四氧化三铁是一种复杂的铁的氧化物,它与盐酸反应后的溶液中同时存在Fe2+和Fe3+ C.FeO在空气中加热生成Fe2O3 D.工业上常使用铁的氧化物作原料冶炼铁
【解析】铁的氧化物在通常状况下都是有色固体,如氧化铁是红棕色固体,氧化亚铁和四氧化三铁都是黑色固体,故A正确;四氧化三铁是一种复杂的铁的氧化物,可看作是由FeO、Fe2O3组成的化合物,它与盐酸反应后的溶液中同时存在Fe2+和Fe3+,B正确;FeO在空气中加热生成Fe3O4,故C错误;工业上常使用铁的氧化物作原料,用一氧化碳冶炼铁,故D正确。
【典例2】关于铁的三种氧化物(FeO、Fe2O3、Fe3O4),下列叙述中正确的是( ) A.铁的三种氧化物中铁元素的化合价完全相同 B.都是碱性氧化物,都能与盐酸反应生成氯化铁和水 C.铁的三种氧化物在高温条件下都能被CO还原为Fe D.四氧化三铁中铁元素有+2价和+3价,它是一种混合物
活动一、铁的氢氧化物性质、制备及转化
任务一、实验探究:完成或观看教材P67【实验3-1】,补充实验:向FeCl3溶液中滴加NaOH溶液,描述实验现象并分析可能的原因?
①氯化铁溶液中滴加氢氧化钠溶液有红褐色沉淀生成,该沉淀为氢氧化铁,方程式为:Fe3+ + 3OH- = Fe(OH)3↓。
②向FeSO4溶液中滴加NaOH溶液,看到白色絮状沉淀迅速变灰绿色,变红褐色沉淀?
③在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,因此现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,反应的化学方程式为:4Fe(OH)2+O2+2H2O===4Fe(OH)3
任务二、归纳小结:铁的氢氧化物的制备方法、性质及转化有何规律?并完成下表内容。
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3++3H2O
在空气中不稳定,易被氧化
Fe2++2OH-=Fe(OH)2↓
Fe3++3OH-=Fe(OH)3↓
4Fe(OH)2+O2+2H2O==4Fe(OH)3
Fe(OH)2转化成Fe(OH)3的特殊现象是白色沉淀迅速变成灰绿色,最终变成红褐色。
【典例1】下列说法中,不正确的是( ) A.FeCl3溶液和FeCl2溶液都是黄色的 B.Fe(OH)2是白色的,Fe(OH)3是红褐色的 C.FeO、 Fe2O3都能与盐酸反应 D.FeCl3溶液、FeCl2溶液都能与NaOH溶液反应
【解析】A.FeCl3溶液是黄色的,FeCl2溶液是浅绿色的,A项错误;B.Fe(OH)2是白色的,Fe(OH)3是红褐色的,B项正确;C.FeO、 Fe2O3都是金属氧化物,金属氧化物一般都能与盐酸反应,C项正确;D.FeCl3溶液、FeCl2溶液与NaOH溶液反应分别生成氢氧化铁沉淀和氢氧化亚铁沉淀,故FeCl3溶液、FeCl2溶液都能与NaOH溶液反应,D项正确;答案选A。
【典例2】将一定量铁粉溶解于足量稀硫酸中,然后向溶液中滴加足量NaOH溶液,充分反应后过滤将滤渣在空气中加热至1000℃完全反应,最终得到的固体的成分为( )
【解析】将一定量铁粉溶解于足量稀硫酸中发生反应:Fe+H2SO4=FeSO4+H2↑,然后向溶液中滴加足量NaOH溶液,发生反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3,充分反应后过滤将滤渣在空气中加热至1000℃完全反应,反应为:2Fe(OH)3 Fe2O3+3H2O,最终得到的固体成分为Fe2O3;故选C。
活动二、探究Fe(OH)2的制备方法
任务一、结合教材P689页“思考与讨论”:由实验3-1可知,白色的Fe(OH)2会被溶解在溶液中的氧气氧化。那么,在实验室里,如何得到Fe(OH)2呢?
【关键】Fe(OH)2会被溶解在溶液中的氧气氧化,因此实验室中得到Fe(OH)2的 关键是防止氧气的干扰。其中包括溶液中的氧气干扰与空气中的氧气干扰。
【方法】①Fe2+必须是新制的,并放入铁粉,以防Fe2+被氧化成Fe3+;
②为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。
③为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
④为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物、用还原性气体排除装置中的空气等,以隔绝空气。装置如下:
任务二、方法探究:下图为实验方案改进,请讨论图①的防氧化原理。图②的防氧化原理和图①类似,如何操作才能达到目的?用图③装置能制备氢氧化亚铁吗?若能,该如何操作?
①图①铁粉和硫酸反应得到H2,装置充满了H2,生成的Fe(OH)2没有与O2接触。
②图②打开止水夹a,检验试管B出口处排出的氢气的纯度。当排出的H2纯净时,夹紧止水夹a。
③ 能。具体操作:注射器A吸入NaOH溶液后用硅胶塞封口,再用注射器B将FeSO4溶液缓慢推入注射器A中,使两溶液混合反应。
任务三、归纳小结:Fe(OH)2和Fe(OH)3性质的比较,填写下表内容:
3Fe(OH)2+10HNO3(稀)=3Fe(NO3)3+NO↑+8H2O
在空气中分解产物很复杂
【典例1】实验室可用图装置制备Fe(OH)2。下列说法不正确的是( ) A.配制NaOH溶液和FeSO4溶液的蒸馏水要提前煮沸 B.实验前可在FeSO4溶液上面加一层煤油 C.得到的Fe(OH)2为红褐色固体 D.实验结束后的胶头滴管,要先用盐酸浸泡,再用水洗
【解析】如图,利用NaOH溶液与FeSO4溶液反应得到Fe(OH)2和Na2SO4,Fe(OH)2易被空气氧化。A项,FeSO4和Fe(OH)2中铁元素呈+2,易被氧化,故配制NaOH溶液和FeSO4溶液的蒸馏水要提前煮沸,除去水中溶解的氧气,正确;B项,实验前可在FeSO4溶液上面加一层煤油,浮在水面上,可隔绝空气,正确;C项,得到的Fe(OH)2为白色固体,错误;D项,实验结束后的胶头滴管含碱性溶液,要先用盐酸浸泡,再用水洗,正确。
【典例2】关于甲、乙、丙、丁四套装置的说法正确的是( ) A.用装置甲制取氯气 B.用装置乙除去氢气中的少量氯化氢 C.用丙装置可以较长时间看到白色Fe(OH)2白色沉淀 D.用丁装置证明碳酸氢钠受热易分解
【解析】A.MnO2与浓盐酸混合制取Cl2需要在加热条件下进行,装置中缺少加热装置,因此不能用于制取Cl2,A项错误;B.HCl溶于水产生盐酸,盐酸与NaHCO3发生产生CO2气体,导致Cl2中含有新杂质CO2气体,不能达到目的,B项错误;C.试管中Fe与H2SO4反应产生FeSO4和H2,产生的H2将试管A、B及导气管中空气排出,待其中没有空气后,关闭阀门a,反应产生的H2又将A中新制取的FeSO4压入B试管中,发生反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,由于处于H2的惰性环境,产生的Fe(OH)2不会被氧化,因此可以较长时间观察到Fe(OH)2白色沉淀,C项正确;D.固体加热时为防止产生的水蒸气冷凝回流,试管口应该略向下倾斜,D项错误;答案选C。
1.下列有关物质的性质与用途不具有对应关系的是( ) A.铁粉能与O2反应,可用作食品保存的吸氧剂 B.聚合硫酸铁能水解并形成胶体,可用于净水 C.FeCl3具有氧化性,可用于腐蚀印刷电路板上的Cu D.纳米Fe3O4能与酸反应,可用作铁磁性材料
【解析】铁粉能与O2反应,因此铁粉可用作食品保存的吸氧剂,物质的性质与用途具有对应关系,故A错;聚合硫酸铁能水解并形成胶体,胶体能吸附杂质,因此聚合硫酸铁可用于净水,具有对应关系,故B错;FeCl3具有氧化性,氯化铁和铜反应生成氯化铜和氯化亚铁,则氯化铁可用于腐蚀印刷电路板上的Cu,具有对应关系,故C错;纳米Fe3O4能与酸反应生成氯化亚铁、氯化铁和水,纳米Fe3O4可用作铁磁性材料,物质的性质与用途不具有对应关系,故D正确。
2.《神农本草经》记载:“磁石,味辛寒,主周痹风湿,肢节中痛,不可持物,洗洗酸消,除大热烦满及耳聋。”下列说法错误的是( )A.磁石的主要成分是碱性氧化物Fe3O4 B.磁石呈黑色C.磁石不溶于水 D.磁石可作药材使用
【解析】A.磁石的主要成分是Fe3O4,但不是碱性氧化物, 碱性氧化物是能和酸作用,只生成一种盐和水的金属氧化物;而四氧化三铁虽可以和酸反应,但同时生成铁盐和亚铁盐两种盐,所以不是碱性氧化物,A错误;B.磁石呈黑色,B正确;C.磁石的主要成分是Fe3O4,难溶于水,C正确;D.根据题意可做药材,D正确;故选A。
3.氧化还原反应广泛存在,下列变化中没有发生氧化还原反应的是( )A.用焦炭将Fe2O3冶炼成生铁B.FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化C.用石灰浆粉刷墙壁D.Fe(OH)2白色沉淀在空气中放置变成红褐色
【解析】用焦炭将Fe2O3,冶炼成生铁,反应为置换反应,C、Fe的化合价发生改变,为氧化还原反应,A不符;FeO是一种黑色粉末,不稳定,在空气中受热,变为四氧化三铁,为氧化还原反应,B不符;用石灰浆粉刷墙壁,为氢氧化钙与二氧化碳反应生成碳酸钙和水,各元素的化合价未变,为非氧化还原反应, C符合题意;Fe(OH)2白色沉淀在空气中放置最终变成红褐色,原理为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,涉及氧化还原反应,D不符;故选C。
4.下列各图示中能较长时间观察到Fe(OH)2的是( )
A.①②③ B.①②④ C.①②③④ D.②③④
【解析】①稀硫酸和铁粉生成H2,氢气排除了装置中的空气,在滴加氢氧化钠溶液,可以观察到白色沉淀;②稀硫酸和铁粉生成H2,打开a止水夹,氢气排除了装置中的空气,过一段时间关闭a止水夹,A中生成硫酸亚铁的试管压强增大,将硫酸亚铁压如B试管,可以观察到白色沉淀;③与空气直接接触,Fe(OH)2迅速被空气氧化成灰绿色最终变成红褐色的Fe(OH)3,不能较长时间观察到Fe(OH)2白色沉淀;④在硫酸亚铁溶液上面加苯液封,隔绝空气,能较长时间观察到Fe(OH)2白色沉淀;综上所述,①②④符合题意;故选B。
物理性质:色、态、俗名、用途
化学性质:稳定性、与酸反应
化学性质:稳定性、与酸反应、转化
制备方法:盐铁盐+强碱
高中化学人教版 (2019)必修 第一册第三章 铁 金属材料第一节 铁及其化合物集体备课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161989_t3/?tag_id=26" target="_blank">第三章 铁 金属材料第一节 铁及其化合物集体备课ppt课件</a>,共32页。PPT课件主要包含了Fe的氢氧化物,加热分解,思考讨论,铁盐与亚铁盐等内容,欢迎下载使用。
化学必修 第一册第一节 铁及其化合物课前预习ppt课件: 这是一份化学必修 第一册第一节 铁及其化合物课前预习ppt课件,共22页。
人教版 (2019)必修 第一册第一节 铁及其化合物课前预习ppt课件: 这是一份人教版 (2019)必修 第一册第一节 铁及其化合物课前预习ppt课件,共22页。













