




所属成套资源:新人教版化学必修第一册课件PPT+教案+分层作业+导学案(原卷+解析卷)整册(含单元+专题复习)
高中化学人教版 (2019)必修 第一册第三章 铁 金属材料实验活动2 铁及其化合物的性质精品课件ppt
展开
这是一份高中化学人教版 (2019)必修 第一册第三章 铁 金属材料实验活动2 铁及其化合物的性质精品课件ppt,共38页。PPT课件主要包含了三角转化关系图,有关方程式等内容,欢迎下载使用。
1.通过讨论交流、问题探究,进一步巩固铝、氧化铝、氢氧化铝及铝盐分别与酸、碱反应的规律,掌握氢氧化铝的制备方法、铝及其化合物的主要性质及其应用。 2.通过归纳总结、对比分析,加深对铝的重要化合物性质及应用的理解,构建铝三角转化模型,进一步巩固物质的量在化学方程式计算中的应用。 3.通过对铝及其化合物性质的深度探究,了解铝的重要化合物在生产、生活中的重要应用。掌握铝及其化合物有关图像的特点及应用,增强学好化学、服务社会的责任感和使命感。
19世纪,法国王宫一次宴会上,法国皇帝拿破仑三世独自用一种比金、银轻得多的金属制成的刀叉,而其他人都用黄金或白银制的餐具,以体现其王者的风范。其实拿破仑的刀叉就是用金属就是铝属制成的。由于当时冶炼铝很难,铝十分珍贵,据说泰国当时的国王曾用过铝制的表链;1855年巴黎万国博览会上,展出了一小块铝,标签上写到:“来自黏土的白银”, 并将它放在最珍贵的珠宝旁边;直到1889年’伦敦化 学会还把铝合金制的花瓶和杯子作为贵重的礼物送 给门捷列夫。随着科学技术的发展,铝的冶炼变得 很简单,现在铝和铝制品在生活中,可以说无处不在。
铝及其化合物的性质及转化
活动一、铝、氧化铝及氢氧化铝的主要性质及应用
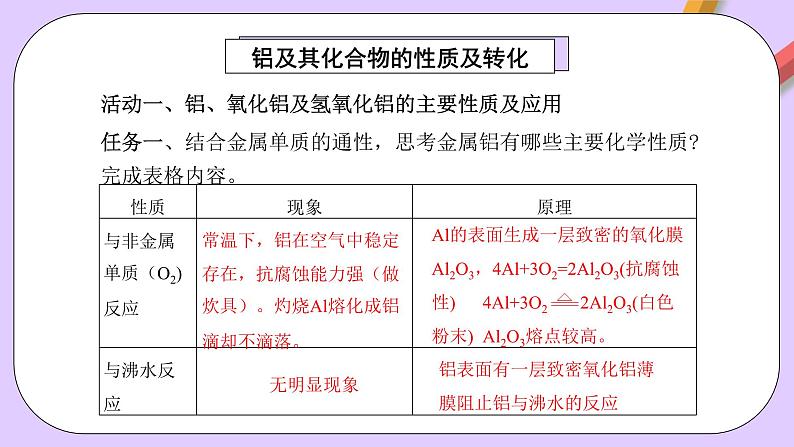
任务一、结合金属单质的通性,思考金属铝有哪些主要化学性质?完成表格内容。
常温下,铝在空气中稳定存在,抗腐蚀能力强(做炊具)。灼烧Al熔化成铝滴却不滴落。
铝表面有一层致密氧化铝薄膜阻止铝与沸水的反应
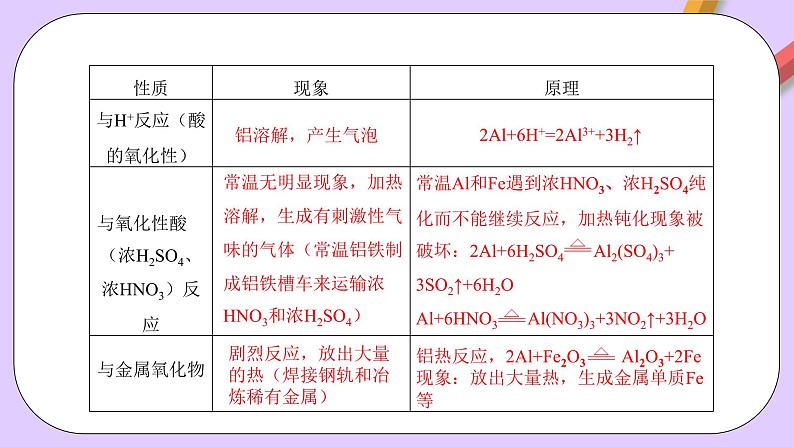
常温无明显现象,加热溶解,生成有刺激性气味的气体(常温铝铁制成铝铁槽车来运输浓HNO3和浓H2SO4)
2Al+6H+=2Al3++3H2↑
剧烈反应,放出大量的热(焊接钢轨和冶炼稀有金属)
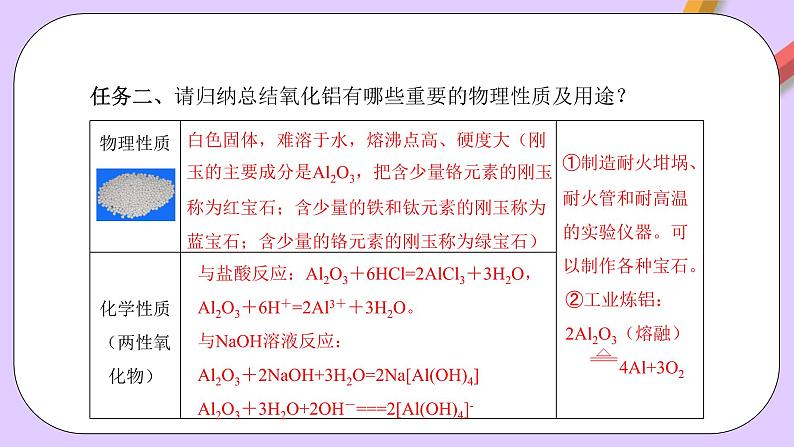
任务二、请归纳总结氧化铝有哪些重要的物理性质及用途?
①制造耐火坩埚、耐火管和耐高温的实验仪器。可以制作各种宝石。
与盐酸反应:Al2O3+6HCl=2AlCl3+3H2O,Al2O3+6H+=2Al3++3H2O。与NaOH溶液反应:Al2O3+2NaOH+3H2O=2Na[Al(OH)4]Al2O3+3H2O+2OH-===2[Al(OH)4]-
白色固体,难溶于水,熔沸点高、硬度大(刚玉的主要成分是Al2O3,把含少量铬元素的刚玉称为红宝石;含少量的铁和钛元素的刚玉称为蓝宝石;含少量的铬元素的刚玉称为绿宝石)
氧化铝的天然存在形式
【铝土矿】由氧化铝的水合物和少量的氧化铁和二氧化硅杂质组成
【刚玉】氧化铝的天然晶体,硬度大仅次于金刚石、金刚砂。含少量铬元素—红宝石;含少量的铁和钛元素—蓝宝石;含少量的铬元素—绿宝石
【典例1】下列关于金属铝的叙述中,说法不正确的是( ) A.铝的化学性质很活泼,但在空气中不易锈蚀 B.铝是比较活泼的金属,在化学反应中容易失去电子,表现出还原 性 C.铝箔在空气中受热可以熔化,且发生剧烈燃烧 D.铝箔在空气中受热可以熔化,但由于氧化膜的存在,熔化的铝并 不滴落
【解析】尽管铝的化学性质很活泼,但在空气中易与氧气反应,生成一层稳定的致密氧化膜,故不易被锈蚀,A项正确;B项正确;铝箔在空气中受热可以熔化,但形成的氧化膜使得铝与氧气不再反应,因而也就不会燃烧,C项错;D项正确。四 金属与氯气、硫的反应。
【典例2】用氧化铝为原料来制取氢氧化铝的最好的方法是( ) A.将氧化铝粉末溶于水 B.将氧化铝粉末溶于盐酸,再滴加氢氧化钠溶液 C.将氧化铝粉末溶于盐酸中,再滴加氨水 D.将氧化铝粉末溶于氢氧化铝溶液中,再滴加盐酸 滴落
【解析】A.氧化铝粉末和水不反应,故A错误;B.过量的NaOH可能会导致Al(OH)3溶解,故B错误;C.氨水不能溶解Al(OH)3但能和AlCl3得到Al(OH)3沉淀,故C正确;D.过量的HCl可能会导致Al(OH)3溶解,故D错误;故选C。
活动二、铝盐的性质及应用、氢氧化铝的制备
任务一、观察明矾样品,观察实验现象,思考明矾具有哪些性质及用途?
KAl(SO4)2·12H2O
①与氨水反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+(过量氨水沉淀不溶解)
②与强加反应:Al3++3OH-(不足)=Al(OH)3↓、Al3++4OH-(过量)==[Al(OH)4]-
净水:KAl(SO4)2===K++Al3++2SO42-,其中Al3+与反应,产生Al(OH)3(胶体),能吸附水中悬浮物形成沉淀,使水澄清。
任务二、讨论交流:氢氧化铝具有哪些重要的性质?根据氢氧化铝的性质如何制备氢氧化铝?完成表格内容。
白色胶状不溶于水的固体,有较强的吸附性
Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O
Al(OH)3+NaOH=Na[Al(OH)4]Al(OH)3+OH-=[Al(OH)4]-
Al3++3NH3·H2O=Al(OH)3↓+3NH4+
[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
Al3++3[Al(OH)4]-=4Al(OH)3↓
氢氧化铝胶体有较强的吸附性,可用于净水;氢氧化铝碱性不强,可以用作胃酸中和剂
【典例1】探究氢氧化铝的两性,最适宜的试剂是( ) A.Al、NaOH溶液、稀盐酸 B.Al2O3、氨水、稀盐酸 C.Al2(SO4)3溶液、NaOH溶液、稀盐酸 D.AlCl3溶液、氨水、稀盐酸
【解析】可溶性的铝盐Al2(SO4)3溶液与少量NaOH溶液反应生成氢氧化铝沉淀,继续加过量的氢氧化钠,氢氧化铝沉淀会溶解,氢氧化铝沉淀中加盐酸也会溶解。
【典例2】下列有关物质的性质与用途具有对应关系的是( ) A.铝的金属活泼性强,可用于制作铝金属制品 B.氧化铝熔点高,可用作电解冶炼铝的原料 C.氢氧化铝受热分解,可用于中和过多的胃酸 D.明矾溶于水并水解形成胶体,可用于净水
【解析】铝的金属活泼性强与可用于制作铝金属制品无对应关系,A项错误;氧化铝熔点高,可用作耐高温材料;铝是活泼金属,用电解法冶炼,选择氧化铝作原料,是因为氧化铝是离子化合物,B项错误;氢氧化铝具有弱碱性,可以中和过多的胃酸,C项错误;明矾的化学式为KAl(SO4)2·12H2O,Al3+发生水解生成Al(OH)3胶体,可以吸附水中悬浮的颗粒物,从而起到净水的作用,D项正确。
铝及其化合物的图像分析
活动一、铝及其化合物的转化关系
任务一、结合铝及其化合物的性质,请自主构建Al3+、Al(OH)3、[Al(OH)4]-的转化模型,写出相应化学方程式,并与大家交流分享。
①Al(OH)3溶于强酸溶液:Al(OH)3+3H+===Al3++3H2O。
②可溶性铝盐与过量的强碱反应:Al3++4OH−(过量)===[Al(OH)4]-
③可溶性铝盐与氨水反应: Al3++3NH3·H2O===Al(OH)3↓+3NH4+可溶性铝盐与四羟基铝酸钠溶液反应:Al3++3[Al(OH)4]-===4Al(OH)3↓可溶性铝盐与少量NaOH溶液反应:Al3++3OH− (少量)===Al(OH)3↓。
④偏铝酸盐溶液与足量的盐酸反应:[Al(OH)4]-+4H+===Al3++4H2O。
⑤偏铝酸盐溶液中加入少量盐酸:[Al(OH)4]-+H+(少量)===Al(OH)3↓+H2O 偏铝酸盐溶液中通入CO2:[Al(OH)4]-+CO2(过量)===Al(OH)3↓+HCO3-
⑥Al(OH)3溶于强碱溶液:Al(OH)3+OH−===[Al(OH)4]-
任务二、讨论交流:铝及其化合物的转化关系有哪些应用?
①制取Al(OH)3:Al3++3NH3·H2O===Al(OH)3↓+3NH4+ [Al(OH)4]-+CO2===Al(OH)3↓+HCO3-(利用Al(OH)3不能溶于碳酸的性质)
②判断离子共存问题:Al3+与OH−等离子不能大量共存;[Al(OH)4]-与H+、HCO3-等离子不能大量共存。
③鉴别(利用滴加试剂顺序不同,现象不同):向AlCl3溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀溶解;向NaOH溶液中滴加AlCl3溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。
④分离提纯:利用Al能溶于强碱溶液,分离Al与其他金属的混合物;利用Al2O3能与强碱溶液反应,分离Al2O3与其他金属氧化物;利用Al(OH)3能与强碱溶液反应,分离Al3+与其他金属阳离子。
【典例1】下列各种物质既能与强酸反应又能与强碱反应的是( ) ①Al ②AlCl3 ③NaCl ④Al(OH)3 ⑤Al2O3 ⑥NaHCO3 A.①②③④⑤⑥ B.①③④⑤ C.④⑤D.①④⑤⑥
【解析】①Al既能与强酸反应产生铝盐和氢气,也能够与强碱反应产生偏铝酸盐和氢气,①符合题意;②AlCl3只能与强碱反应产生偏铝酸盐,但不能与强酸反应,②不符合题意;③NaCl是强酸强碱盐,与强酸、强碱都不反应,③不符合题意;④Al(OH)3既能够与强酸反应产生铝盐和水,也能够与强碱反应产生偏铝酸盐和水,④符合题意;⑤Al2O3既能够与强酸反应产生铝盐和水,也能够与强碱反应产生偏铝酸盐和水,⑤符合题意;⑥NaHCO3既能与强酸反应产生强酸的盐和CO2气体,也能够与强碱反应产生碳酸的正盐和水,⑥符合题意;综上选D。
【典例1】下列离子方程式书写错误的是( ) A.铝粉投入到NaOH溶液中: 2Al+2OH-+4H2O===2[Al(OH)4]-+H2↑ B.Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-===[Al(OH)4]- C.Na[Al(OH)4]溶液中通入少量的CO2: 2[Al(OH)4]-+CO2===2Al(OH)3↓+CO32-+H2O D.Al2O3粉末溶于NaOH溶液中: Al2O3+2OH-+3H2O===2[Al(OH)4]-
【解析】A项应为2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑。
活动二、铝及其化合物的图像及原理
任务一、分析可溶性铝盐溶液与NaOH溶液反应的图像有何特点和规律?完成表格内容。
立即产生白色沉淀→渐多→最多→渐少→消失
无沉淀(有但即溶)→出现沉淀→渐多→最多→沉淀不消失
Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=[Al(OH)4]-
Al3++4OH-=[Al(OH)4]-
任务二、分析偏铝酸盐(四羟基铝酸盐)溶液与盐酸反应的图像的特点和规律,完成表格内容。
无沉淀→出现沉淀→渐多→最多→沉淀不消失
[Al(OH)4]-+H+=Al(OH)3↓+H2O
Al(OH)3+3H+=Al3++3H2O
4H++[Al(OH)4]-=Al3++4H2O
任务三、分析可溶性铝盐溶液与弱碱(氨水)溶液反应的图像、偏铝酸盐溶液与弱酸(CO2)反应的图像有何特点何规律,完成表格内容。
立即产生白色沉淀→渐多→最多→沉淀不消失
Al3++3NH3·H2O=Al(OH)3↓+3NH4+Al3++3[Al(OH)4]-=4Al(OH)3↓
[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
任务四、分析向含MgCl2、AlCl3、盐酸、NH4Cl的混合溶液中,逐滴加入NaOH溶液至过量的图像有何特点何规律,填写表格内容。
开始无沉淀产生,后产生沉淀并逐渐增多,沉淀不变,最后沉淀部分溶解。
Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓
NH4++OH-=NH3·H2O
Al(OH)3+OH-=[Al(OH)4]-
【典例1】下列各组反应中最后仍产生沉淀的是( ) A.Na[Al(OH)4]溶液中加入过量盐酸 B.KAl(SO4)2溶液中加入过量氨水 C.AlCl3溶液中加入过量NaOH溶液 D.NaOH溶液中加入少量AlCl3溶液
【解析】A.Na[Al(OH)4]溶液中加入过量盐酸,生成了AlCl3,A不符合题意;B.KAl(SO4)2溶液中加入过量氨水,生成了Al(OH)3沉淀,B符合题意;C.AlCl3溶液中加入过量NaOH溶液,生成了Na[Al(OH)4],C不符合题意;D.NaOH溶液中加入少量AlCl3溶液,溶液中NaOH过量,生成了Na[Al(OH)4]-,D不符合题意;故答案选B。
【典例2】如下六个图中,横坐标为某溶液中加入某物质的物质的 量,纵坐标为生成沉淀的物质的量,将图中的字母代号填入下表。
【解析】①发生如下反应:Ca(OH)2+CO2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,故其沉淀生成与消失时消耗的CO2的物质的量是相同的,其图象应为B。②AlCl3溶液中通入NH3只发生反应:3H2O+AlCl3+3NH3=3NH4Cl+Al(OH)3↓,生成的Al(OH)3不能溶于弱碱溶液中,其对应图象应为C。③发生如下反应:MgCl2+2NaOH=Mg(OH)2↓+2NaCl,AlCl3+3NaOH=Al(OH)3↓+3NaCl,故先生成沉淀,当NaOH过量时又发生如下反应而部分溶解:Al(OH)3+NaOH=Na[Al(OH)4],因Mg(OH)2与碱不反应,故沉淀不能完全消失,因此其对应图象为A。④发生如下反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=Na[Al(OH)]4。其反应现象为先生成白色沉淀,再逐渐溶解且前后消耗NaOH的物质的量之比为3∶1,故其对应图象为E。⑤发生的反应有:HCl+NaOH=NaCl+H2O,AlCl3+3NaOH=3NaCl+Al(OH)3↓,Al(OH)3+NaOH=Na[Al(OH)4]。此时优先发生的是酸碱中和反应,故开始时应无沉淀产生,后续反应与上述④中相同,故其图象应为F。
1.下列关于铝及其化合物的说法正确的是( ) A.铝制品在生活中被广泛使用,说明铝是一种不活泼的金属 B.氧化铝的熔点很高,是一种较好的耐火材料 C.Al(OH)3碱性很强,故可用于治疗胃酸过多 D.铝是地壳中含量最多的元素
【解析】A.铝易被氧化生成氧化铝,在铝表面形成一层致密的氧化铝膜,可保护铝进一步被腐蚀,所以铝制品在生活中被广泛使用,并不是铝不活泼,A错误;B.氧化铝的熔点很高,很难熔化,是一种较好的耐火材料,B正确;C.Al(OH)3碱性很弱,能和胃酸反应,同时由于碱性弱、无毒,所以常用于治疗胃酸过多,C错误;D.铝是地壳中含量最多的金属元素,地壳中含量最多的元素为O元素,D错误;综上所述答案为B。
2.用含有少量镁的铝片制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )①加盐酸溶解 ②加过量烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液生成Al(OH)3沉淀A.①⑤⑥③ B.②③⑥③ C.②③④③ D.②③⑤③
【解析】利用铝既能与酸反应,又能与碱反应的特点,先加入过量烧碱溶液溶解,过滤除去镁,氢氧化铝不与弱酸反应,所以通入过量CO2可以得到Al(OH)3沉淀,过滤即可得到氢氧化铝沉淀。
3.下列离子方程式书写正确的是( )A.向硝酸铝溶液中通入过量氨气:4NH3+Al3++4H2O=[Al(OH)4]-+4NH4+B.将铝片打磨后置于NaOH溶液中:2Al+2H2O+2OH-=2[Al(OH)4]-+H2↑C.向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+[Al(OH)4]-D.向Na[Al(OH)4]溶液中通入足量CO2:2[Al(OH)4]-+CO2=2Al(OH)3↓++H2O+CO32-
【解析】A.硝酸铝与过量氨气、水反应生成氢氧化铝沉淀和硝酸铵,离子方程式是3NH3+3H2O+Al3+=Al(OH)3↓+3NH4+,故A错误;B.将铝片打磨后置于NaOH溶液中,Al和NaOH溶液反应生成偏铝酸钠和氢气:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,故B错误;C.向明矾溶液中加入过量的Ba(OH)2溶液,Al3+和SO42-按1:2参与反应,生成硫酸钡沉淀和偏铝酸钠和水,离子方程式是Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+[Al(OH)4]-,故C正确;D.向Na[Al(OH)4]溶液中通入足量CO2生成氢氧化铝沉淀和碳酸氢钠,反应离子方程式是[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-,故D错误;故选C。
4.若下列图像中横轴代表所加溶液体积,纵坐标代表生成沉淀质量,则各项描述中与图像能对应的是( )A.图①可能是MgCl2、AlCl3溶液逐滴加氨水至过量B.图②可能是AlCl3溶液逐滴加NaOH溶液至过量C.图③可能是Na[Al(OH)4]溶液滴加稀盐酸至过量D.图④可能是含一定量HCl的AlCl3溶液逐滴加氨水至过量
【解析】A.MgCl2、溶液中滴加氨水至过量,应生成沉淀氢氧化镁、氢氧化铝,由于氢氧化铝不溶于弱碱,所以沉淀完全后不再变化,A错误;B.向AlCl3溶液中滴加NaOH溶液至过量,先生成氢氧化铝沉淀,氢氧化钠过量后沉淀溶解生成偏铝酸钠,发生的反应为:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=[Al(OH)4],两过程中氢氧化钠的用量为3:1,与图象不符合,B错误;C.向Na[Al(OH)4]溶液中滴加稀盐酸至过量且边滴边振荡,开始会生成沉淀,当偏铝酸钠完全沉淀后继续滴入盐酸,沉淀会溶解,发生的反应为:[Al(OH)4]+H+=Al(OH)3↓、Al(OH)3+3H+=Al3++3H2O,两过程消耗盐酸量为1:3,与图象不符合,C不正确;D.向含一定量HCl的AlCl3溶液逐滴加氨水至过量,氨水首先与盐酸发生中和反应,然后沉淀铝离子,由于氨水不能溶解氢氧化铝,所以沉淀达到最大值以后,不再发生变化,D正确,答案选D。
可溶性铝盐溶液与NaOH溶液反应四羟基铝酸盐溶液与盐酸反应可溶性铝盐溶液与弱碱溶液反应含铝混合溶液与NaOH溶液
相关课件
这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物公开课课件ppt,共38页。PPT课件主要包含了铁的钝化应用等内容,欢迎下载使用。
这是一份化学必修 第一册第二章 海水中的重要元素——钠和氯第二节 氯及其化合物完整版课件ppt,共39页。PPT课件主要包含了氯气泄漏事件福建,氯水的多重性及检验,理论分析,含氯物质的性质及应用,几种含氯物质及应用等内容,欢迎下载使用。
这是一份化学必修 第一册第二单元 硫及其化合物的相互转化图文ppt课件,共26页。









