


高中化学人教版 (2019)必修 第一册第二节 元素周期律完美版课件ppt
展开1.结合有关数据和实验事实认识原子结构核外电子排布、元素最高化合价和最低化合价、原子半径等随元素原子序数递增而呈周期性变化的规律。 2.以第三周期元素为例,认识同周期元素的金属性、非金属性等随元素原子序数递增而呈周期性变化的规律,建构元素周期律。 3.通过实验探究,归纳同周期元素金属性、非金属性变化规律,学会判断元素金属性、非金属性的强弱的基本方法,进一步发展抽象、归纳以及演绎、推理能力。
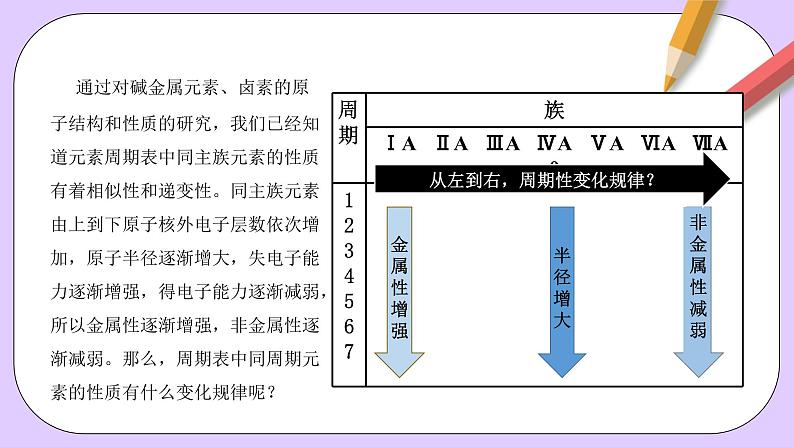
通过对碱金属元素、卤素的原子结构和性质的研究,我们已经知道元素周期表中同主族元素的性质有着相似性和递变性。同主族元素由上到下原子核外电子层数依次增加,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱,所以金属性逐渐增强,非金属性逐渐减弱。那么,周期表中同周期元素的性质有什么变化规律呢?
从左到右,周期性变化规律?
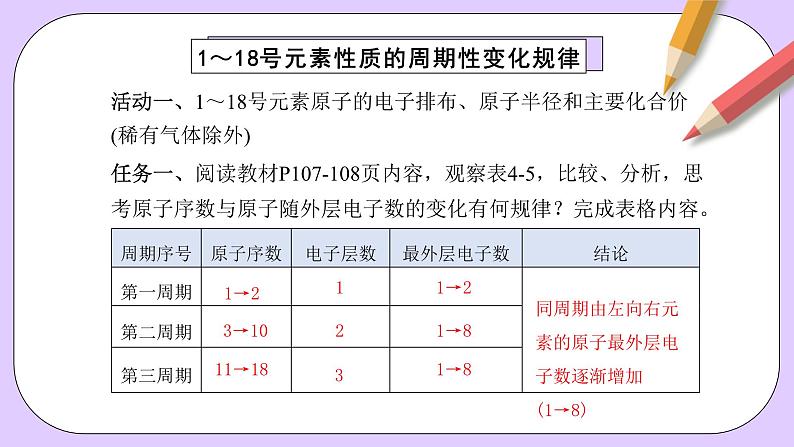
1~18号元素性质的周期性变化规律
活动一、1~18号元素原子的电子排布、原子半径和主要化合价(稀有气体除外)
任务一、阅读教材P107-108页内容,观察表4-5,比较、分析,思考原子序数与原子随外层电子数的变化有何规律?完成表格内容。
同周期由左向右元素的原子最外层电子数逐渐增加(1→8)
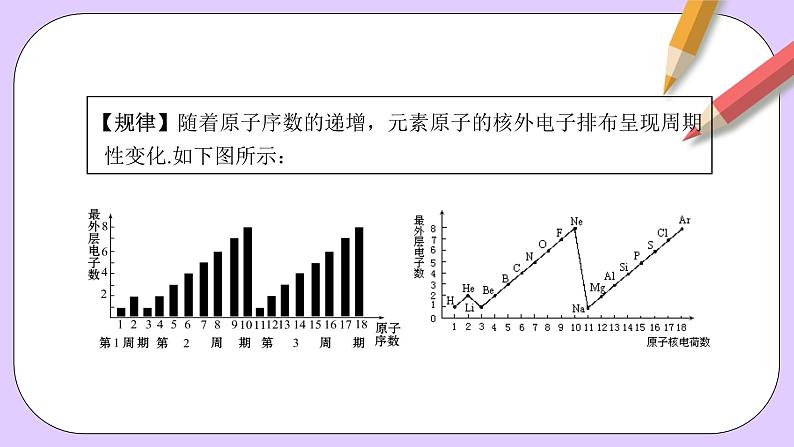
【规律】随着原子序数的递增,元素原子的核外电子排布呈现周期 性变化.如下图所示:
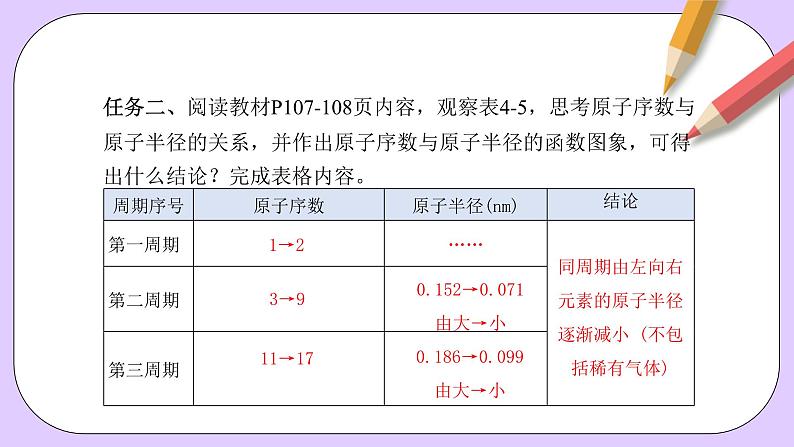
任务二、阅读教材P107-108页内容,观察表4-5,思考原子序数与原子半径的关系,并作出原子序数与原子半径的函数图象,可得出什么结论?完成表格内容。
同周期由左向右元素的原子半径逐渐减小 (不包括稀有气体)
0.152→0.071由大→小
0.186→0.099由大→小
【规律】随着原子序数的递增,元素的原子半径由大到小(原子核对核外电子的引力逐渐增大)呈现周期性变化。如下图所示:
任务三、阅读教材P107-108页内容,观察表4-5,作出原子序数与元素化合价函数图象,由此可得出什么规律?并完成表格内容
①原子序数与元素化合价函数图象(横坐标---原子序数,纵坐标---元素的主要化合价)。如下图:
②同周期主族元素的主要化合价
最高价+1→+5(不含O、F) 最低价-4→-1
最高价+1→+7 最低价-4→-1
【规律】随着原子序数的递增,元素的主要化合价呈现周期性变化。具体表现: ①随着元素核电荷数的递增,同一周期元素的最高正价呈现由+1到+7、最低负 价呈现由-4到-1的周期性变化; ②最外层电子数=最高正价;最高正价+|最低负价|=8(H、O、F除外); ③主族序数=最高正价=最外层电子数(O、F除外)。
【温馨提示】金属无负价;H最高价为+1,最低价为-1;O无最高正价,最低价为-2;F无正化合价,最低价为-1
【典例1】对于原子核外电子层数为3的元素,随着最外层电子数的增大,下列说法中错误的是( ) A.原子半径逐渐减小 B.原子的失电子能力逐渐增强 C.最高正化合价逐渐增大 D.元素的非金属性逐渐增强
【解析】原子核外电子层数为3的元素,随着最外层电子数的增大,原子半径依次减小,A正确;原子核外电子层数为3的元素,随着最外层电子数的增大,原子得电子能力依次增强,B错误;原子核外电子层数为3的元素,随着最外层电子数的增大,最高正化合价逐渐增大,C正确;原子核外电子层数为3的元素,随着最外层电子数的增大,元素的非金属性逐渐增强,D正确;故选B。
下列叙述正确的是( ) A.X、Y元素的金属性:X
【解析】根据提供的原子半径和主要化合价,可以推断X为Mg,Y为Al,Z为N,W为O。金属性Mg>Al,A项错误;N2和O2在放电的条件下生成NO,B项错误;Al的最高价氧化物对应的水化物为Al(OH)3,不能溶于稀氨水,C项错误;NH3在纯氧中燃烧:4NH3+3O2=2N2+6H2O,O2从NH3中置换出N2,D项正确。
活动二、元素原子核外电子排布、原子半径和化合价周期性变化规律
任务一、结合教材P108页“思考与讨论”,回答元素原子的核外电子排布、原子半径和化合价各呈现什么规律性的变化?完成表格内容。
随着原子序数的递增,原子的核外电子排布、原子半径、化合价均呈现周期性的变化。
+1→+5、-4→-1→0
+1→+7、-4→-1→0
任务二、拓展探究:影响原子半径大小的因素有哪些?如何比较微粒半径的大小?
①电子层数相同,质子数越多,吸引力越大,半径越小;最外层电子数相同,电子层数越多,电子数越多,半径越大。
②“三看”比较微粒半径的大小:
“一看”微粒的电子层数,电子层越多则微粒半径一般越大;
“二看”微粒的核电荷数,电子层数时,核电荷数越大则微粒的半径一般越小;
“三看”最外层电子数。电子层数和核电荷数相同时,最外层电子数多,半径越 大;反之,半径越小。
③核外电子排布相同的微粒(电子层数相同、各电子层上的电子数分别相同),r(阳离子)
同主族元素原子半径、离子半径随原子序数增加而增大。如r(Li)
【解析】元素的性质呈周期性变化,根本原因是原子核外电子排布呈周期性变化,故答案选C。
【典例2】下列关于Na、Mg、S、Cl元素及其化合物的说法正确的 是( ) A.NaOH的碱性比 Mg(OH)2 的弱 B.原子半径r∶ r(Cl)>r(S)>r(Na) C.Cl2得到电子的能力比 S 的弱 D.原子的最外层电子数∶n(Cl)> n(S)> n(Mg)
【解析】同一周期,从左到右,金属性减弱,金属性钠大于镁,所以碱性:NaOH> Mg(OH)2 ,A错误;同一周期,从左到右,原子半径逐渐减小,所以原子半径r∶ r(Cl)
同周期元素金属性和非金属性的递变规律
活动一、预测第三周期元素金属性和非金属性的递变规律
任务一、讨论交流:回顾已学知识,思考判断元素金属性和非金属性强弱的依据有哪些?
电子层数越多,最外层电子数越少,金属性越强。
金属活动性顺序表中越靠前的金属性越强,反之金属性越弱。
与水或酸反应难易:Na>Mg,则金属性Na>Mg。
碱性:NaOH>Mg(OH)2,则金属性Na>Mg。
非金属性强弱的判断方法
气态氢化物越稳定非金属性越强。如稳定性:HCl>H2S,则非金属性:Cl>S。
单质与氢气化合时,生成气态氢化物越容易,元素的非金属性越强。如F2与H2混合,暗处就会爆炸,而Br2与H2反应时,需要加热。则非金属性:F>Br。
最高价氧化物水化物酸性越强,非金属性越强。如酸性:HClO4>H3PO4,则非金属性:Cl>P。
任务二、问题探究:根据第三周期元素原子的核外电子排布规律,你能推测出该周期元素金属性和非金属性的变化规律吗?
①第三周期元素原子结构特点:
②根据结构决定性质:电子层数相同,核电荷数增大→原子半径逐渐减小→原子核对最外层电子的引力逐渐增强→失电子能力减弱,得电子能力增强→金属性逐渐减弱,非金属性逐渐增强。
【典例1】下列叙述中,能肯定A金属比B金属活泼性强的是( ) A.A原子的最外层电子数比B原子的最外层电子数少 B.A原子的电子层数比B原子电子层数多 C.1 ml A从酸中置换出的H2比1 ml B从酸中置换出的H2多 D.常温时,A能从冷水中置换出H2,而B不能
【解析】 选项A中只指出A、B两种元素原子的最外层电子数的多少,不能确定A、B的金属性强弱;选项B中指出了A、B原子的电子层数的多少,但电子层数少的原子的金属性不一定比电子层数多的金属性弱;选项C中没有说明反应的剧烈程度,与酸反应生成氢气多的金属活泼性不一定强;选项D正确,只有很活泼的金属在常温下能与冷水反应。
【典例2】元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )A.同一元素不可能既表现金属性,又表现非金属性B.短周期元素形成离子后,最外层电子都达到8电子稳定结构C.元素周期表中同一周期元素电子层数相同D.金属性强的金属都可以把金属性弱的金属从水溶液中置换出来
【解析】 同一元素比如氢元素,既能表现金属性,又能表现非金属性,A不正确;短周期元素形成离子后,最外层电子不一定达到8电子稳定结构。比如H、Be等元素,B不正确;周期数=电子层数,所以元素周期表中同一周期元素,电子层数相同,C正确;如果金属能与冷水反应,则金属性强的金属不能把金属性弱的金属从水溶液中置换出来,D不正确。
活动二、实验验证第三周期元素金属性和非金属性的递变规律
任务一、根据教材P109页“探究”栏目内容,完成实验或观看实验视频,根据实验现象,分析实验原理,填写表格内容。
①Na、Mg、Al金属性强弱比较
与冷水剧烈反应,放出大量的热,并产生气体
与冷水几乎不反应,与沸水缓慢反应,与酸剧烈反应
与沸水反应很慢,与酸反应较快
随着核电荷数减小,与水(或酸)反应越来越剧烈
Al(OH)3两性氢氧化物
NaOH>Mg(OH)2>Al(OH)3
②Si、P、S、Cl非金属性强弱比较
随着核电荷数增加,最高价氧化物对应水化物的酸性越来越强
HClO4(最强的无机含氧酸)
随着核电荷数增加,气态氢化物越来越稳定
随着核电荷数增加,与氢气化合越来越容易
任务二、讨论交流:阅读教材P110第1、2自然段,思考元素周期律的定义、内容与实质分别是什么?
①同一周期元素,电子层数相同,从左到右,核电荷数依次增多,最外层电子数逐渐增多,原子半径逐渐减小,越容易得到电子形成稳定结构,非金属性逐渐增强,金属性逐渐减弱。
②元素周期律的定义:元素的性质随原子序数的递增而呈周期性的变化。
③元素周期律的内容:原子半径、主要化合价、金属性和非金属性等。
④元素周期律的实质:元素原子的核外电子排布的周期性变化。即元素原子核外电子排布的周期性变化决定了元素性质的周期性变化。
【典例1】下列有关性质的比较,不能用元素周期律解释的是( ) A.碱性:NaOH>LiOH B.酸性:H2SO4>H3PO4 C.热稳定性:Na2CO3>NaHCO3D.非金属性:Cl>S
【解析】A项,同一主族从上到下,元素的最高价氧化物对应水化物碱性逐渐增强,则碱性:NaOH>LiOH,能用元素周期律解释,不符合题意;B项,同一周期从左到右,元素的最高价氧化物对应水化物酸性逐渐增强,则酸性:H2SO4>H3PO4,能用元素周期律解释,不符合题意;C项,碳酸氢钠受热分解生成碳酸钠,热稳定性:Na2CO3>NaHCO3,不能用元素周期律解释,符合题意;D项,同周期从左到右元素的非金属性依次增强,非金属性:Cl>S,能用元素周期律解释,不符合题意。
【典例2】W、X、Y、Z是4种常见的短周期元素,其原子半径随原 子序数变化如图所示。已知W的一种核素的质量数为18,中子数为 10;X和氖原子的核外电子数相差1;Y的单质是一种常见的半导体 材料;Z的非金属性在同周期元素中最强,下列说法正确的是( ) A.X的非金属性是同周期中最强的 B.对应气态氢化物的稳定性:Y>Z C.对应简单离子半径:X>W D.Y的氧化物能与X的最高价氧化物对应的水化物反应
【解析】根据条件可知,W的原子序数是8,则W是氧元素,又因为W、X、Y、Z的原子序数递增,原子半径X最大,且X和氖原子的核外电子数相差1,故X是钠,Y的单质是一种常见的半导体材料,则Y是硅,Z的非金属性在同周期元素中最强,则Z是氯。X的金属性是同周期中最强的,A错误;对应气态氢化物的稳定性:Z>Y,B错误;氧离子和钠离子具有相同的核外电子排布,对应简单离子半径:W>X,C错误;Y的氧化物是二氧化硅,能与X的最高价氧化物对应的水化物氢氧化钠反应,D正确。
1.下列关于元素周期律的叙述正确的是( ) A.随元素原子序数的递增,原子最外层电子数总是从1到8重复出现 B.元素的性质随着原子序数的递增而呈周期性变化 C.随元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 D.元素性质的周期性变化的根本原因是:原子半径的周期性变化及元素主要化合价的周期性变化
【解析】 A项错误,随着元素原子序数的递增,原子最外层电子数在第一周期从1到2,而不是从1到8;B项正确,是元素周期律的内容;C项错误,负价一般是从-4到-1,而不是从-7到-1;D项错误,核外电子排布的周期性变化是元素性质周期性变化的根本原因。
2.下列叙述中,正确的是( )A.C、N、O元素的单质与氢气化合越来越难B.Li、Na、K的氧化物的水化物的碱性依次减弱C.Na、Mg、Al的简单离子的半径逐渐减小D.P、S、Cl元素的最高正价依次升高,其对应的气态氢化物的稳定性依次减弱
【解析】 元素的非金属性:C<N<O,则C、N、O元素的单质与氢气化合越来越易,A错误;元素的金属性:Li<Na<K,则Li、Na、K的氧化物的水化物的碱性依次增强,B错误;Na+、Mg2+、Al3+的核外电子排布都是2、8,离子核外电子层结构相同。所以Na、Mg、Al的简单离子的半径逐渐减小,C正确;元素的非金属性:P<S<Cl,则P、S、Cl元素的最高正价依次升高,其对应的气态氢化物的稳定性依次增强,D错误;故合理选项是C。
3.不能说明钠的金属性比镁强的事实是( )A.钠的最高化合价为+1,镁的最高化合价为+2B.NaOH的碱性比Mg(OH)2强C.钠与冷水反应剧烈,镁与冷水不易反应D.在熔化状态下,钠可以从MgCl2中置换出镁
【解析】 元素的金属性是指原子失去电子的能力的强弱,与失去电子多少无关,也与化合价无关,故A符合题意;元素的金属性越强,最高价氧化物对应水化物的碱性越强,则氢氧化钠的碱性强于氢氧化镁能说明钠的金属性比镁强的事实,故B不符合题意;元素的金属性越强,与酸或水反应越剧烈,则钠与冷水反应剧烈,镁与冷水不易反应能说明钠的金属性比镁强的事实,故C不符合题意;在熔化状态下,钠可以从MgCl2中置换出镁能说明钠的金属性比镁强的事实,故D不符合题意;故选A。
4.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )A.元素周期表中左下方区域的金属元素多用于制造半导体材料B.第三周期主族元素的最高正化合价等于它所处的主族序数C.短周期元素形成离子后,最外层都达到8电子稳定结构D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
【解析】 元素周期表中金属与非金属分界线附近的元素多用于制造半导体材料,故A错误;第三周期主族元素的最高正化合价等于最外层的电子数,与它所处的主族序数相等,故B正确;短周期元素形成离子后,最外层不一定都达到8电子稳定结构,如H-的最外层电子数为2,故C错误;同一主族元素的原子,最外层电子数相同,但电子层数不同,原子半径不同,化学性质相似,但不完全相同,故D错误;故选B。
+1~+7或-4~-1
碱性逐渐减弱,酸性逐渐增强
碱性逐渐增强,酸性逐渐减弱
生成由难渐易,稳定性逐渐增强
生成由易渐难,稳定性逐渐减弱
人教版 (2019)必修 第一册第二节 元素周期律教学ppt课件: 这是一份人教版 (2019)必修 第一册第二节 元素周期律教学ppt课件,共33页。PPT课件主要包含了素养要求,元素性质的递变规律,当堂练习等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律集体备课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律集体备课课件ppt,共24页。PPT课件主要包含了最外层电子数1→2,最外层电子数1→8,原子半径逐渐减小等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律说课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律说课课件ppt,共24页。PPT课件主要包含了最外层电子数1→2,最外层电子数1→8,原子半径逐渐减小等内容,欢迎下载使用。













