




人教版 (2019)必修 第一册第三节 化学键优质课课件ppt
展开1.以氯化钠的形成过程为例,从微观角度分析宏观物质的形成过程,认识离子键的形成,建立共价键的概念,初步建立化学键的概念,培养宏观辨识与微观探析的化学核心素养。 2.通过阅读思考,讨论交流,理解离子键的形成过程和形成条件,能用电子式对离子键进行表征,能熟练地用电子式表示离子化合物的形成过程。
由元素周期表可知,到目前为止,已经发现的元素有一百多种。然而,由这一百多种元素的原子构成的物质已超过1亿种。那么,元素的原子之间通过什么作用形成如此丰富的物质呢?如氢分子是由氢原子构成,要想使氢分子分解成氢原子需要加热到温度高达2000℃,它的分解率仍不到1%,说明在 氢分子里氢原子与氢原子之间存在强烈的相互作 用,这种强烈的相互作用就是今天我们要学习的 化学键,化学键有多种类型,在此先讨论离子键。
活动一、氯化钠的形成过程
任务一、思考交流:氧化还原反应的本质是什么?有哪些具体表现?
①氧化还原反应的本质是有电子的转移,包括电子得失(活泼金属与活泼非金属化合)和共用电子对偏移(非金属与非金属化合)两个方面。
②如通过不稳定的钠原子失去电子形成稳定的钠离子(Na→Na+),不稳定的氯原子得到电子形成稳定的氯离子(Cl→Cl-),钠离子和氯离子再形成NaCl;不稳定的氢原子和不稳定的氯原子,通过形成共用电子对,并偏向氯原子,偏离氢原子形成HCl。
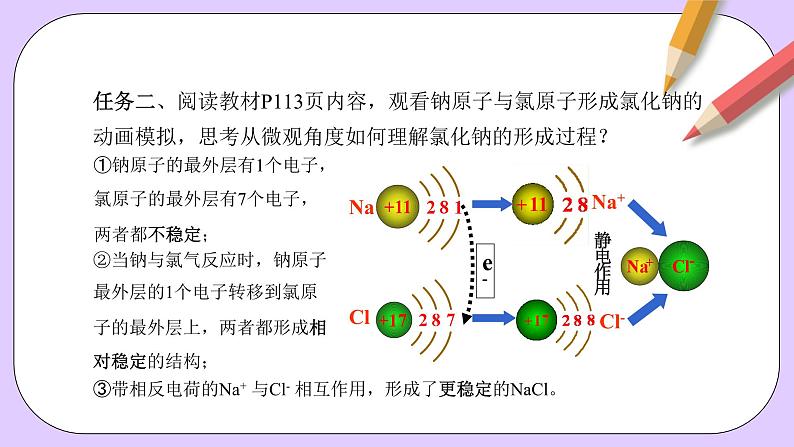
任务二、阅读教材P113页内容,观看钠原子与氯原子形成氯化钠的动画模拟,思考从微观角度如何理解氯化钠的形成过程?
①钠原子的最外层有1个电子,氯原子的最外层有7个电子,两者都不稳定;
②当钠与氯气反应时,钠原子最外层的1个电子转移到氯原子的最外层上,两者都形成相对稳定的结构;
③带相反电荷的Na+ 与Cl- 相互作用,形成了更稳定的NaCl。
任务三、根据教材P113页内容,请回答离子键的定义及实质是什么?
阴、阳离子键间的静电作用(包括静电引力和静电斥力)。
一般是活泼金属元素与活泼非金属元素。
阴、阳离子之间结合成化合物的静电作用(或带相反电荷离子之间的相互作用)叫做离子键。
【典例1】如图形象地表示了氯化钠的形成过程。下列相关叙述中不 正确的是 ( ) A.钠原子易失去一个电子,氯原子易得到一个电子 B.钠离子与钠原子有相似的化学性质 C.钠原子与氯原子作用生成NaCl后,其稳定性增强 D.构成氯化钠的粒子是钠离子和氯离子
【解析】钠原子最外层只有1个电子,当它失去1个电子后形成的Na+具有最外层8个电子的稳定结构,氯原子最外层有7个电子,当它得到1个电子后形成的Cl-具有最外层8个电子的稳定结构,Na+和Cl-通过静电作用形成离子键,从而构成离子化合物NaCl。
【典例2】下列说法不正确的是( ) A.凡金属元素跟非金属元素化合时都能形成离子键 B.原子间先通过得失电子变成阴阳离子后,阴阳离子间才能形成离 子键 C.具有强得电子能力的原子与具有强失电子能力的原子相遇时能形成离子键 D.一般情况下,活泼金属(第Ⅰ A、Ⅱ A族金属)和活泼的非金属(第 Ⅵ A、Ⅶ A族非金属)之间化合时,易形成离子键
【解析】A.氯元素和铝元素化合时形成共价键,故A符合题意;B.原子间通过得失电子变成阴阳离子后形成离子键,故B不符合题意;C.具有强得电子能力的原子与具有强失电子能力的原子相遇时,能形成离子键,故C不符合题意;D.一般情况下,活泼金属(第Ⅰ A、Ⅱ A族金属)和活泼的非金属(第Ⅵ A、Ⅶ A族非金属)它们之间化合时,都易形成离子键,例如氯化钠,故D不符合题意;故答案为:A。
活动二、离子键的形成条件及存在
任务一、讨论交流:根据离子键的成键实质,思考离子键的形成条件是什么?
①活泼金属元素和活泼非金属元素,如ⅠA、ⅡA族的金属元素和ⅥA、ⅦA族的非金属元素。如NaCl、MgCl2、KCl、Na2O、MgO等。
②金属阳离子或NH4+和某些带负电荷的原子和原子团。如NaOH、Na2SO4、NH4Cl等。
任务二、问题探究:形成离子键的原因是什么?从物质类别看离子键可能存在于哪些物质中?
①形成离子键的原因是原子间相互得失电子形成稳定的阴、阳离子,使体系的总能量降低。
②离子键存在于强碱,如NaOH、KOH等;活泼金属氧化物,如Na2O、K2O、CaO、MgO等;绝大多数盐类,如NaCl、NH4Cl、BaSO4等。
【典例1】下列叙述错误的是( ) A.带相反电荷离子之间的相互吸引称为离子键 B.金属元素与非金属元素化合时,不一定形成离子键 C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的 化学键不一定是离子键 D.非金属元素原子间不可能形成离子键
【解析】A.带相反电荷离子之间的相互作用称为离子键,故A正确;B.金属元素与非金属元素化合时,可能形成离子键或共价键,如NaCl为离子键,氯化铝为共价键,故B正确;C.某元素的原子最外层只有一个电子,可能为H,跟卤素结合所形成的化学键为共价键,故C正确;D.非金属原子间可能形成离子键,如铵盐中存在离子键,故D错误;故选D。
【典例2】下列说法正确的是( )A.钠原子与氯原子反应生成食盐后,其结构的稳定性增强B.阴、阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的 核间距离相当小C.失电子难的原子获得电子的能力一定强D.任何离子键在形成过程中必定有电子的得与失
【解析】金属钠和氯气反应生成离子化合物氯化钠后,各原子都变成8电子稳定结构的离子,A项正确;在离子键中,既有阴、阳离子的相互吸引,又有电子与电子、原子核与原子核之间的排斥作用,B项错误;失电子难的原子获得电子的能力不一定强,如稀有气体原子,C项错误;在离子相交换过程中及离子化合物从溶液结晶过程中所形成的离子键,并没有电子得失,D项错误;答案选A。
活动一、离子化合物的概念及形成条件
任务一、阅读教材P113页5、6自然段,回答什么是离子化合物?
①由离子键构成的化合物叫做离子化合物,通常由活泼金属和活泼非金属或铵根离子和酸根离子形成。如NaF、Na2S、Al2O3、Na2CO3、NH4Cl、NH4Br 等化合物。
a.活泼金属阳离子和活泼非金属阴离子形成的化合物;
b.活泼金属阳离子和酸根离子形成的盐;
c.铵根离子和酸根离子(或活泼非金属阴离子)形成的盐。
任务二、拓展提升:结合氯化钠的性质,思考离子化合物在组成和性质上有哪些特点?
①在离子化合物里阳离子所带的正电荷总数等于阴离子所带的负电荷总数,整个化合物呈电中性;
②多数离子化合物在固态(或晶态)时不能导电,而它的水溶液或熔化状态则能导电;
③离子化合物一般说来,熔点和沸点较高,硬度较大,质脆,难于压缩,难挥发;
④离子化合物由阴阳离子构成,阴阳离子之间通过离子键连接。如氯化钠中不存在单个的NaCl分子,阴阳离子个数比是1:1,NaCl是表示离子个数比的化学式,而不是表示分子组成的分子式。
【典例1】下列关于离子化合物的叙述正确的是( )A.离子化合物中可能存在共价键 B.离子化合物中阳离子一定是金属离子 C.离子化合物的水溶液一定能导电 D.离子键在形成过程中一定有电子的得失
【解析】离子化合物中存在离子键也可能同时存在共价键,例如过氧化钠中含有离子键和共价键,A正确;离子化合物中阳离子不一定是金属离子,例如氯化铵中的铵根离子,B错误;溶液导电的原因是存在自由移动的离子,离子化合物的水溶液不一定能导电,例如难溶性硫酸钡的溶液几乎不导电,C错误;离子键是阴阳离子通过静电作用形成的,在形成过程中不涉及电子的得失,在离子形成的过程中涉及电子得失,D错误。
【典例2】下列关于离子键和离子化合物的说法正确的是 ( ) A.阴、阳离子间通过静电引力形成离子键 B.阴、阳离子间通过离子键一定能形成离子化合物 C.离子化合物都能导电,它们都是电解质杨sir化学,侵权必究 D.只有活泼金属元素和活泼非金属元素化合时,才能形成离子键
【解析】A.离子键是阴、阳离子间的静电引力与静电斥力,达到平衡时的一种静电作用,故错误;B.离子化合物是阴、阳离子通过离子键而形成的化合物,故正确;C.离子化合物固态时不能导电,其水溶液或熔融状态下能导电,都是电解质;D.非金属元素原子间可能形成离子键,如氯化铵中的铵根离子与氯离子形成离子键,故错误。故选B。
活动二、电子式及书写方法
任务一、阅读教材P113页“资料卡片”,回答什么是电子式?原子、离子及离子化合物的电子式有何特点?完成表格内容。
①定义:在元素符号的周围用“·”或“×”来表示原子的最外层电子(价电子)的式子叫电子式。
先写出元素符号,再在元素符号的周围用“·”或“×”来表示原子的最外层电子数。注意:一个“×”或“·”代表一个电子,原子的电子式中“×”(或“·”)的个数即原子的最外层电子数;同一原子的电子式不能既用“×”又用“·”表示。
b.简单阴离子得到电子后最外层一般为8电子结构,书写时要在元素符号周围标出电子,用“[ ]”括起来,并在右上角注明所带电荷数。注意:复杂的阳离子用“[ ]”加电荷数表示。如铵根离子 等。
a.简单阳离子是原子失去最外层电子后形成的,其电子式就是阳离子。
离子化合物的电子式由阴、阳离子的电子式组成,相同的离子不合并,阴阳离子间隔排列,将阴阳离子(阳离子在前,阴离子在后.)拼在一起。
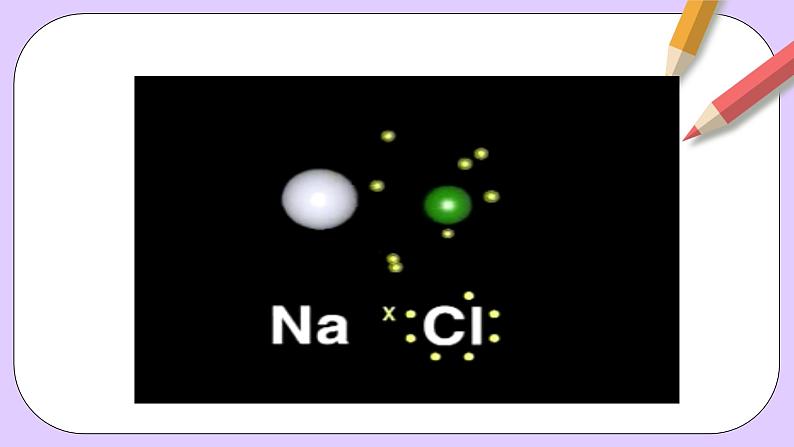
任务二、观察教材P113页氯化钠形成观察的电子表示式,思考用电子式表示离子化合物的形成过程要注意哪些问题?
①用电子式表示离子化合物的形成过程中不但要表示出离子化合物的电子式,还要同时写成方程式的形式。
②反应物均用原子的电子式表示,而不是用分子式或分子的电子式表示,且反应物中相同原子可以合并写。生成物是离子化合物的电子式,且化合物中相同原子必须分开写;
③反应物和生成物之间用箭头而不用等号表示,形成符合质量守恒定律;
1.下列关于离子键和离子化合物的说法正确的是( ) A.离子键是指带相反电荷的阴、阳离子之间的相互吸引作用 B.离子键只能在活泼金属和活泼非金属元素原子之间形成 C.离子键的作用仅仅局限于相邻的两个阴、阳离子之间 D.CaO、NaCl、NaOH中均存在离子键,都是离子化合物
【解析】离子键是指阴、阳离子之间的静电作用,包括引力和斥力,A错误;不是只有活泼的金属元素和活泼的非金属元素之间才能形成离子键,如铵离子与氯离子也能形成离子键,B错误;离子键的作用不仅局限于相邻的两个阴、阳离子之间,还存在于原子核和电子之间,C错误;CaO、NaCl、NaOH都是由活泼金属阳离子与阴离子构成的,均存在离子键,都是离子化合物,D正确;故答案为:D。
2.下列说法正确的是 ( )A.离子键就是使阴、阳离子结合成化合物的静电引力B.所有金属与所有非金属原子之间都能形成离子键C.在化合物CaCl2中,两个氯离子之间存在共价键D.含有离子键的化合物一定是离子化合物
3.下列表示物质结构的化学用语正确的是 ( )A.H、D、T表示同一种核素B.MgCl2的形成过程:C.Cl-的结构示意图:D.NH4Cl的电子式:
4.以下叙述中,错误的是 ( )A.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强B.在氯化钠中,除氯离子和钠离子的静电吸引作用外,还存在 电子与电子,原子核与原子核之间的排斥作用C.任何离子键在形成的过程中必定有电子的得与失D.钠与氯反应生成氯化钠后,体系能量降低
【解析】活泼的金属原子和活泼的非金属原子之间形成离子化合物,阴离子和阳离子均达到稳定结构,这样体系的能量降低,其结构的稳定性增强,故A、D正确,B也正确。离子键的形成只是阴、阳离子间的静电作用,并不一定发生电子的得失,如Na+与OH-结合成NaOH。
定义:带相反电荷离子之间的相互作用
成键粒子:阴离子和阳离子
成键本质:阴阳离子的静电作用
成键元素:一般活泼金属与活泼非金属
定义:由离子键构成的化合物(可能含有共价键)。
强碱:如NaOH、Ba(OH)2等。
大多数盐:如NaCl、BaSO4等。
活泼金属氧化物:如Na2O、CaO等。
高中第三节 化学键公开课ppt课件: 这是一份高中<a href="/hx/tb_c162000_t3/?tag_id=26" target="_blank">第三节 化学键公开课ppt课件</a>,共23页。PPT课件主要包含了离子键和离子化合物,离子键,离子化合物,Na2O,共价键与共价化合物,共价键,无箭头,极性键,非极性键,共价化合物等内容,欢迎下载使用。
高中化学必修一 专题4.3.1 离子键: 这是一份高中化学必修一 专题4.3.1 离子键,共17页。
高中化学必修一 专题4.3.1 离子键备课堂课件)): 这是一份高中化学必修一 专题4.3.1 离子键备课堂课件)),共17页。













