





高中人教版 (2019)第一节 反应热精品ppt课件
展开【思考与交流】请结合以下数据计算2H2(g)+O2(g)=2H2O(g)的反应热 ,写出该反应的热化学方程式?
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6KJ/ml
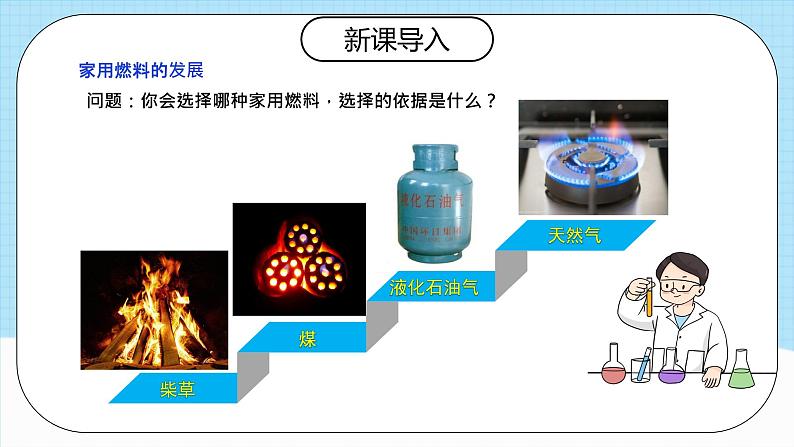
问题:你会选择哪种家用燃料,选择的依据是什么?
以下场景的热能都是由什么物质提供的呢?我们知道物质燃烧都会放出热量,那么是不是物质燃烧放出的热量就叫燃烧热呢?
模块一 理解燃烧热的概念
1.概念: 101kPa时,1ml纯物质完全燃烧生成指定产物时所放出的热量。
①研究条件: ②反应物及其物质的量:③反应程度:④生成物:⑤燃烧热与物质的多少无关,只与物质的种类有关⑥符号: 单位:
指定产物,没有特别说明,一般是在氧气中进行,且产物为稳定氧化物
如:C→CO2,H→H2O(l),S→SO2等。
纯物质 1ml(以燃烧1ml纯物质为标准来配平)
答:① 燃烧放出的热量与物质的多少有关,燃烧的物质越多,放出的热量就越多,而燃烧热规定是1 ml的纯物质; ② 研究燃烧放出的热量并未限定燃烧产物的形态,而研究燃烧热必须是生成稳定的氧化物。
【思考1】燃烧放出的热量与燃烧热有什么不同?
【思考2】可燃物的物质的量发生变化,其燃烧热变吗?
答:不变。燃烧热指1 ml可燃物燃烧放出的热量,与可燃物的物质的量无关。
2、燃烧热表示的意义:
【想一想】1、已知CH4的燃烧热为890.31KJ/ml,表示的含义是什么?
在101KPa时, 1mlCH4完全燃烧生成CO2(g)和H2O(l)时,放出890.31KJ的热量。
【写一写】2、表示甲烷燃烧热的热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.31kJ/ml
文字描述燃烧热时用“正值” (如甲烷的燃烧热为890.31KJ/ml)而用符号△H表示燃烧热时用“负值”(如甲烷的燃烧热△H=-890.31KJ/ml)
例:语言表述——CH4的燃烧热为890.3 kJ/ml 符号表示——△H= -890.3 kJ/ml例:语言表述——H2的燃烧热为285.8 kJ/ml 符号表示——△H= -285.8 kJ/ml
【注意事项】中文叙述燃烧热、中和热时可以不带“负号”, 但凡用ΔH表示时一定要有“负号”
测定原理:将待测物质放在一个充满氧气的密封金属容器(称为氧弹)内,再将此容器置于盛有一定量水的量热计内筒中,通过点火装置使氧弹中物质燃烧,反应放出的热量会使氧弹外面的水温升高。用温度计测量水温的变化,即可计算出此反应放出的热量。
【例1】分析以下几个热化学方程式,哪个是表示碳的燃烧热( ) A.C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ/ml B.C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/ml C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/ml D.H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/ml
【变式1】下列说法正确的是( )A.1mlH2完全燃烧生成H2O(g)放出的热量叫H2的燃烧热B.25℃、101kPa时,1mlS和2mlS的燃烧热相等C.已知S(s)+ O2(g)=SO3(g) ∆H =-269.8kJ/ml,则硫生成SO3的反应热为269.8kJ/mlD.25℃、101kPa时,碳的燃烧热为-393.5kJ/ml
(1)1 ml 甲烷在氧气中完全燃烧释放的能量为890 kJ(2)28 g CO在氧气中燃烧生成CO2(g)释放的能量为283 kJ
CH4(g)+ 2O2(g) = CO2(g) + 2H2O(l) △H = – 890 kJ/ml
【变式2】书写表示下列燃料燃烧热的热化学方程式
模块二 燃烧热的相关计算
【例2】 在101 kPa时,1 ml CH4 完全燃烧生成CO2和液态H2O,放出890.3 kJ的热量,CH4的燃烧热为多少?1000 L CH4(标况)燃烧后所产生的热量为多少?
解析:CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH =-890.3 kJ/ml 即CH4的燃烧热为890.3 kJ/ml。 1000 L CH4(标况)的物质的量为:n(CH4)=44.6 ml, 44.6 ml CH4 完全燃烧放出的热量为:44.6 ml×890.3 kJ/ml=3.97×104 kJ
Q放=
[归纳]一定量可燃物完全燃烧时放出的热量
n(可燃物)×|ΔH|
已知:H+(aq) + OH-(aq) = H2O(l) ΔH =﹣57.3 kJ·ml-1试比较下列反应中放出的热量与 57.3 kJ 的大小:(1)浓酸与浓碱反应生成 1 ml 水,Q1 _____57.3 kJ, ΔH1 _____ ΔH;(2)弱酸与弱碱反应生成 1 ml 水,Q2 _____57.3 kJ, ΔH2 _____ ΔH;(3)强酸与强碱反应生成 1 ml 水和难溶性盐,Q3 _____57.3 kJ, ΔH3 _____ ΔH。
【思考3】中和热与57.3 kJ·ml-1的关系
【变式1】已知充分燃烧a g乙烯气体时生成1 ml二氧化碳气体和液态水,并放出热量b kJ,则乙烯燃烧的热化学方程式正确的是( )A.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH=-2b kJ/mlB.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH=+2b kJ/mlC.2C2H4(g)+6O2(g)=4CO2(g)+4H2O(l) ΔH=-2b kJ/mlD.2C2H4(g)+6O2(g)=4CO2(g)+4H2O(l) ΔH=+b kJ/ml
【变式2】已知下列两个热化学方程式:
2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ•ml-1 C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2 220 kJ•ml-1(1)H2的燃烧热为______________,C3H8的燃烧热为_____________(2)2 g H2和2 ml C3H8组成的混合气体完全燃烧放出的热量为____________ (3)现有H2和C3H8的混合气体5 ml,完全燃烧时放出热量3847 kJ,则混合气体中H2和C3H8的体积比为____________
285.8 kJ•ml-1
2 220 kJ•ml-1
模块三 家用燃料和火箭推进剂燃料的选择
CO(g) + O2(g) CO2 (g) ∆H=−283 kJ/ml
【提示】可从物质的燃烧热、燃料的储量、开采、运输、价格、对生态环境的影响等方面综合考虑。
①燃烧产物大气污染,一般不作燃料
②不易制备、运输,但无污染且燃烧热较大,是未来新能源
③西气东输工程,家庭常用燃料
④可再生能源,液体易运输,且燃烧热较大,逐渐被应用于乙醇汽油中
【研究与实践】P11
[研究目的]火箭推进剂在航天和军事等领域具有广泛的应用。通过查阅资料,了解火箭推进剂的发展历史、现状及趋势,感受火箭推进剂的发展对人类社会进步的促进作用,体会化学反应中能量变化的重要价值。
[研究任务](1)了解火箭推进剂的发展历史。 (2)了解我国目前常用的火箭推进剂的类型、成分和特点。 (3)了解火箭推进剂的发展趋势。
[结果与讨论](1)通过研究,你得到什么启示?(2)撰写研究报告,并与同学讨论。
肼类燃料(肼、偏二甲肼)
第一枚液体火箭发动机的推进剂
中国第一颗人造卫星“东方红一号”采用偏二甲肼推进剂
“长征七号”运载火箭采用液氧煤油推进剂
“长征五号”运载火箭采用液氢液氧推进剂
长征火箭的第三级使用的推进剂是:
火箭发射的一级燃料是:
N2H4(肼)和NO2
火箭推进剂的发展主要着眼于能量高、排烟少、污染轻三个方面。
H2(l) + 1/2O2(l) = H2O(g) ∆H=−237.5 kJ/ml
CO(g) + 1/2O2(g)=CO2 (g) ∆H=−283 kJ/ml
火箭荷载的绝大部分质量来自于推进剂,产生同样推力所需要的推进剂质量越小,火箭的荷载就越低。计算每克液氢-液氧推进剂恰好完全反应释放的热量。
【思考与交流】长征五号火箭推进剂为什么选择液氢而不用CO呢?
1、定义:能源就是能提供能量的自然资源,它包括化石燃料(煤、石油、天然气)、 阳光、风力、流水、潮汐以及柴草等。
3、节约能源的重要措施:科学地控制燃烧反应,使燃料充分燃烧,提高能源的利用率。
2、能源的开发和利用可以用来衡量一个国家或地区的经济发展和科学技术水平。煤、石油、天然气是当今世界上重要的化石燃料。 但它们的蕴藏有限,且不可再生。解决的办法 :开源节流。即开发新能源,节约现有能源,提高能源的利用率。
4、一级能源:来自自然界未经转化的能源。 二级能源:一级能源经过转化得到的能源形式。
太阳能、海洋能、地热能、波浪能、潮汐能等。
电能、氢能、煤气、水煤气、蒸汽、焦炭、汽油、煤油、柴油、液化石油气、沼气能等
【知识拓展】 氢 能
氢能被视为21世纪最具发展潜力的清洁能源,随着化石燃料耗量的日益增加,其储量日益减少,终有一天这些资源将要枯竭,这就迫切需要寻找一种不依赖化石燃料的、储量丰富的新的含能体能源。氢能正是一种在常规能源危机的出现、在开发新的二次能源的同时人们期待的新的二次能源。
主要优点有:燃烧热值高,燃烧同等质量的氢产生的热量,约为汽油的3倍,酒精的3.9倍,焦炭的4.5倍。燃烧的产物是水,是世界上最干净的能源。资源丰富,氢气可以由水制取,而水是地球上最为丰富的资源,演绎了自然物质循环利用、持续发展的经典过程。
缺点:(1)制取成本高,需要大量的电力;(2)生产、存储难:氢气密度小,很难液化,高压存储不安全
【例3】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 ml液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。(1)写出该反应的热化学方程式:______________________________________________________。
N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)
ΔH=-640 kJ·ml-1
(2)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______________________。
【变式1】(1)已知肼(N2H4)是一种高能燃料,将16 g气态肼在氧气中燃烧,生成氮气和水蒸气,放出267 kJ热量,试写出该反应的热化学方程式:___________________________________________________。(2)试用化学反应能量图表示该反应过程中能量的变化。
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·ml-1
2、预习下一节内容反应热的计算,并完成导学案
1、完成本节内容燃烧热的配套练习
沪科技版(2020)选择性必修1燃烧热图文课件ppt: 这是一份沪科技版(2020)选择性必修1燃烧热图文课件ppt,共1页。
人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热优秀课件ppt: 这是一份人教版 (2019)选择性必修1第一章 化学反应的热效应第一节 反应热优秀课件ppt,共27页。PPT课件主要包含了情境导入,模块一中和热,模块二燃烧热,燃烧热,题型二燃烧热,化学与生活等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 物质的分类及转化一等奖课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 物质的分类及转化一等奖课件ppt,共15页。PPT课件主要包含了研究条件,限定可燃物的量,生成物不能再燃烧,燃烧热,△H<0,液氢-液氧,长征五号推进剂,煤油-液氧,火箭推进剂燃料的选择,常见火箭推进剂等内容,欢迎下载使用。













