资料中包含下列文件,点击文件名可预览资料内容






还剩41页未读,
继续阅读
所属成套资源:【新课标】人教版化学选择性必修2PPT课件+教案+分层作业+导学案整册(含单元复习资料)
成套系列资料,整套一键下载
- 【新课标】人教版(2019)高中化学选择性必修二 1.1.1《能层与能级基态与激发态原子光谱》导学案(原卷版) 试卷 1 次下载
- 【新课标】人教版(2019)高中化学选择性必修二 1.1.1《能层与能级基态与激发态原子光谱》导学案(解析卷) 学案 2 次下载
- 【新课标】人教版(2019)高中化学选择性必修二 1.1.2《构造原理与电子排布式 电子云与原子轨道》教案 教案 1 次下载
- 【新课标】人教版(2019)高中化学选择性必修二 1.1.2《构造原理与电子排布式 电子云与原子轨道》分层作业(原卷版) 试卷 1 次下载
- 【新课标】人教版(2019)高中化学选择性必修二 1.1.2《构造原理与电子排布式 电子云与原子轨道》分层作业(解析卷) 试卷 2 次下载
高中化学人教版 (2019)选择性必修2第一节 原子结构公开课ppt课件
展开这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构公开课ppt课件,文件包含人教版2019高中化学必修二112《构造原理与电子排布式电子云与原子轨道》课件pptx、夫琅禾费线的发现mp4、核外电子排布规律和原子结构示意图mp4、玻尔的原子结构提出mp4等4份课件配套教学资源,其中PPT共49页, 欢迎下载使用。
1. 能根据构造原理写出1-36号元素的核外电子排布式 。 2.了解核外电子运动、电子云轮廓图和核外电子排布式 。
通过刚才的视频,我们回顾了以前学过的电子的运动状态和前三周期的原子结构示意图的书写,那么第四周期元素的原子结构示意图该如何书写,原子核外的电子排布还有哪些其他的表达方式,今天我们就来研究这方面的问题。
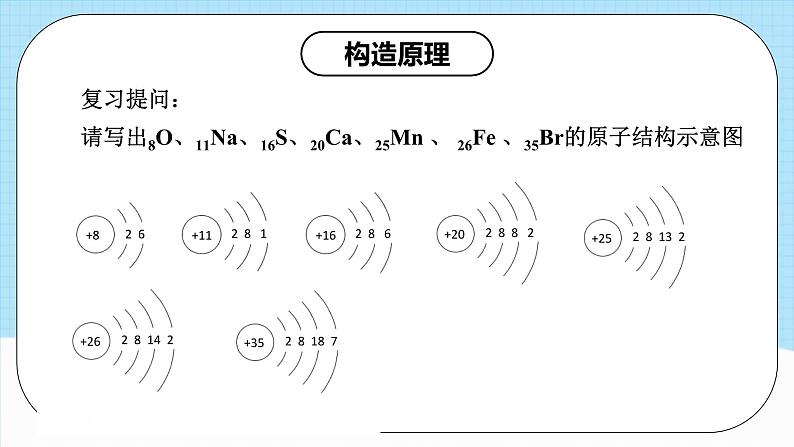
请写出8O、11Na、16S、20Ca、25Mn 、 26Fe 、35Br的原子结构示意图
学生活动:阅读教材P8第二自然段,了解构造原理,回下列问题:
1、构造原理的内容?
2、构造原理示意图中:
图中小圆圈表示一个 ,每一行对应一个 ,箭头引导的曲线显示 。
3、根据构造原理示意图,找出电子排布的顺序?
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
图中小圆圈表示一个 ,每一行对应一个 ,箭头引导的曲线显示 。
递增电子填入能级的顺序
3、根据构造原理示意图,找出电子填充的顺序?
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d→7p
任务二:探究电子的填充顺序
学生活动:仔细观察构造原理示意图,回答以下问题:
1、从能层的角度看,电子的填充顺序规律是怎样的?
2、从能级的角度看,电子的填充顺序规律是怎样的?
3、电子填充的顺序,有没有特殊情况出现?
电子先填满一个能层,再继续填下一个能层;填充时,从第一能层开始,依次填入
电子先填满一个能级,再继续填下一个能级;填充时,从s能层开始,依次填入p、d、f能级。
电子并不总是填满一个能层后再开始填入下一个能层,例如从第三层开始,填充完3p之后,先填充的是第四层的s能级
任务三:探究能级交错的现象
学生活动:阅读教材P10第二、三自然段,回答以下问题:
2、构造原理呈现的能级交错源于 事实,是 的,而不是任何理论推导的结果。构造原理是一个 ,是个假想过程。
3、Cr和Cu最后两个能级的电子排布是什么?
2、构造原理呈现的能级交错源于 事实,是 的,而不是任何理论推导的结果。构造原理是一个 ,是个假想过程。
构造原理告诉我们,随核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的。这种现象被称为能级交错。
Cu :3d104s1
1s→2s→2p→3s→3p→4s→3d→4p→5s
重点记忆构造原理示意图中:
电子排布式是用核外电子分布的能级及各能级上的电子数来表示电子排布的式子。
举例:1s2 、3s1、 2p3 、 4p5、 3d10、 4f12
表示第一能层,s能级上,填充2个电子
表示第三能层,s能级上,填充1个电子
表示第二能层,p能级上,填充3个电子
表示第四能层,p能级上,填充5个电子
表示第三能层,d能级上,填充10个电子
表示第四能层,f能级上,填充12个电子
“三步法”(构造原理是书写基态原子电子排布式的主要依据)
第一步:按照构造原理写出电子填入能级的顺序,1s→2s→2p→3s→3p→4s→3d→4p→5s
第二步:根据各能级容纳的电子数填充电子。
请同学们回忆一下,上节课所学的,各个能级最多容纳的电子数都是多少?
s-2,p-6,d-10,f-14,另一个-18
第三步:去掉空能级,并按照能层顺序排列即可得到电子排布式。
举例:写出下列元素基态原子的电子排布式
1s22s22p63s1
1s22s22p63s23p63d54s2
(1)在书写电子排布式时,一般情况下,能层低的能级要写在左边,而不是按构造原理的顺序写。
1s22s22p63s23p1
1s22s22p63s23p2
1s22s22p63s23p5
1s22s22p63s23p63d64s2
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p5
1s22s22p63s23p63d104s1
1s22s22p63s23p63d54s1
(2)在得出构造原理之前,由原子光谱得知,有些过渡金属元素基态原子电子排布不符合构造原理,如Cr和Cu的最后两个能级的电子排布分别为3d54s1和3d104s1。由此可见,构造原理是被理想化了的。
考试要求:根据构造原理写出1-36号元素的基态原子的电子排布式
【思考与讨论】按照构造原理写出稀有气体氦、氖、氩、氪、氙、氡、的基态原子的最外层电子排布;除氦外它们的通式是什么?
任务四:利用电子排布式书写钛、锰、铁、锌、铬、铜、锗、砷、氪的原子结构示意图
【思考与讨论】电子排布式可以简化,如钠的电子排布式可以简化为[Ne]3s1。试问:上式方括号里的符号的意义是什么? 请仿照钠原子的简化的电子排布式,写出第8号元素氧、第14号元素硅和第29号元素铜的简化电子排布式?
【任务五】探究简化的电子排布式
【学生活动】阅读教材P11思考与讨论第二题,回答其中的问题
【思考与讨论】电子排布式可以简化,如钠的电子排布式可以简化为[Ne]3s1。试问:上式方括号里的符号的意义是什么?
内层电子已达到稀有气体结构的部分
将原子中已经达到稀有气体元素原子结构的部分,用相应的稀有气体元素符号外加方括号表示的式子称为简化电子排布式。
简化电子排布式的定义:
请仿照钠原子的简化的电子排布式,写出第8号元素氧、第14号元素硅和第29号元素铜的简化电子排布式?
[He]2s22p4
[Ne]3s23p2
[Ar]3d104s1
【任务六】探究价层电子排布式的相关内容
【学生活动】阅读教材P11思考与讨论第三题,小组讨论,回答下 列问题
2、请从书末的元素周期表中找出Na、Al、Cl、Mn、Br的价层电子排布。
3、查看书末元素周期表中前四周期元素的价层电子排布,总结不同族中,价层电子的排布规律,并写出通式。
为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)
11Na: 13Al: 17Cl: 25Mn: 35Br:
①对于主族元素和零族元素来说,价电子就是最外层电子
IA、IIA: nsx
IIIA-0族:nsxnpy
②对于副族和第VIII族元素来说,价电子除最外层电子外,还包括次外层电子
练习:写出下列原子的价层电子排布式
1、构造原理的电子排布顺序
2、前四周期元素,电子排布式,简化电子排 布式、价层电子排布式的书写
【典例1】构造原理揭示的电子排布能级顺序,实质是各能级能量高 低。若以E(nl)表示某能级的能量,以下各式中正确的是 ( ) A.E(5s)>E(4f)>E(4s)>E(3d) B.E(3d)>E(4s)>E(3p)>E(3s) C.E(4s)
【解析】根据构造原理,A项和D项正确顺序为E(4f)>E(5s)>E(3d)>E(4s);对于不同能层的相同能级,能层序数越大,能量越高,C项错,其正确顺序为E(4s)>E(3s)>E(2s)>E(1s);E(3d)>E(4s)>E(3p)>E(3s)符合构造原理,B项正确。答案:B
【典例2】下列说法正确的是( ) A.钾(K)原子的原子结构示意图为 B.H2O的电子式为
C.Mg的电子排布式为1s22s22p63s23p1 D.Ca2+的电子排布式为1s22s22p63s23p64s2
【解析】19号元素钾(K)原子的原子结构示意图为 , A项错误;H2O为共价化合物,B项正确;12号元素Mg的电子排布式为1s22s22p63s2,C项错误;Ca2+的电子排布式为1s22s22p63s23p6,D项错误。答案选B。
【典例3】以下电子排布式是基态原子的电子排布式的是( ) ①1s12s1 ②1s22s12p1 ③1s22s22p63s2 ④1s22s22p63s23p1 A.①② B.①③ C.②③ D.③④
【解析】基态原子排布式的特点是,按照构造原理,依次排布。 ①应先排满1s能级再排2s能级,显然不符合基态原子的排布要求;②应先排满2s能级再排2p能级,也不符合基态原子的排布要求。答案选D。
【典例4】在下列所示的粒子中,氧化性最强的是( ) A. 1s22s22p2 B. 1s22s22p5 C. 1s22s22p63s1 D .1s22s22p6
【解析】4种粒子分别为C、F、Na、Ne,氧化性最强的是氟原子。答案选B。
【解析】某元素正二价离子的最外层电子排布为3d9,则其原子的核外电子排布式为1s22s22p63s23p63d104s1,核外共有29个电子,原子序数为29。答案选A。
【典例5】某元素正二价离子的最外层电子排布为3d9,则该元素的 原子序数为( ) A.29 B.30 C.31 D.32
【典例6】回答下列问题。 (1)①C基态原子核外电子排布式为 ; ②Zn2+基态核外电子排布式为 ; ③Cr3+基态核外电子排布式为 ; ④N的基态原子核外电子排布式为 ; Cu的基态原子最外层有 个电子。 ⑤Si元素基态原子的电子排布式为 ;
(2)比较下列多电子原子的原子轨道的能量高低(填“>”或“<”或“=”)。①2s 3s ②2s 3d ③3d 4s ④4f 6f
【解析】按照构造原理依次书写
(1)①[Ar]3d74s2或1s22s22p63s23p63d74s2 ②1s22s22p63s23p63d10或[Ar]3d10 ③1s22s22p63s23p63d3或[Ar]3d3 ④1s22s22p3 1 ⑤1s22s22p63s23p2或[Ne] 3s23p2(2)①< ②< ③> ④<
前四周期元素电子排布式的书写
前四周期元素价层电子排布式的书写
前四周期元素简化电子排布式的书写
前四周期元素原子结构示意图的书写
相关课件
人教版 (2019)选择性必修2第一节 原子结构优质课课件ppt:
这是一份人教版 (2019)选择性必修2第一节 原子结构优质课课件ppt,共24页。PPT课件主要包含了构造原理,电子排布式,电子数,适用范围,s22s22p6,s22s22p3,s22s22p4,4s1,4s2,3d1等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第一节 原子结构教案配套ppt课件:
这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构教案配套ppt课件,共25页。PPT课件主要包含了构造原理,电子排布式,能级交错现象,ns2np6,s22s22p1,s22p3,s23p63d10,s22s22p6等内容,欢迎下载使用。
人教版 (2019)选择性必修2第一节 原子结构多媒体教学课件ppt:
这是一份人教版 (2019)选择性必修2第一节 原子结构多媒体教学课件ppt,共13页。PPT课件主要包含了PART01,PART02,·电子云与原子轨道·等内容,欢迎下载使用。









