
还剩13页未读,
继续阅读
成套系列资料,整套一键下载
【新课标】人教版(2019)高中化学选择性必修二 第二章《分子结构与性质》知识清单
展开
这是一份【新课标】人教版(2019)高中化学选择性必修二 第二章《分子结构与性质》知识清单,共16页。
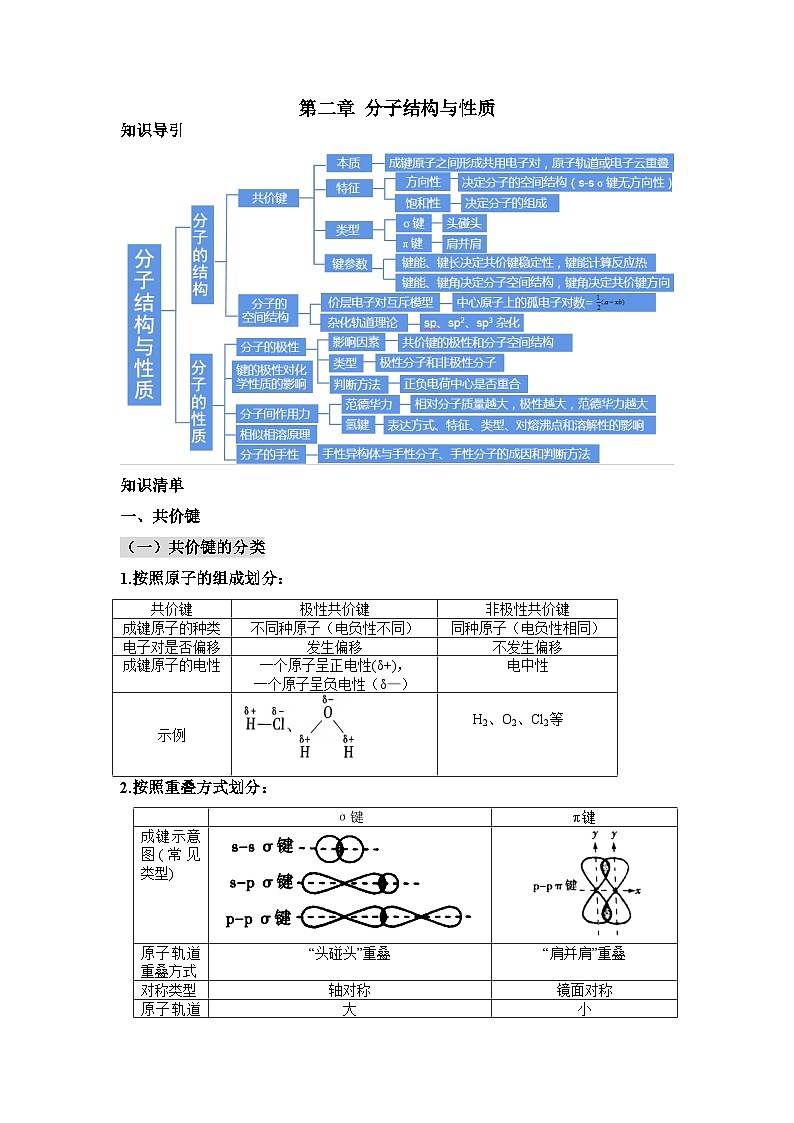
第二章 分子结构与性质知识导引知识清单一、共价键(一)共价键的分类1.按照原子的组成划分:2.按照重叠方式划分:说明:①一般情况下,σ键比π键牢固,但并不是所有分子中的σ键都比π键牢固(例如:N2)②并不是所有的分子都含有σ键(二)共价键的形成条件及特征1.形成条件:通常电负性相同或差值较小的非金属元素原子之间形成共价键,大多数电负性之差小于1.7的金属与非金属原子之间形成共价键。2.特征:(三)键参数——键能、键长与键角1.键能(1)定义:气态分子中1mol化学键解离成气态原子所吸收的能量称为键能。(2)测定方法:键能可通过实验测定,更多的却是推算获得的注:同种类型的共价键,键能大小为:单键<双键<三键2.键长(1)定义:构成化学键的两个原子的核间距叫做该化学键的键长。由于分子中的原子始终处于不断振动之中,键长只是振动着的原子处于平衡位置时的核间距。(2)定性判断键长的方法①根据原子半径进行判断。在其他条件相同时,成键原子的半径越小,键长越短。②根据共用电子对数判断。相同的两原形成共价键时,单键键长>双键键 长>三键键长3.键角(1)定义:在多原子分子中,两个相邻共价键之间的夹角称为键角。(2)测定方法:键长和键角的数值可通过晶体的X射线衍射实验获得(3)常见分子的键角及分子空间结构:4.键参数对分子性质的影响:相同类型的共价化合物分子,成键原子半径越小,键长越短,键能越大,分子越稳定 例题1:下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠形成的是( )A.H2 B.Cl2 C.NaH D.HF【答案】D【解析】氢气分子中的σ键是由两个1s轨道以“头碰头”方式重叠形成的,A项错误;Cl2分子中的σ键是由两个3p轨道以“头碰头”方式重叠形成的,B项错误;NaH中没有共价键,C项错误;HF分子中的σ键是由1s轨道和2p轨道以“头碰头”方式重叠形成的,D项正确。例题2:五种短周期主族元素X、Y、Z、R、W的原子序数依次增大,它们形成的化合物的结构如图所示。基态X原子的核外电子只有一种自旋取向,Y、Z、R为同周期元素。下列说法正确的是( )A.电负性:RN>C>Na,A项错误;N2的结构式为N≡N,含2个π键,π键是由两个原子的p轨道“肩并肩”重叠形成的,B项错误;H2分子中两个H原子的未成对电子均为1s能级的电子,s轨道呈球形,故s轨道之间的重叠不具有方向性,C项正确;基态C原子的核外电子排布式为1s22s22p2,s轨道的电子数与p轨道的电子数不相等,D项错误。例题3:在铜的催化作用下,F2能与过量NH3发生反应:3F2+4NH3 3NH4F+NF3。下列说法正确的是( )A.第一电离能:N>F>HB.NF3中键角大于NH3中键角C.键能:N-H键>O-H键D.NH4F的电子式:【答案】D【解析】第一电离能:F>N>H,A项错误;NF3的键角比NH3小,B项错误;一般,键长越短,键能越大,N-H键键长大于O-H键,故O-H键键能大,C项错误。例题4:下列说法正确的是( )A.同一原子中,1s、2s、3s电子的能量逐渐减小B.同一原子中,2p、3p、4p能级的轨道数依次增多C.C-C键、C=C键、C≡C键的键能之比为1.00 :1.77:2.34,根据以上数据,可知乙烯和乙炔不容易发生反应D.共价键的键能越大,共价键越不容易断裂,由该键形成的分子越稳定【答案】D【解析】同一原子中,1s、2s、3s电子的能量逐渐增大,A错误;同一原子中,2p、3p、4p能级的轨道数相等,都是3个,B错误;C≡C键键能小于C-C键键能的三倍,C=C键键能小于C-C键键能的二倍,说明乙烯和乙炔中的π键不牢固,易发生反应,C错误;共价键的键能越大,共价键越牢固,由该键形成的分子越稳定,D正确。二、分子的空间结构(一)分子结构的测定1、常用的测定方法:红外光谱、晶体X射线衍射(1)红外光谱①测定原理:分子中的原子不是固定不动的,而是不断地振动着的。当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。②应用:分析出分子中含有何种化学键或官能团的信息。(2)质谱法①测定原理:在质谱仪中使分子失去电子变成带正电荷的分子离子和碎片离子等粒子。由于生成的离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场得以分离,在记录仪上呈现一系列峰,化学家对这些峰进行系统分析,便可得知样品分子的相对分子质量。应用:质谱图中,横坐标最右侧,数值最大的质荷比,就是该分子的相 对分子质量(二)多样的分子空间结构1、三原子分子的空间结构——直线型和V形(又称角形)2、四原子分子常见的空间结构——平面三角形和三角锥形四原子分子的空间结构大多数为平面三角形和三角锥形,也有的为直线形(如C2H2)、正四面体形(如P4)等。3、五原子分子常见的空间结构——四面体形(三)价层电子对互斥模型1、中心原子上的价层电子对数的计算(1)中心原子上的价层电子对数=σ键电子对数+中心原子上的孤电子对数①σ键电子对数的确定:由化学式确定②中心原子上的孤电子对数的确定:中心原子上的孤电子对数=公式中各字母的含义:2、常见分子或离子的空间结构的推测注:1、价层电子对互斥模型对分子空间结构的预测少有失误,但它不能用于预测以过渡金属为中心原子的分子。2、氨气与水的VSEPR模型一致,但空间构型不同的原因是:孤电子对之间斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力(四)杂化轨道理论简介1、杂化轨道类型2、杂化轨道理论的要点(1)原子形成分子时,通常存在激发、杂化和轨道重叠等过程。发生轨道杂化的原子一定是中心原子。(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子不可能发生杂化。(3)只有能量相近的原子轨道才能杂化(如2s、2p)。(4)杂化前后原子轨道数目不变(参加杂化的轨道数目等于形成的杂化轨道数目),且杂化轨道的能量相同。(5)杂化使原子的成键能力增加,形成的共价键更牢固。 (6)杂化轨道成键时仍具有共价键的特征——方向性和饱和性。 (7)杂化轨道数=中心原子上的孤电子对数+与中心原子结合的原子数 3、杂化轨道类型的判断方法(1)利用价层电子对数进行判断(2)根据杂化轨道间的夹角判断(3)根据分子或离子的空间结构判断 (4)根据共价键类型判断对于能明确结构式的分子、离子,其中心原子的杂化轨道数n=中心原子形成的σ键数+中心原子上的孤电子对数,即可将结构式和电子式相结合,从而判断中心原子形成的σ键数和中心原子上的孤电子对数,进而判断杂化轨道数。(5)以碳原子为中心原子的分子中碳原子的杂化类型 ①没有形成π键,为sp3杂化:CH4、CCl4、②形成一个π键,为sp2杂化:CH2=CH2、苯(大π键)、、③形成两个π键,为sp杂化:CH≡CH、O=C=O(CO2)、S=C=S(CS2)例题1:已知原子数和价电子数相同的离子或分子空间结构相似,如SO3、NO3−都是平面三角形结构。那么下列分子或离子中与SO42−有相似空间结构的是( ) A.PCl5 B.CCl4 C.NF3 DN3−.【答案】B【解析】原子数和价电子数相同的离子或分子的空间结构相似。SO42−有5个原子、32个价电子,选项中只有CCl4含5个原子、32个价电子。例题2:下表中各粒子、粒子对应的空间结构及解释均正确的是 ( )【答案】D【解析】NH2−中N原子采用sp3杂化,且孤电子对数为2,离子的空间结构为V形,A项错误;SO2中S原子的价层电子对数=σ键数+孤电子对数=2+1/2×(6-2×2)=3杂化轨道数为3,采取sp2杂化,孤电子对数为1,分子的空间结构为V形,B项错误;CO32−中C原子的价层电子对数=3+1/2×(4+2-3×2)=3,不含孤电子对,杂化轨道数为3,采取sp2杂化,离子空间结构为平面三角形,C项错误;C2H2中C原子采用sp杂化,且C原子的价电子均参与成键,所以分子的空间结构为直线形,D项正确。例题3:下列关于苯乙炔的说法错误的是( )A.1个该分子中有8个σ键,5个π键B.该分子中碳原子有sp和sp2杂化两种形式C.该分子中存在非极性键D.该分子中有8个碳原子在同一平面上【答案】A【解析】1个苯乙炔分子中含14个σ键,苯环中的碳原子都是sp2杂化,苯环中的六个碳原子的未参与杂化的2p轨道形成1个大π键,故1个苯乙炔分子中含3个π键,故A错误;分子中苯环中碳原子都是sp2杂化,碳碳三键中碳原子是sp杂化,该分子中碳原子有sp和sp2杂化两种形式,故B正确;同种元素原子间形成的共价键为非极性键,碳碳键为非极性键,故C正确;苯分子是平面形结构,碳碳三键是直线形结构,因此该分子中有8个碳原子在同一平面上,故D正确。例题4:短周期元素a、b、c、d的原子序数依次增大,在下列转化关系中,甲、乙、丙、丁、戊为上述元素组成的二元或三元化合物。其中A为d元素组成的单质,常温下乙为液体,丁物质常用于消毒、漂白。下列说法错误的是( )A.简单离子半径:c>bB.丙中既有离子键又有极性键C.b、c形成的化合物中阴、阳离子数目比为1:2 D.b、c、d形成的化合物中,d的杂化方式是sp3【答案】A【解析】短周期元素a、b、c、d的原子序数依次增大,常温下乙为液体,应该为H2O,则a为H元素,A为d元素组成的单质,且与丙反应生成水和常用于消毒、漂白的丁,则丙应为碱,由转化关系可知甲为Na2O,丙为NaOH,A为Cl2,生成的丁、戊分别为NaClO、NaCl,可知b为O元素、c为Na元素,d为Cl元素。b、c对应的简单离子为O2-和Na+,具有相同的核外电子排布,核电荷数越大离子半径越小,则离子半径O2->Na+,即b>c,故A错误;丙为NaOH,由Na+和OH-组成,含有离子键和极性共价键,故B正确;b为O元素,c为Na元素,两者形成的Na2O和Na2O2中阴、阳离子数目比均为1:2,故C正确;b、c、d形成的化合物中,若为NaClO,C1原子的价层电子对数为1+ 7+1−1×22 =4,则C1的杂化方式是sp3,若为NaClO2,Cl原子的价层电子对数为2+7+1−2×22 =4,则Cl的杂化方式是sp3,同理若为NaClO3或NaClO4,Cl原子杂化方式也为sp3,故D正确。三、分子结构与物质的性质(一)共价键的极性和分子的极性 1、影响共价键极性的因素(1)电负性差值越大的两原子形成的共价键的极性越强(2)共用电子对偏移程度越大,键的极性越强2、分子极性的判断方法(1)可依据分子中化学键的极性的向量和进行判断分子的极性必须依据分子中极性键的极性的向量和是否等于0而定。当分子中各个键的极性的向量和等于0时,是非极性分子,否则是极性分子。(2)可根据分子中的正电中心和负电中心是否重合判断(3)利用键的极性和空间构型一起判断分子的极性一般规律:①只含有非极性键的分子一定是非极性分子;②含有极性键的分子,如果分子空间结构不对称,则为极性分子;如果分子空间结构呈对称(如直线形、平面三角形、正四面体形),则为非极性分子。(4)化合价法ABn型分子中,中心原子的化合价的绝对值等于该元素的价层电子数时,该分子为非极性分子,此时分子的空间结构是对称的;若中心原子的化合价的绝对值不等于其价层电子数,则分子的空间结构不是对称的,其分子为极性分子。具体实例如表所示:注:a、一般情况下,单质分子为非极性分子,但O3是V形分子,其空间结构不对称,故O3为极性分子。 b、H2O2的结构式为H—O—O—H,空间结构是,是不对称的,为极性分子。(二)键的极性对物质化学性质的影响1、电负性越大,极性越大,酸性越强2、卤族元素越多,极性越大,酸性越强3、烃基越长,推电子效应越大,羧酸的酸性越小4、键的极性对羧酸酸性大小的影响实质是通过改变羧基中羟基的极性而实现的,羧基中羟基的极性越大,越容易电离出H+,则羧酸的酸性越大(三)分子间的作用力及其对物质性质的影响1、范德华力及其对物质性质的影响(1)存在范围:范德华力存在于由共价键形成的多数共价化合物、绝大多数非金属单质及没有化学键的稀有气体中。但像二氧化硅晶体、金刚石等由共价键形成的物质中不存在范德华力。(2)特征 ①范德华力广泛存在于分子之间,但只有分子间充分接近时才有分子间的相互作用力。②范德华力很弱,比化学键的键能小1~2个数量级。③范德华力没有方向性和饱和性。(3)影响范德华力的因素①一般地,组成和结构相似的分子,相对分子质量越大,范德华力越大。②相对分子质量相同或相近时,分子的极性越大,范德华力越大。③分子组成相同,但结构不同的物质(即互为同分异构体),分子的对称性越强,范德华力越小。(4)范德华力对物质性质的影响范德华力主要影响物质的熔、沸点等物理性质。一般规律:范德华力越大,物质的熔、沸点越高。2、氢键及其对物质性质的影响(1)形成条件:它是由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力。(2)表达方式:X—H…Y—。其中X、Y为N、O、F这样的电负性很大的原子,“—”表示共价键,…”表示形成的氢键。在X—H…Y中,X、Y的电负性越大,氢键越强;Y原子的半径越小,氢键越强。(3)特征:①氢键是一种分子间作用力,但不同于范德华力,也不属于化学键。 ②氢键是一种较弱的作用力,比化学键的键能小1~2个数量级,与范德华力数量级相同,但比范德华力明显的强。 ③氢键具有方向性(X-H…Y尽可能在同一条直线上)和饱和性(一个X-H只能和一个Y原子结合),但本质上与共价键的方向性和饱和性不同。(4)氢键的键长:一般定义为A-H…B的长度,而不是H…B的长度。(5)存在范围:氢键不仅存在于分子间,有时也存在于分子内。(6)对物质性质的影响:①对物质溶沸点的影响:I.存在分子间氢键的物质,具有较高的熔、沸点。II.互为同分异构体的物质,能形成分子内氢键的,其熔、沸点比能形成分子间氢键的物质的低。②对物质溶解度的影响:溶质与溶剂之间若能形成分子间氢键,则溶质的溶解度明显的大。注:化学键主要影响物质的化学性质(四)溶解性1、“相似相溶”规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。 说明:(1)“相似”指的是分子的极性相似 (2)这是一条经验规律,也会有不符合规律的例子,如CO、NO等极性分子均难溶于水,不少盐类(如AgCl、PbSO4、BaCO3等)也难溶于水,H2、N2难溶于水也难溶于苯等。2、影响溶解度的因素(1)内因①如果溶剂和溶质之间存在氢键,则溶质在溶剂中的溶解度较大。②物质自身的结构。③溶质与溶剂发生反应可增大其溶解度。(2)外因①温度:一般地,温度升高,固体物质的溶解度增大,气体物质的溶解度减小。②压强:一般地,压强越大,气体的溶解度越大。注:I、影响固体溶解度的主要因素是温度。常见物质中,Ca(OH)2的溶解度随温度的升高而减小。受热易分解的物质的溶解情况需考虑温度因素。II、影响气体溶解度的主要因素是温度和压强。(五)分子的手性1、手性分子的成因当4个不同的原子或基团连接在同一个碳原子上时,这个碳原子是不对称原子。这种分子和它“在镜中的像”不能重叠,因而表现为“手性”。手性分子中的不对称碳原子称为手性碳原子。2、手性分子的判断有机物分子具有手性是由于其分子中含有手性碳原子。如果1个碳原子所连接的4个原子或基团各不相同,那么该碳原子为手性碳原子,用*C来表示。如,R1、R2、R3、R4是互不相同的原子或基团。所以,判断一种有机物是否为手性分子,就看其含有的碳原子是否连有4个不同的原子或基团。例题1:第VA族元素的R原子与A原子结合形成RA3气态分子,其空间结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5的说法中正确的是( )A.每个原子都达到8电子稳定结构B.分子中5个R-C1键的键能完全相等C.键角(C1-R-C1)有90°、120°、180°三种D. RCl5受热后会分解生成RCl3分子,RCl5和RCl3都是极性分子【答案】C【解析】RCl5分子中R原子形成5个σ键,则R的最外层电子数为10,A项错误。键长越短,键能越大,由题图可知,5个R-C1键的键长不完全相同,则其键能也不完全相等,B项错误。上下两个顶点的C1原子与中心R原子形成的键角为180°,中间3个C1原子形成平面三角形, R原子位于三角形的中心,C1原子与R原子形成的键角为120°,顶点C1原子与R原子及平面三角形中的任一C1原子形成的键角为90°,故键角(C1-R-C1)有90°、120°、180°三种,C项正确。RCl5分子结构对称,正负电荷中心重合,属于非极性分子,D项错误。例题2: 下列物质中,酸性最强的是( )A.CH3ClCOOH B.CH2FCOOH C.CHF2COOH D.CHBr2COOH【答案】C【解析】电负性F>Cl>Br,则酸性最强的是CHF2COOH,答案为C。例题3:有4个系列分别同族的物质,101.3kPa时测定它们的沸点(单位:℃)如下表所示。对应表中内容,下列叙述中正确的是( )A.系列①的a物质中没有离子键,只有共价键和范德华力B.系列③中c物质的沸点比HCl的高是因为c中的共价键更牢固C.系列②中b物质的元素的原子序数应为35,且该物质常温下为液态D.系列④中H2O沸点变化出现反常,是因为分子内有氢键的影响 【答案】C【解析】系列①是稀有气体,a是Ne,它没有化学键,A项错误;系列③是卤化氢,c是HF,它比HCl沸点高的原因是存在分子间氢键,B项错误;系列②是卤素单质,b是Br2,Br处于C1的下一周期,其原子序数为17+18=35,常温下Br2是红棕色液体,C项正确;系列④为VIA族元素形成的简单氢化物,H2O沸点反常是由于存在分子间氢键, D项错误。例题4:关于CS2、SO2、NH3三种物质的说法中正确的是( )A.CS2在水中的溶解度很小,是由于其属于极性分子B.SO2和NH3均易溶于水,原因之一是它们都是极性分子C.CS2为非极性分子,所以在三种物质中熔、沸点最低D.NH3在水中溶解度很大,只是由于NH3分子有极性 【答案】B【解析】A错,CS2是直线形的非极性分子,H2O是极性分子,根据“相似相溶”规律推知,CS2难溶于水。B对,SO2和NH3均易溶于水,其原因有两个:①二者都是极性分子,与水分子的极性相同;②二者都与水发生化学反应。C错,在题述三种物质中,常温下CS2呈液态,SO2、NH3都是气体。D错,NH3在水中溶解度很大,一方面是NH3分子有极性,另一方面是NH3与水发生化学反应生成NH3·H2O。例题5:有一种有机物的键线式酷似牛,故称为牛式二烯炔醇。下列有关说法不正确的是( )A.牛式二烯炔醇的官能团可以用红外光谱测定B.牛式二烯炔醇含有三个手性碳原子C.1mol牛式二烯炔醇含有6molπ键D.牛式二烯炔醇分子中C原子只存在sp和sp2杂化 【答案】D【解析】红外光谱可以测定官能团,A项正确;牛式二烯炔醇含有3个手性碳原子,B项正确;1mol牛式二烯炔醇含有6molπ键,C项正确;牛式二烯炔醇分子中碳原子存在sp、sp2和sp3杂化,D项错误。
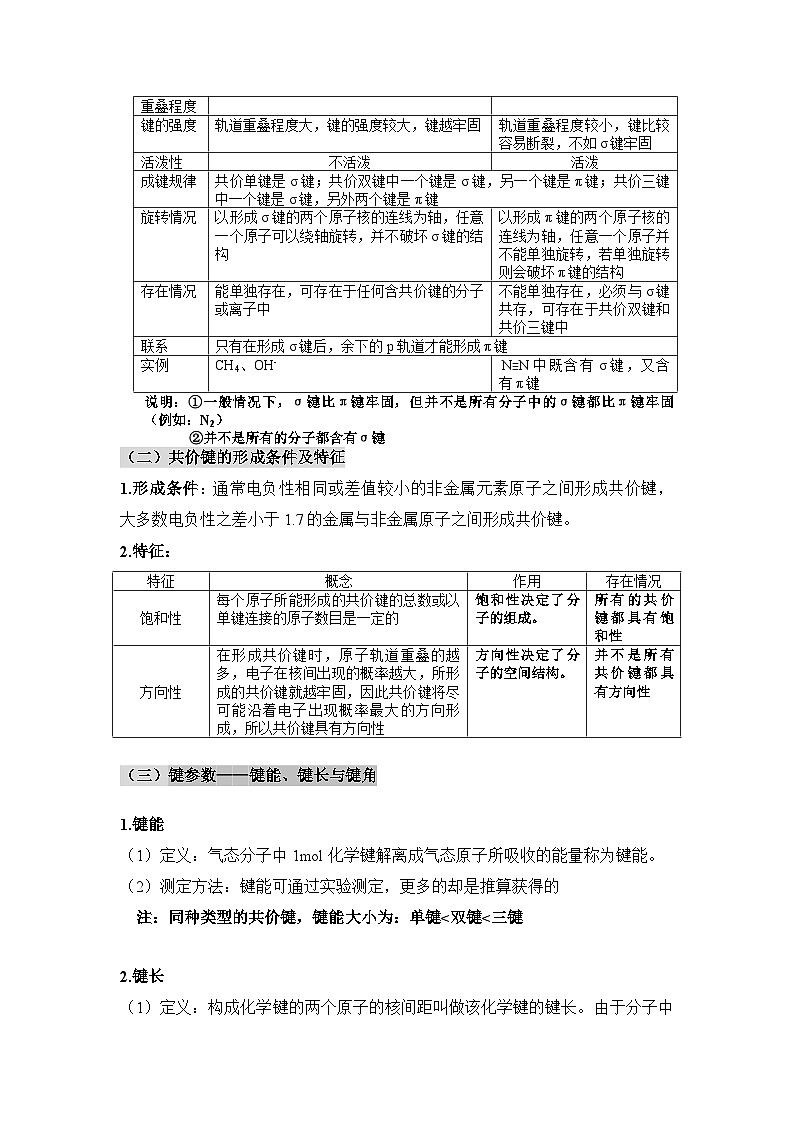
共价键极性共价键非极性共价键成键原子的种类不同种原子(电负性不同)同种原子(电负性相同)电子对是否偏移发生偏移不发生偏移成键原子的电性一个原子呈正电性(δ+),一个原子呈负电性(δ—)电中性示例H2、O2、Cl2等σ键π键成键示意图(常见类型)原子轨道重叠方式“头碰头”重叠“肩并肩”重叠对称类型轴对称镜面对称原子轨道重叠程度大小键的强度轨道重叠程度大,键的强度较大,键越牢固轨道重叠程度较小,键比较容易断裂,不如σ键牢固活泼性不活泼活泼成键规律共价单键是σ键;共价双键中一个键是σ键,另一个键是π键;共价三键中一个键是σ键,另外两个键是π键旋转情况以形成σ键的两个原子核的连线为轴,任意一个原子可以绕轴旋转,并不破坏σ键的结构以形成π键的两个原子核的连线为轴,任意一个原子并不能单独旋转,若单独旋转则会破坏π键的结构存在情况能单独存在,可存在于任何含共价键的分子或离子中不能单独存在,必须与σ键共存,可存在于共价双键和共价三键中联系只有在形成σ键后,余下的p轨道才能形成π键实例 CH4、OH- N≡N中既含有σ键,又含有π键特征概念作用存在情况饱和性每个原子所能形成的共价键的总数或以单键连接的原子数目是一定的饱和性决定了分子的组成。所有的共价键都具有饱和性方向性在形成共价键时,原子轨道重叠的越多,电子在核间出现的概率越大,所形成的共价键就越牢固,因此共价键将尽可能沿着电子出现概率最大的方向形成,所以共价键具有方向性方向性决定了分子的空间结构。并不是所有共价键都具有方向性分子键角空间结构CO2(O=C=O)180°直线形H2O(H-O)105°V形(或称角形)NH3(N-H)107°三角锥形CH4(C-H)109º28´正四面体形P4(P-P)60º正四面体形化学式电子式结构式键角空间结构模型空间结构名称CO2O=C=O180º直线型H2O105ºV形化学式电子式结构式键角空间结构模型空间结构名称CH2O约120º平面三角形NH3107º三角锥形化学式电子式结构式键角空间结构模型空间结构名称CH4109º28´正四面体形a中心原子的价层电子数主族元素=最外层电子数阳离子=中心原子的价层电子数-离子的电荷数阴离子=中心原子的价层电子数+︱离子的电荷数︱x与中心原子结合的原子数b与中心原子结合的原子最多能接受的电子数H=1其他原子=8-该原子的价层电子数分子或离子中心原子上的孤电子对数中心原子上的价层电子对数VSEPR模型VSEPR模型名称空间结构空间结构名称CO2、BeCl202直线形直线形CO32—、BF303平面三角形平面三角形SO2、PbCl21V形CH4、CCl404正四面体形正四面体形NH3、NF31四面体形三角锥形H2O、H2S2V形类型形成过程夹角空间结构sp3杂化轨道sp3杂化轨道是由1个s轨道和3个p轨道杂化形成的109°28′正四面体形sp2杂化轨道sp2杂化轨道是由1个s轨道和2个p轨道杂化而成的120°平面三角形sp杂化轨道sp杂化轨道是由1个s轨道和1个p轨道杂化而成的180°直线形价层电子对数杂化轨道类型2sp3sp24sp3杂化轨道间的夹角杂化轨道类型109º28´sp3120ºsp2180ºsp分子或离子的空间结构杂化轨道类型正四面体形sp3平面三角形sp2直线形sp选项粒子空间结构解释A氨基负离子(NH2−)直线形N原子采用sp杂化B二氧化硫(SO2)V形S原子采用sp3杂化C碳酸根离子(CO32−)三角锥形C原子采用sp3杂化D乙炔(C2H2)直线形C原子采用sp杂化且C原子的价电子均参与成键化学式BF3CO2PCl5SO3H2ONH3SO2中心原子化合价的绝对值3456234中心原子价层电子数3456656分子极性非极性非极性非极性非极性极性极性极性①He:-268.8a:-249.5Ar:-185.8Kr:-151.7②F2:-187.0Cl2:-33.6b:58.7I2:184.0③c:19.4HC1:-84.0HBr:-67.0HI:-35.3④H2O:100.0H2S:-60.0d:-42.0H2Te:1.8
第二章 分子结构与性质知识导引知识清单一、共价键(一)共价键的分类1.按照原子的组成划分:2.按照重叠方式划分:说明:①一般情况下,σ键比π键牢固,但并不是所有分子中的σ键都比π键牢固(例如:N2)②并不是所有的分子都含有σ键(二)共价键的形成条件及特征1.形成条件:通常电负性相同或差值较小的非金属元素原子之间形成共价键,大多数电负性之差小于1.7的金属与非金属原子之间形成共价键。2.特征:(三)键参数——键能、键长与键角1.键能(1)定义:气态分子中1mol化学键解离成气态原子所吸收的能量称为键能。(2)测定方法:键能可通过实验测定,更多的却是推算获得的注:同种类型的共价键,键能大小为:单键<双键<三键2.键长(1)定义:构成化学键的两个原子的核间距叫做该化学键的键长。由于分子中的原子始终处于不断振动之中,键长只是振动着的原子处于平衡位置时的核间距。(2)定性判断键长的方法①根据原子半径进行判断。在其他条件相同时,成键原子的半径越小,键长越短。②根据共用电子对数判断。相同的两原形成共价键时,单键键长>双键键 长>三键键长3.键角(1)定义:在多原子分子中,两个相邻共价键之间的夹角称为键角。(2)测定方法:键长和键角的数值可通过晶体的X射线衍射实验获得(3)常见分子的键角及分子空间结构:4.键参数对分子性质的影响:相同类型的共价化合物分子,成键原子半径越小,键长越短,键能越大,分子越稳定 例题1:下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠形成的是( )A.H2 B.Cl2 C.NaH D.HF【答案】D【解析】氢气分子中的σ键是由两个1s轨道以“头碰头”方式重叠形成的,A项错误;Cl2分子中的σ键是由两个3p轨道以“头碰头”方式重叠形成的,B项错误;NaH中没有共价键,C项错误;HF分子中的σ键是由1s轨道和2p轨道以“头碰头”方式重叠形成的,D项正确。例题2:五种短周期主族元素X、Y、Z、R、W的原子序数依次增大,它们形成的化合物的结构如图所示。基态X原子的核外电子只有一种自旋取向,Y、Z、R为同周期元素。下列说法正确的是( )A.电负性:R
相关资料
更多









