





所属成套资源:新人教版化学选择性必修3PPT课件+教案+分层作业+导学案(原卷+解析卷)全套(含单元复习资料)
高中化学人教版 (2019)选择性必修3第二节 烯烃 炔烃精品课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修3第二节 烯烃 炔烃精品课件ppt,共32页。PPT课件主要包含了课前导入,炔烃的结构,官能团,结构特点,HC≡CH,HC≡C-CH3,-丁炔,C4H6,结构式,结构简式等内容,欢迎下载使用。
我国古时曾有“器中放石几块,滴水则产气,点之则燃”的记载。这种石头就是电石(主要成分CaC2 ),气体就是乙炔。
分子中含有碳碳三键的不饱和链烃
链状单炔烃CnH2n-2(n≥2)
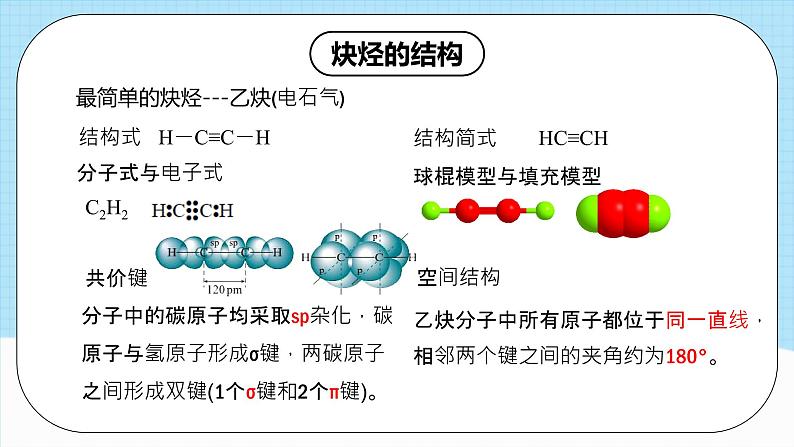
碳碳三键碳原子均采取sp杂化,以碳碳三键为中心的4个原子一定在同一直线
碳碳三键(—C≡C—)
(与二烯烃、环烯烃相同)
HC≡C-CH2-CH3
H3C-C≡C-CH3
H2C=CH-CH=CH2
最简单的炔烃---乙炔(电石气)
分子中的碳原子均采取sp杂化,碳原子与氢原子形成σ键,两碳原子之间形成双键(1个σ键和2个π键)。
乙炔分子中所有原子都位于同一直线,相邻两个键之间的夹角约为180°。
例1.下列有关乙炔分子中的化学键描述不正确的是( )。A.两个碳原子采用sp杂化方式B.两个碳原子采用sp2杂化方式C.每个碳原子都有两个未参与杂化的2p轨道形成π键D.两个碳原子间形成两个π键和一个σ键
电石(CaC2),常含有磷化钙,硫化钙等杂质
磷化钙(Ca3P2)与水反应产物为?CaS与水反应产物为?
反应剧烈,放热,有气体产生
产生明亮的火焰,有黑烟
(1)以上实验现象与你的预测是否一致?乙炔通入酸性高锰酸钾溶液时的实验现象,说明乙炔具有怎样的化学性质?
(2)乙炔通入溴的四氯化碳溶液时的实验现象,说明乙炔具有怎样的化学性质?这与乙炔的哪些结构特点有关?并指出反应前后官能团和化学键的变化。
(3)乙炔在空气中燃烧的实验现象,说明乙炔在组成上有哪些特点?与乙烯的燃烧有什么区别?
一致;酸性高锰酸钾溶液褪色;乙炔具有还原性(π键)。
溴的四氯化碳溶液褪色;乙炔具有还原性(π键)
(2)盛电石的试剂瓶要及时密封,严防电石吸水而失效。取电石要用镊子夹取,切忌用手拿。
(1)实验装置在使用前要先检查装置的气密性
①使用分液漏斗,以便控制饱和食盐水的流速。
②使用饱和食盐水作为反应物,减小浓度、降低反应速率。
(3)剧烈,如何不剧烈?
(4)Ca(OH)2糊状微溶
①导管内塞少许棉花,防止产生的泡沫涌入导管。
②发生装置不能使用启普发生器。
(5) 使用CuSO4而不用NaOH除去H2S PH3等杂质。
CuSO4+H2S=CuS↓+H2SO48CuSO4+2PH3 + 8H2O =8Cu↓+2H2PO4 +8H2SO4
(6) 收集采用排水法还是排空气法?
①可以用向下排空气法,不可以用向上排空气法,因为乙炔相对分子质量小于空气,即密度小于空气密度。
②最好采取排水法,因为乙炔不溶于水。
例2.实验室制取的乙炔气体中常混有少量H2S、CO2和水蒸气,为了得到干燥纯净的乙炔气体,选择最简便的实验方案有( )。A.依次通过NaOH溶液、浓H2SO4和石灰水B.通过CuSO4溶液后再通过石灰水C.通过五氧化二磷,再通过无水CaCl2D.通过足量的碱石灰
(1)图中A管的作用是 ,制取乙炔的化学方程式是 ,为避免反应太剧烈,可采取的措施为 。 (2)将乙炔通入酸性KMnO4溶液中观察到的现象是 ,乙炔发生了 反应。 (3)将乙炔通入溴的CCl4溶液中可观察到的现象是 ,乙炔发生了 反应。 (4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。
例3.制取乙炔的实验装置如图所示,回答下列问题:
(2)酸性KMnO4溶液紫色褪去 氧化(3)溴的CCl4溶液橙色褪去 加成(4)检验乙炔的纯度 火焰明亮并伴有浓烈的黑烟
(1)调节水面高度以控制反应的发生和停止
2.炔烃的物理性质——递变规律与烷烃和烯烃相似
1.乙炔(俗称电石气)是最简单的炔烃。乙炔是无色、无臭的气体,微溶于水,易溶于有机溶剂。
(1)炔烃的沸点随分子中碳原子数的递增而逐渐 ,碳原子数相同时,支链越多,熔沸点越低。(2)状态由气态(常温下,碳原子数 时)到液态、固态。(3)炔烃几乎都 溶于水,但可溶于有机溶剂。(4)液态炔烃的密度均比水 。
乙炔在氧气中燃烧放出大量的热,氧炔焰的温度可达3000 ℃以上,可用于焊接或切割金属。
b.KMnO4:被酸性KMnO4溶液氧化,溶液褪色
2KMnO4+3H2SO4+C2H2→2MnSO4+K2SO4+2CO2↑+4H2O
可鉴别乙炔和甲烷,但不可除杂!!
(H2、X2、HX、H2O等)
CH≡CH + H2 CH2=CH2
C2H2与H2的加成可以按1:1或1:2加成,其程度可通过条件得到控制。
总反应 CH≡CH + 2Br2 → CHBr2CHBr2
1,1,2,2-四溴乙烷
可用于除去甲烷中的乙炔!
产物可溶于四氯化碳等有机溶剂,不溶于水。
聚氯乙烯(PVC塑料)
乙炔与水加成后的产物乙烯醇(CH2=CH—OH)很不稳定,很快转化为乙醛。
聚乙炔可用于制备导电高分子材料。经溴或碘掺杂之后导电性会提高到金属水平。白川英树、艾伦·黑格和艾伦·麦克迪尔米德因“发现和发展导电聚合物”获得2000年的诺贝尔化学奖。
炔烃的化学性质---与乙炔相似,都能发生氧化反应以及加成、加聚反应
b.与酸性KMnO4溶液反应:
将炔烃通入酸性KMnO4溶液中,会使其褪色
X-C≡C-Y+Br2 →CXBr=CYBr
例4.下列各组物质之间的化学反应,反应产物一定为纯净物的是( )。A.CH2 CH2+Br2B.CH2 CH—CH2—CH3+HClC.C(CH3)4+Cl2D.nCH3—CH CH2
例5.桶烯的结构简式如图所示,下列说法正确的是( )。A.0.1 ml桶烯完全燃烧需要消耗氧气22.4 LB.桶烯在一定条件下能发生加成反应,不能发生加聚反应C.桶烯的二氯取代产物只有3种D.桶烯与苯乙烯(C6H5CH CH2)互为同分异构体
炔烃的化学性质与乙炔相似
相关课件
这是一份高中化学人教版 (2019)选择性必修3第二节 烯烃 炔烃教学课件ppt,共24页。PPT课件主要包含了学习目标,新课导入,产生了大量的乙炔气体,知识点一,乙炔C2H2,乙炔的组成与结构,球棍模型,空间充填模型,思考讨论,直线型键角1800等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修3第二节 烯烃 炔烃优秀ppt课件,共83页。PPT课件主要包含了第一部分炔烃的结构,知识新授,炔烃的结构,碳碳三键,-C≡C-,-2H,单烯烃CnH2n,单炔烃,直线形,键能kJmol等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修3第二节 烯烃 炔烃优质ppt课件,共40页。










