





所属成套资源:【新课标】人教版2019高中化学必修一课件及作业
高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教课内容ppt课件
展开
这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应教课内容ppt课件,共34页。PPT课件主要包含了强弱规律,还原性氧化性,Fe>Cu,优先规律,Ag+>Cu2+,价态规律,氧化还原方程式配平,五步法,十字交叉法,设一法等内容,欢迎下载使用。
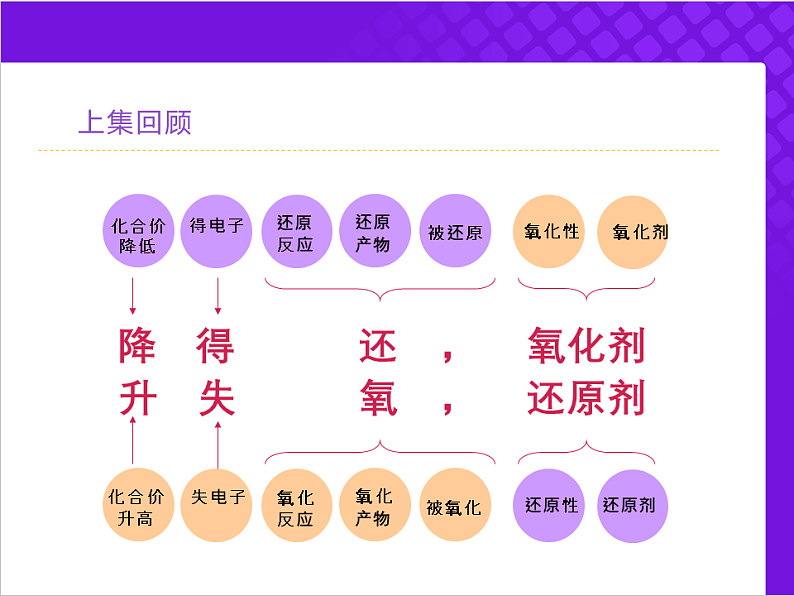
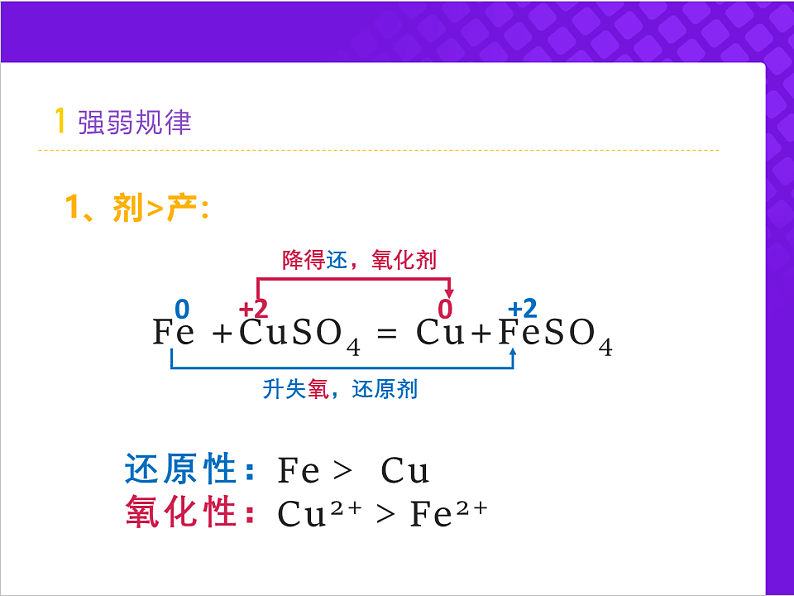
降 得 还 , 氧化剂 升 失 氧 , 还原剂
氧化性(得e-能力):氧化剂>氧化产物
还原性(失e-能力) :还原剂>还原产物
Fe +CuSO4 = Cu+FeSO4
Cu2+>Fe2+
氧化性:Cl2 > Br2 > Fe3+ > I2 > SO2> S
K > Ca > Na > Mg > Al > Zn > Fe > Sn > Pb > H > Cu > Hg > Ag > Pt > Au
S2- > SO32- > I- > Fe2+ >Br- > Cl-
同一氧化剂,先与还原性强的物质反应 同一还原剂,先与氧化性强的物质反应
Cl2 +2Fe2+= 2Cl-+2Fe3+
Cl2 +2I-= 2Cl-+2I2
1. 高氧、低还、中两性
Fe3+ Fe2+ Fe
SO42-SO32-S S2-
最高价态只有氧化性最低价态只有还原性,中间价态既有氧化性又有还原性
2.化合价就近原则:只靠拢,不交叉
例:H2S+H2SO4(浓)=S↓+SO2↑+2H2O
例:KClO3+6HCl=KCl+3Cl2+3H2O
浓H2SO4能干燥SO2 Fe2+,Fe3+可共存
失e-总数=得e-总数=转移电子数
↑m×原子数n1=↓m×原子数n2
NH3 + O2 — NO + H2O
1. 标变价2. 列升降 需要寻找基准物。两个要求:完全参与氧还、角标大的原子3. 求总数 注意变价原子在物质中的角标要乘上4. 配系数 最小公倍数——配基准物的系数5. 查守恒 先变后定,调氢平氧
Cu + HNO3(稀) — Cu(NO3)2+ NO↑+ H2O
FeS + HNO3(稀) — Fe(NO3)3 + NO↑+ S + H2O
1. 适用范围2.原理3.口诀最高价态写在上、最低价态写在下、中间价态写中间交叉做差得比例
电子得失守恒+原子守恒
歧化反应 / 归中反应
S+ KOH — K2S+ K2SO3+ H2O
1. 适用范围2.原理3. 优势 配平物质中有元素化合价不明确的方程式
通用(所有物质均已给出)
FeTiO3+ C+ Cl2—— TiCl4+ FeCl3+ CO
5、复杂氧化还原反应:
1. 补项所谓缺项方程式,即某些反应物或生成物化学式未写出的方程式,缺项一般为 H2O、H+、OH—。2.关键1 化合价升降守恒(两剂两产)2 电荷守恒(补项)3 原子守恒(配平未变价元素)
相关课件
这是一份高中化学人教版 (2019)必修 第一册第一章 物质及其变化第三节 氧化还原反应教学ppt课件,共30页。PPT课件主要包含了素养要求,价态规律及应用,课堂检测等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第三节 氧化还原反应课前预习课件ppt,共25页。
这是一份高中人教版 (2019)第三节 氧化还原反应优秀课件ppt,文件包含人教版高中化学必修一133《氧化还原反应》课件pptx、人教版高中化学必修一133《氧化还原反应》同步练习解析版docx、人教版高中化学必修一133《氧化还原反应》同步练习原卷版docx等3份课件配套教学资源,其中PPT共22页, 欢迎下载使用。












