





所属成套资源:人教版高中化学必修第一册精品课件
高中化学人教版 (2019)必修 第一册第二节 元素周期律优秀ppt课件
展开
这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律优秀ppt课件,共22页。PPT课件主要包含了AlSi,元素周期律,非金属,失去或偏移,最外层,归纳总结,金属与非金属分界处,过渡元素,①预测元素的性质,②比较元素的性质等内容,欢迎下载使用。
【学习目标与核心素养】
门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下了空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。镓的性质与门捷列夫推测的一样。门捷列夫还预测在硅和锡之间存在一种元素——“类硅”,15年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。
门捷列夫作出这些伟大预言的科学依据是什么?
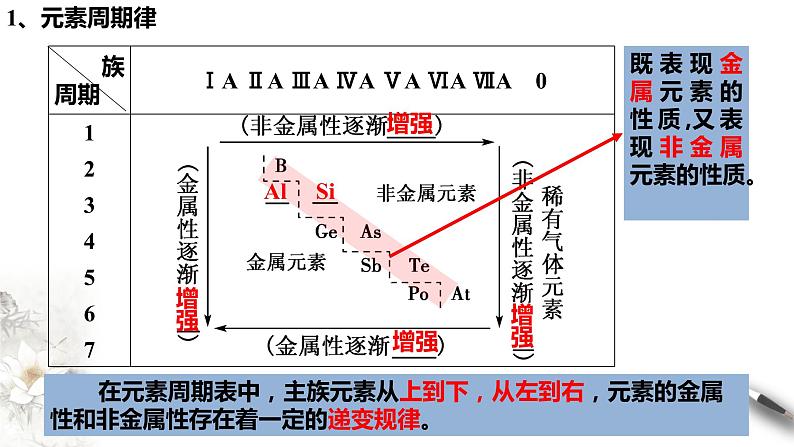
既表现金属元素的性质,又表现非金属元素的性质。
在元素周期表中,主族元素从上到下,从左到右,元素的金属性和非金属性存在着一定的递变规律。
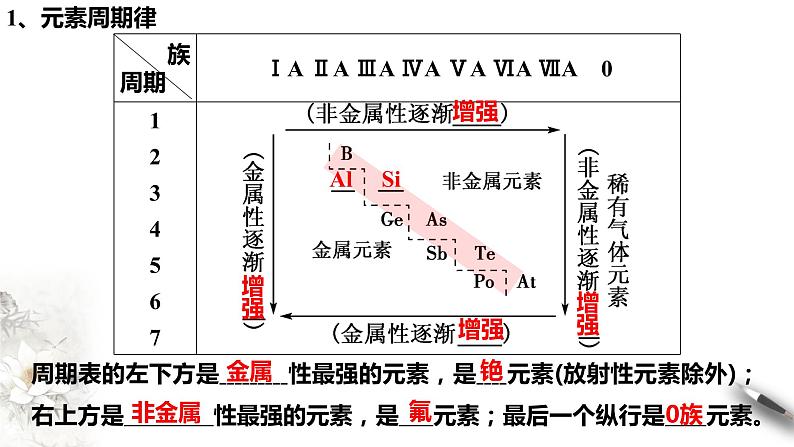
周期表的左下方是 性最强的元素,是 元素(放射性元素除外);右上方是 性最强的元素,是 元素;最后一个纵行是 元素。
2、元素金属性强弱的比较
比较金属性的强弱,其实质是看元素原子 电子的难易程度,越易 电子,金属性越 。(1)根据元素周期表判断①同一周期,从左到右,随着原子序数的递增,元素的金属性逐渐 ;②同一主族,从上到下,随着原子序数的递增,元素的金属性逐渐 。(2)根据元素单质及其化合物的相关性质判断①金属单质与水(或酸)反应越剧烈,元素的金属性 。如Zn与盐酸反应比Fe与盐酸反应更容易,则金属性:Zn>Fe;
②最高价氧化物对应水化物的碱性越强,元素的金属性 。如碱性:NaOH>Mg(OH)2,则金属性:Na>Mg;③金属单质间的置换反应。如Zn+Cu2+===Zn2++Cu,则金属性:Zn>Cu;④元素的原子对应阳离子的氧化性越强,则元素的金属性 。如氧化性:Mg2+>Na+,则金属性:Mg<Na。(3)根据金属活动性顺序判断一般来说,排在前面的金属元素其金属性比排在后面的强。如Fe排在Cu的前面,则金属性:Fe>Cu。提醒 金属性强弱的比较,关键是比较原子失去电子的难易,而不是失去电子数的多少。如Na失去一个电子,而Mg失去两个电子,但Na的金属性比Mg强。
比较元素非金属性的强弱,其实质是看元素原子 电子的难易程度,越易 电子,非金属性越 。(1)根据元素周期表判断①同一周期,从左到右,随着原子序数的递增,元素的非金属性逐渐 ;②同一主族,从上到下,随着原子序数的递增,元素的非金属性逐渐 。(2)根据元素单质及其化合物的相关性质判断①非金属单质越易跟H2化合,其非金属性 。如F2与H2在暗处即可反应,Br2与H2在加热条件下才能反应,则非金属性:F>Br;
3、非元素金属性强弱的比较
②气态氢化物越稳定,其非金属性 。如稳定性:HF>HCl,则非金属性:F>Cl;③最高价氧化物对应水化物的酸性越强,其非金属性 。如酸性:H2SO4>H3PO4,则非金属性:S>P;④非金属单质间的置换反应。如Cl2+2KI===2KCl+I2,则非金属性:Cl>I;⑤元素的原子对应阴离子的还原性越强,其非金属性就 。如还原性:S2->Cl-,则非金属性:Cl>S。
4、元素的化合价与元素在周期表中的位置关系
主族元素的最高正化合价等于原子所能 的最外层电子数(价电子),而非金属的最低负化合价则等于使原子达到8电子稳定结构所需 的电子数。所以,非金属元素的最高正化合价和它的最低负化合价的绝对值之和等于 。(1)最高正化合价= 序数=原子 电子数(O、F除外)。(2)最高正化合价+|最低负化合价|= 。
元素金属性、非金属性递变与其在周期表中的位置关系请填写出图中序号所示内容。① ②_____③ ④_____ ⑤ ⑥__⑦ ⑧_______
碱性最强的是CsOH,酸性最强的含氧酸是HClO4。
5、元素周期表和元素周期律的应用
(1)指导其他与化学相关的科学技术
①在周期表中__________________,可以找到半导体材料。
②在__________中寻找催化剂和耐高温、耐腐蚀的合金材料。
③寻找制取农药的元素 。
如:F、Cl、S、P、As等
5、元素周期表和元素周期律的生产应用
(2)元素周期表和元素周期律的理论应用
根据卤族元素的性质递变规律,推知元素砹(At)的性质:有色固体,与氢难化合,HAt不稳定,水溶液呈酸性,AgAt不溶于水等。
1、镭是第7周期第ⅡA族元素,下列关于镭的性质的描述中不正确的是( )A.镭比钙金属性更强 B.氢氧化物呈两性C.在化合物中呈+2价 D.碳酸盐难溶于水
2、下列说法正确的是( ) A. C、N、O、F原子半径依次增大B. NH3、H2O(g)、HF 稳定性依次增强C. HClO比H2SO4酸性强。D. 甲、乙两种非金属元素与金属钠反应时, 甲得电子的数目多, 所以甲活泼。
元素非金属性越强,氢化物越稳定
HClO不是最高价氧化物对应酸
活泼性与得失电子数目无关,与得失电子的能力有关
3、已知电子层数相同的三种元素X、Y、Z,其最高价含氧酸酸性:H3XO4
相关课件
这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律精品课件ppt,共44页。PPT课件主要包含了元素周期律,元素周期表等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律备课课件ppt,共25页。PPT课件主要包含了二位置决定性质,问题导学,CsOH,HClO4等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第二节 元素周期律课文配套ppt课件,共22页。PPT课件主要包含了AlSi,元素周期律,非金属,失去或偏移,最外层,归纳总结,金属与非金属分界处,过渡元素,①预测元素的性质,②比较元素的性质等内容,欢迎下载使用。










