





所属成套资源:2024--2025年高考化学一轮复习全套知识课件(新教材,新一轮)
课件 高考化学一轮复习第四单元 重要的金属元素 发展素养(四) 科学探究——以金属及其化合物为主体的化学工艺流程分析
展开
这是一份课件 高考化学一轮复习第四单元 重要的金属元素 发展素养(四) 科学探究——以金属及其化合物为主体的化学工艺流程分析,共60页。PPT课件主要包含了Na2CrO4,Fe2O3,抑制金属离子水解,SiO2,作业手册,Mn2+,NH42SO4,CO和SO2,是不合理的等内容,欢迎下载使用。
发展素养(四) 科学探究——以金属及其化合物为主体的化学工艺流程分析
探究点1 以金属及其化合物为主体的“微流程”探究点2 以金属及其化合物为主体的化学工艺流程分析作业手册
探究点1 以金属及其化合物为主体的“微流程”
“六看法”突破金属及其化合物的制备“微流程”
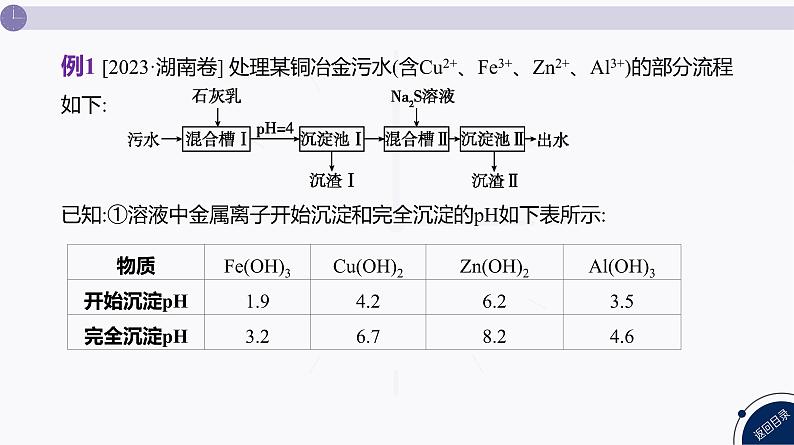
例1 [2023·湖南卷] 处理某铜冶金污水(含Cu2+、Fe3+、Zn2+、Al3+)的部分流程如下:已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
[解析] 污水中含有铜离子、铁离子、锌离子、铝离子,首先加入石灰乳,调pH=4沉淀铁离子和部分铝离子,过滤后,加入硫化钠溶液沉淀其中的铜离子和锌离子,再次过滤。根据表格数据可知Fe3+在pH=1.9时开始形成氢氧化铁沉淀,在pH=3.2时完全沉淀,Al3+在pH=3.5时开始形成氢氧化铝沉淀,在pH=4.6时完全沉淀,则当pH=4时,Fe3+完全沉淀,Al3+部分沉淀,即“沉渣Ⅰ”中含有Fe(OH)3和Al(OH)3,A正确;硫化钠溶液中的硫离子可以水解产生氢氧根离子,使溶液显碱性,以第一步水解为主,方程式为S2-+H2O HS-+OH-,B正确;
变式题2 [2022·河北卷] LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下: 下列说法错误的是( )A.还原工序逸出的Br2用NaOH溶液吸收,吸收液直接返回还原工序B.除杂工序中产生的滤渣可用煤油进行组分分离C.中和工序中的化学反应为Li2CO3+2HBr = CO2↑+2LiBr+H2OD.参与反应的n(Br2)∶n(BaS)∶n(H2SO4)为1∶1∶1
探究点2 以金属及其化合物为主体的化学工艺流程分析
1.化学工艺流程思维模型
2.化学工艺流程中原料预处理的5种常用方法
3.化学工艺流程中控制反应条件的6种方法
[注意] 调节pH所需的物质一般应满足两点:①能与H+反应,使溶液pH变大;②不引入新杂质。例如,若要除去Cu2+中混有的Fe3+,可加入CuO、Cu(OH)2或Cu2(OH)2CO3等物质调节溶液的pH,不可加入NaOH溶液、氨水等。
回答下列问题:(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为 (填化学式)。 (2)水浸渣中主要有SiO2和 。
[解析] (1)因为煅烧过程中加入了NaOH,为碱性环境,故含铬最高价含氧酸盐主要为Na2CrO4。(2)杂质中铁的化合物不会与NaOH及Na2CO3反应,煅烧时通入了空气,故煅烧后铁将以Fe2O3的形式存在,则水浸渣中除了SiO2还主要有Fe2O3。
[解析] (3)“沉淀”步骤调pH到弱碱性的目的是让[Al(OH)4]-沉淀,故主要除去的杂质是铝。
(3)“沉淀”步骤调 pH 到弱碱性,主要除去的杂质是 。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀。该步需要控制溶液的pH≈9以达到最好的除杂效果。若pH9时,会导致 。
磷不能除净(磷酸盐会转化为可溶性的酸式盐)
硅不能除净(生成氢氧化镁,镁离子被消耗)
[解析] (5)由题意可知,V2O5既能与酸反应,又能与碱反应,故V2O5体现两性,选C。
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为 。
变式题 [2022·辽宁卷] 某工厂采用辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)联合焙烧法制备BiOCl和MnSO4,工艺流程如下:已知:①焙烧时过量的MnO2分解为Mn2O3,FeS2转变为Fe2O3;②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围如下:回答下列问题:(1)为提高焙烧效率,可采取的措施为 。 a.进一步粉碎矿石b.鼓入适当过量的空气c.降低焙烧温度
[解析] (1)联合焙烧时,进一步粉碎矿石,可以增大矿石与空气的接触面积,能够提高焙烧效率,a符合题意;鼓入适当过量的空气有利于矿石充分反应,b符合题意;降低焙烧温度,反应速率减慢,不利于提高焙烧效率,c不符合题意。
(2)Bi2S3在空气中单独焙烧生成Bi2O3,反应的化学方程式为 。 (3)“酸浸”中过量浓盐酸的作用为:①充分浸出Bi3+和Mn2+;② 。 (4)滤渣的主要成分为 (填化学式)。 (5)生成气体A的离子方程式为 。 (6)加入金属Bi的目的是 。
Mn2O3+6H++2Cl- = 2Mn2++Cl2↑+3H2O
将Fe3+转化为Fe2+
[解析] (2)Bi2S3在空气中单独焙烧生成Bi2O3,根据原子守恒可知还应生成SO2,结合得失电子守恒,反应的化学方程式为2Bi2S3+9O2 2Bi2O3+6SO2。(3)加入浓盐酸后,溶液中含有的离子主要为Bi3+、Fe3+、Mn2+、H+、Cl-,而酸浸后取滤液进行转化,故要防止金属离子水解生成沉淀,进入滤渣,造成制得的BiOCl产率偏低。(6)由已知信息③知,调pH=2.6时,Fe3+会水解生成Fe(OH)3沉淀,但Fe2+还没开始沉淀,故要将Fe3+转化为Fe2+,在调pH后获得含FeCl2的滤液,为了不引入新的杂质,加入Bi作还原剂。
探究点一 以金属及其化合物为主体的“微流程”
1. 一种工业制备无水氯化镁的工艺流程如下:下列说法错误的是( )A.物质X常选用生石灰B.工业上常用电解熔融MgCl2制备金属镁C.“氯化”过程中发生的反应为MgO+C+Cl2 MgCl2+COD.“煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2
[解析] 流程梳理:物质X常选用生石灰,“沉镁”发生反应:CaO+H2O = Ca(OH)2,MgCl2+Ca(OH)2 = Mg(OH)2↓+CaCl2,使Mg2+转化成Mg(OH)2,A正确;工业上常用电解熔融MgCl2制备金属镁,B正确;“氯化”过程中发生的反应为MgO+C+Cl2 MgCl2+CO,C正确;“煅烧”后的产物中加稀盐酸转化成MgCl2,不能通过加热蒸发MgCl2溶液得到无水MgCl2,需在氯化氢气流中加热得到无水氯化镁,D错误。
3. [2024·吉林长春东北师大附中模拟] 工业上以镉铁矿(主要成分为CdO2、Fe2O3、Fe和SiO2)为原料制备分析试剂Cd(BrO3)2的流程如图所示,已知Cd(SO4)2可溶于水。下列说法不正确的是( ) A.“酸浸”过程既有氧化还原反应,也有非氧化还原反应 B.CH3OH是“还原镉”步骤的还原剂,溶液中Cd4+可能将其氧化为CO2 C.若“氧化”步骤有气泡生成,说明酸性条件下H2O2也能氧化CH3OH D.“沉镉”后的滤液仍会残留少量的Cd2+,排放前需进一步回收处理以防污染环境
[解析] 镉铁矿主要成分为CdO2、Fe2O3、Fe和SiO2,加入稀硫酸“酸浸”,Fe2O3与硫酸发生非氧化还原反应生成Fe2(SO4)3和H2O,Fe2(SO4)3与Fe发生氧化还原反应生成FeSO4,A正确;CH3OH是“还原镉”步骤的还原剂,溶液中Cd4+具有氧化性,可能将CH3OH氧化为CO2,B正确;
“氧化”步骤中H2O2将Fe2+氧化为Fe3+,而Fe3+可催化H2O2的分解反应,故“氧化”步骤产生的气体是O2,不能确定酸性条件下H2O2氧化CH3OH,C错误;“沉镉”后生成CdCO3,存在沉淀溶解平衡,故滤液仍会残留少量的Cd2+,排放前需进一步回收处理以防污染环境,D正确。
5. [2024·山东日照模拟] 某工厂废液经简易处理后的沉淀泥浆中含有大量废铜丝和少量V、Ti、Fe、Si元素氯化物及复杂化合物,一种以该沉淀泥浆为原料回收铜与钒的工艺流程如图所示:已知:常温下Ksp[Fe(OH)3]=2.79×10-39,Ksp[Cu(OH)2]=2.2×10-20,溶液中的离子浓度小于10-5ml·L-1时,可以认为已经被除尽。
下列说法错误的是( )A.泥浆在空气中堆放后由灰色变为疏松的绿色粉状,是因为铜被氧化,便于后续酸浸时铜进入溶液B.流程中利用Cu2(OH)3Cl+OH- = 2Cu(OH)2+Cl-除氯,可以减少酸浸时含氯化合物的挥发C.若浸出液中Cu2+的浓度为0.1 ml·L-1,则酸浸时可调pH=5D.焙烧加入Na2CO3的目的是使V元素转化成可溶性的钒酸盐
[解析] 由泥浆堆放后由灰色变为疏松的绿色粉状可以得出是铜被氧化,酸浸时可以进入溶液便于后期制备胆矾,A正确;常温下除氯,Cl-进入废液,可以在酸浸时减少HCl挥发,更加环保,B正确;
6. [2024·辽宁抚顺六校联考] 以高硫铝土矿(主要成分为Fe2O3、Al2O3、SiO2,还含有少量FeS2和硫酸盐)为原料制备聚合硫酸铁{[Fe2(OH)x(SO4)y]n}和明矾的部分工艺流程如下:已知:赤泥液的主要成分为Na2CO3。下列说法错误的是( )A.赤泥液的作用是吸收“焙烧”阶段中产生的SO2B.从“滤液”到“明矾”的过程中还应有“除硅”步骤C.聚合硫酸铁可用于净化自来水,与其组成中的Fe3+具有氧化性有关D.在“聚合”阶段,若增加Fe2O3用量,会使[Fe2(OH)x(SO4)y]n中x变大
[解析] 焙烧时,FeS2与O2反应生成Fe2O3和SO2,反应方程式为4FeS2+11O2 2Fe2O3+8SO2,用赤泥液吸收生成的SO2,反应方程式为Na2CO3+SO2 = Na2SO3+CO2,A正确;由于“碱浸”造成二氧化硅溶于氢氧化钾溶液,滤液中含硅酸盐,从“滤液”到“明矾”的过程中,需要进行“除硅”步骤,B正确;
聚合硫酸铁可用于净化自来水,与其组成中的Fe3+具有水解产生胶体的性质有关,与其组成中的Fe3+具有氧化性无关,C错误;在“聚合”阶段,若增加Fe2O3用量,碱性增强,x变大,D正确。
7. [2024·江西九校联盟联考] 锂离子电池的应用很广泛,某种锂电池的正极材料为钴酸锂,该材料可以由海水(含较高浓度的LiCl及少量MgCl2、CaCl2、MnCl2等)为原料制备,其工艺流程如图所示:
探究点二 以金属及其化合物为主体的化学工艺流程分析
已知:①在常温下几种难溶物质的溶度积常数如表②Li2CO3微溶于热水,可溶于冷水。回答下列问题:(1)“除杂1”步骤中除去的杂质离子为Mg2+和 。
[解析] (1)海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等,加入纯碱,根据难溶物质的溶度积,得到滤渣主要成分有Mg(OH)2、CaCO3和MnCO3,故“除杂1”步骤中除去的杂质离子为Mg2+和Ca2+、Mn2+。
(2)“调pH”的目的是 。 (3)金属镁可以通过电解熔融MgCl2得到,写出由Mg(OH)2沉淀制MgCl2固体的具体操作: 。
[解析] (3)因镁离子水解生成挥发性HCl,故蒸干MgCl2溶液时需在HCl的气流中进行,抑制水解,由Mg(OH)2沉淀制MgCl2固体的具体操作为Mg(OH)2溶于过量盐酸得到含MgCl2溶液,在HCl的气流中蒸发溶液得到无水MgCl2。
除去过量的碳酸钠,避免蒸发浓缩时析出碳酸锂
Mg(OH)2溶于过量盐酸得到含MgCl2溶液,在HCl的气流中蒸发溶液得到无水MgCl2
0.18 ml·L-1
(4)20 ℃时碳酸锂在水中的溶解度为1.295 g,饱和溶液密度为1.014 8 g·cm-3,其中Li2CO3的物质的量浓度为 。(结果保留2位有效数字)
(5)“热水洗涤”的目的是 。 (6)“合成”工序需要高温条件,并放出能使澄清石灰水变浑浊的气体,写出该反应的化学方程式: 。
[解析] (5)根据信息可知“热水洗涤”的目的是减少碳酸锂在洗涤过程中的损失。(6)“合成”工序中碳酸锂和碳酸钴在高温条件下与空气中的氧气反应,放出能使澄清石灰水变浑浊的气体二氧化碳并生成钴酸锂,该反应的化学方程式为2Li2CO3+4CCO3+O2 4LiCO2+6CO2。
减少碳酸锂在洗涤过程中的损失
8. [2023·河北沧州开学考] 镍粉作为导电填料广泛应用于电路保护的热敏器件,其具有明显降低电阻率的优点。某工厂以氧化镍废渣(主要含有NiO、Fe3O4及少量SiO2)为主要原料制备镍粉,其工艺流程如图所示:
25 ℃时,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:回答下列问题:(1)“酸浸”时Fe3O4发生反应的离子方程式为 ,“滤渣1”中主要成分的一种用途是 。
Fe3O4+8H+ = Fe2++2Fe3++4H2O
制光导纤维或制玻璃或制纯硅
[解析] 向氧化镍废渣中加稀硫酸酸浸,SiO2不溶,过滤除去,滤液中加入H2O2溶液,将Fe2+氧化为Fe3+,再加NiO调节溶液的pH,将Fe3+转化为Fe(OH)3沉淀除去,滤液中加草酸铵,将Ni2+沉淀为NiC2O4,最后用H2还原NiC2O4得到镍。(1)“酸浸”时Fe3O4和稀硫酸发生反应生成硫酸铁、硫酸亚铁和水,离子方程式为Fe3O4+8H+ = 2Fe3++Fe2++4H2O。“滤渣1”的主要成分是SiO2,可以用来制光导纤维、制玻璃、制纯硅等。
[解析] (2)“转化”时Fe2+被H2O2氧化为Fe3+,氧化剂是H2O2,1 ml H2O2得到2 ml电子,Fe2+是还原剂,1 ml Fe2+失去1 ml电子,根据得失电子守恒,理论上消耗的氧化剂与还原剂的物质的量之比为1∶2。
(2)“转化”时理论上消耗的氧化剂与还原剂的物质的量之比为 。
(3)“调pH”时应控制的pH范围是 , 表中a= 。
(4)“沉镍”时不宜用草酸钠代替草酸铵,其原因是 , “滤液”中溶质的主要成分为 (写化学式)。
[解析] (4)草酸钠溶液碱性较强,可能会生成Ni(OH)2沉淀,草酸铵中草酸根离子和铵根离子都水解,使溶液的酸碱性保持在适合草酸镍生成沉淀而Ni(OH)2不沉淀的环境,所以不能用草酸钠代替草酸铵;根据流程中加入的物质,滤液的主要成分是(NH4)2SO4。
草酸钠溶液碱性较强,会生成Ni(OH)2沉淀,草酸铵中草酸根离子和铵根离子都水解,使溶液的酸碱性保持在适合草酸镍生成沉淀而Ni(OH)2不沉淀的环境
(5)“还原”时NiC2O4与H2反应,气体产物为CO、CO2,且物质的量之比为1∶1,该反应的化学方程式为 。
[解析] (5) “还原”时NiC2O4与H2反应,气体产物为CO、CO2,且物质的量之比为1∶1,则碳元素的化合价既升高,又降低,且升高和降低的数值相等,该反应中Ni的化合价从+2价降低到0价,H的化合价从0价升高到+1价,则NiC2O4和H2的化学计量数相等,该反应的化学方程式为NiC2O4+H2 Ni+CO↑+CO2↑+H2O。
9. [2024·辽宁十校联合体调研] 以某铁钴矿(主要成分为 FeC2S4,还含有少量 MgO、SiO2等杂质)为原料制取金属钴和黄钠铁矾的工艺流程如图所示:
可能用到的常数如下:HF的电离常数Ka=6.3×10-4。
请回答下列问题:(1)焙烧铁钴矿时,产生气体A的主要成分有 ;滤渣 1 的主要成分为 。
[解析] (1)FeCS4与焦炭、空气在熔剂作用下焙烧得到金属氧化物,生成SO2和CO气体,SiO2不溶于硫酸,则滤渣1的主要成分为SiO2。
(2)在溶液A中加入适量的Na2CO3溶液调节pH 为 1.6~2.0,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式: ,此步骤加入Na2CO3不宜过量,原因是 。
3Fe2(SO4)3+6H2O+6Na2CO3 = 5Na2SO4+Na2Fe6(SO4)4(OH)12↓+6CO2↑
若Na2CO3过量,pH超过2.0,会加速Fe3+水解,产生Fe(OH)3沉淀,黄钠铁矾产率降低
[解析] (2)滤液1中加入NaClO溶液,Fe2+转化为Fe3+,在溶液A中加入适量的Na2CO3溶液调节pH为1.6~2.0,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,根据原子守恒可知该反应的化学方程式为3Fe2(SO4)3+6H2O+6Na2CO3 = 5Na2SO4+Na2Fe6(SO4)4(OH)12↓+6CO2↑;若Na2CO3过量,pH超过2.0,会加速Fe3+水解,产生Fe(OH)3沉淀,黄钠铁矾产率降低,所以此步骤加入Na2CO3不宜过量。
(3)确定滤液1中的Fe2+已被氧化完全的方法: 。
[解析] (3)确定滤液1中的Fe2+被氧化完全,即检验滤液中无Fe2+,检验亚铁离子一般用K3[Fe(CN)6]溶液,所以确定滤液1中的Fe2+已被氧化完全的方法为取适量滤液1于试管中,滴加几滴K3[Fe(CN)6]溶液,无蓝色沉淀产生,说明Fe2+已被完全氧化。
取适量滤液1于试管中,滴加几滴K3[Fe(CN)6]溶液,无蓝色沉淀产生,说明 Fe2+已被完全氧化
(4)已知:当离子浓度小于 1.0×10-5 ml·L-1 时,可认为沉淀完全。25 ℃时,在滤液2中加入NaF溶液,当溶液中 Mg2+刚好沉淀完全时,测得溶液的pH为3.5,此时溶液中HF的浓度为 ml·L-1。(保留2位有效数字)
[解析] (5)由于Fe2+的还原性强于C2+,优先被NaClO溶液氧化为Fe3+,有利于得到较纯的黄钠铁矾,所以流程中NaClO溶液必须分两次加入。
Fe2+的还原性强于C2+,优先被NaClO溶液氧化为Fe3+,有利于得到较纯的黄钠铁矾
(5)流程中NaClO溶液必须分两次加入,请解释原因: 。
(6)经检测,滤渣4是由 C(OH)3和C(OH)SO4形成的混合物,请写出后者焙烧时发生反应的化学方程式: 。
[解析] (6)C(OH)SO4焙烧时生成C2O3,根据原子守恒可知还有水和三氧化硫生成,则发生反应的化学方程式为2C(OH)SO4 C2O3+H2O↑+2SO3↑。
回答下列问题:(1)Fe、Ni元素在周期表位于 区。 (2)“酸浸”后所得废渣的主要成分为 (填化学式);除铜步骤的离子方程式为 。 (3)“氧化”时,若用稀硝酸代替过氧化氢溶液氧化Fe2+,从环保角度分析其 (填“是合理的”或“是不合理的”),理由是 。 (4)“沉镍”时,加入NaOH溶液调节pH至13,滤液中的Cr2(SO4)3转化为NaCrO2,写出该反应的离子方程式: 。 (5)“灼烧”反应过程中氧化剂与还原剂的物质的量之比为 。
Cu2++FeS = CuS+Fe2+
稀硝酸被Fe2+还原为NO,污染环境
[解析] 含镍废渣(主要成分为NiO、Fe3O4,还含有少量的CuO、Cr2O3、SiO2等杂质)加稀硫酸酸浸,其中SiO2不溶于稀硫酸,过滤除去,滤液中含Ni2+、Fe2+、Fe3+、Cu2+和Cr3+;酸性滤液中加入FeS,将Cu2+形成沉淀CuS过滤除去;加入过氧化氢溶液,将Fe2+氧化为Fe3+后,加入Na2CO3溶液将Fe3+形成黄钠铁矾沉淀,过滤除去;再加入NaOH溶液将Ni2+形成沉淀,过滤出氢氧化镍后在空气中灼烧生成碱式氧化镍。(1)根据Fe、Ni元素基态原子核外电子排布式可知,二者在周期表中位于d区。
(2)酸浸时SiO2不溶于稀硫酸,为滤渣;酸性滤液中加入FeS,将Cu2+形成沉淀CuS过滤除去,离子方程式为Cu2++FeS = CuS+Fe2+。(3)“氧化”时,若用稀硝酸代替过氧化氢溶液氧化Fe2+,稀硝酸被Fe2+还原为NO,污染环境。
相关课件
这是一份PPT课件 高考化学一轮复习第五单元化工生产中重要非金属元素 发展素养(五) 学科价值——化学与STSE,共50页。PPT课件主要包含了作业手册等内容,欢迎下载使用。
这是一份PPT课件 高考化学一轮复习第四单元重要的金属元素 第十三讲 铁及其化合物,共60页。PPT课件主要包含了夯实必备知识,化合物,铁的物理性质,2铁的化学性质,铁的氧化物,红棕色,白色固体,红褐色固体,铁的氢氧化物,FeOH3↓等内容,欢迎下载使用。
这是一份PPT课件 高考化学一轮复习第四单元重要的金属元素 第十一讲 钠的单质及其氧化物,共60页。PPT课件主要包含了使用建议,教学建议,夯实必备知识,钠的物理性质,钠的化学性质,NaCl+Ti,石蜡油或煤油中,对点自测,提升关键能力,考点二钠的氧化物等内容,欢迎下载使用。









