





所属成套资源:2024--2025年高考化学一轮复习全套知识课件(新教材,新一轮)
课件 高考化学一轮复习第七单元 化学反应与能量 发展素养(十) 模型认知——反应热的计算
展开
这是一份课件 高考化学一轮复习第七单元 化学反应与能量 发展素养(十) 模型认知——反应热的计算,共42页。PPT课件主要包含了作业手册等内容,欢迎下载使用。
发展素养(十) 模型认知——反应热的计算
探究点1 根据键能计算反应热探究点2 根据盖斯定律反应热探究点3 根据图像信息计算反应热作业手册
探究点1 根据键能计算反应热
例1 [2024·辽宁沈阳二中模拟] 已知:①CO的结构式为C≡O;②298 K时相关化学键的键能数据如下表:则反应CO(g)+3H2(g) ⇌ CH4(g)+H2O(g)的ΔH的值为( )A.-198 kJ·ml-1 B.+267 kJ·ml-1C.-298 kJ·ml-1 D.+634 kJ·ml-1
[解析] 根据反应热ΔH与反应物、生成物中化学键键能的关系“ΔH=Σ(反应物键能)-Σ(生成物键能)”,据此可得,反应CO(g)+3H2(g) ⇌ CH4(g)+H2O(g)的ΔH=(1076 kJ·ml-1+3×436 kJ·ml-1)-(413 kJ·ml-1×4+465 kJ·ml-1×2)=-198 kJ·ml-1。
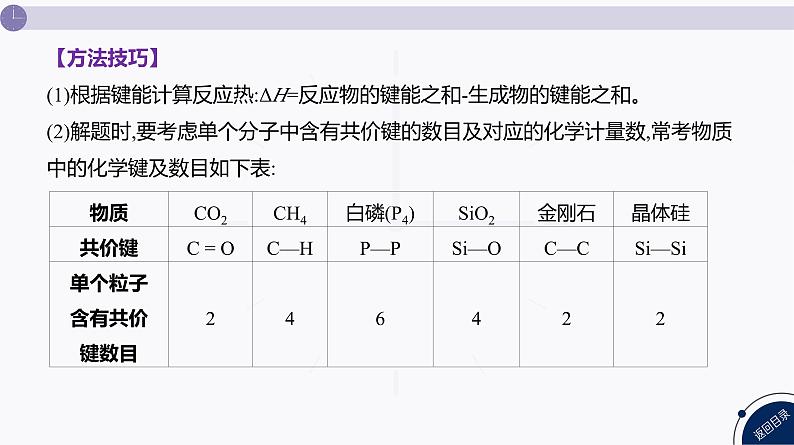
【方法技巧】 (1)根据键能计算反应热:ΔH=反应物的键能之和-生成物的键能之和。(2)解题时,要考虑单个分子中含有共价键的数目及对应的化学计量数,常考物质中的化学键及数目如下表:
变式题 [2023·浙江舟山联考] NH3和NO是有毒气体,在一定条件下,二者可通过反应转化为无害的N2和H2O。已知:断开1 ml N≡N、1 ml N—H、1 ml N = O、1 ml H—O吸收的能量分别为946 kJ·ml-1、391 kJ·ml-1、607 kJ·ml-1、464 kJ·ml-1,则反应4NH3(g)+6NO(g) ⇌ 5N2(g)+6H2O(g)的反应热ΔH为( )A.-1964 kJ·ml-1B.+430 kJ·ml-1C.-1780 kJ·ml-1D.-450 kJ·ml-1
[解析] 根据反应的反应热与物质键能之间的关系,可进行如下计算:反应4NH3(g)+6NO(g) ⇌ 5N2(g)+6H2O(g)的反应热ΔH=E(反应物的键能)-E(生成物的键能)=12E(N—H)+6E(N = O)-5E(N≡N)-12E(H—O)=12×391 kJ·ml-1+6×607 kJ·ml-1-5×946 kJ·ml-1-12×464 kJ·ml-1=-1964 kJ·ml-1。
探究点2 根据盖斯定律反应热
例2 [2023·浙江卷] “碳达峰·碳中和”是我国社会发展重大战略之一,CH4还原CO2是实现“双碳”经济的有效途径之一,相关的主要反应有:Ⅰ:CH4(g)+CO2(g) ⇌ 2CO(g)+2H2(g) ΔH1=+247 kJ·ml-1,K1Ⅱ:CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ΔH2=+41 kJ·ml-1,K2反应CH4(g)+3CO2(g) ⇌ 4CO(g)+2H2O(g)的ΔH= kJ·ml-1。
[解析] 根据盖斯定律,反应 Ⅰ +反应 Ⅱ ×2可得目标反应,则该反应的焓变ΔH=ΔH1+2ΔH2=+247 kJ·ml-1+(+41 kJ·ml-1)×2=+329 kJ·ml-1。
【方法技巧】 利用盖斯定律解题的思维流程将所给热化学方程式适当加减得到所求的热化学方程式,反应热也作相应的加减运算。思维流程如下:
变式题 (1)利用CH4超干重整CO2技术可得到富含CO的化工原料。已知:①CH4(g)+H2O(g) = CO(g)+3H2(g) ΔH1=+196 kJ·ml-1②2H2(g)+O2(g) = 2H2O(g) ΔH2=-484 kJ·ml-1③2CO(g)+O2(g) = 2CO2(g) ΔH3=-566 kJ·ml-1则CH4(g)+CO2(g) = 2CO(g)+2H2(g) ΔH= 。
+237 kJ·ml-1
(2)一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:①CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.1 kJ·ml-1②CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160.6 kJ·ml-1则CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) ΔH= 。
-867.35 kJ·ml-1
探究点3 根据图像信息计算反应热
【方法技巧】 (1)根据物质的总焓值(能量)计算反应热:ΔH=H总(生成物)-H总(反应物)。(2)根据正、逆反应的活化能计算反应热:ΔH=Ea(正反应)-Ea(逆反应)。
变式题 2023年5月30日我国在酒泉卫星发射中心利用长征二号F遥十六运载火箭成功将“神舟十六号”送入太空。运载火箭第三级使用液氧-液氢作推进剂。已知:①H2(g) = H2(l) ΔH1=-0.92 kJ·ml-1②O2(g) = O2(l) ΔH2=-6.84 kJ·ml-1下列说法正确的是( )A.H2(g)与O2(g)反应生成H2O(g)放热483.6 kJ·ml-1B.氢气的燃烧热ΔH=-241.8 kJ·ml-1C.火箭中液氢燃烧的热化学方程式为2H2(l)+O2(l) = 2H2O(g) ΔH=-474.92 kJ·ml-1D.H2O(g) = H2O(l) ΔH=-88 kJ·ml-1
探究点一 根据键能计算反应热
1. [2024·北京朝阳区统考] 已知某些化学键的键能数据如下,下列说法不正确的是( )A.根据键能可估算反应H2(g)+Cl2(g) = 2HCl(g)的ΔH=-185 kJ·ml-1B.根据原子半径可知键长:H—Cl
相关课件
这是一份课件 高考化学一轮复习第六单元 物质结构 元素周期律 发展素养(九) 模型认知——晶胞的有关计算,共60页。PPT课件主要包含了Ca2+,信息解读,作业手册,KFe2Se2等内容,欢迎下载使用。
这是一份课件 高考化学一轮复习第二单元 化学常用计量 发展素养(三) 模型认知——化学计算的常用方法,共54页。PPT课件主要包含了信息解读,MgC2O4·H2O,具体步骤如下,作业手册,C4H6O6,Sc2C2O43,CoC2O4,淀粉溶液,50%等内容,欢迎下载使用。
这是一份课件 高考化学一轮复习第一单元 物质及其变化 发展素养(一) 模型认知——情境型方程式的书写,共46页。PPT课件主要包含了解题策略,信息解读,作业手册,Na2SiO3,V2O5等内容,欢迎下载使用。









