




课件 高考化学一轮复习第八单元 化学反应速率与化学平衡 发展素养(十三) 平衡思想——化学平衡常数K、Kp的计算
展开发展素养(十三) 平衡思想——化学平衡常数K、Kp的计算
探究点1 浓度平衡常数的计算探究点2 压强平衡常数的计算作业手册
探究点1 浓度平衡常数的计算
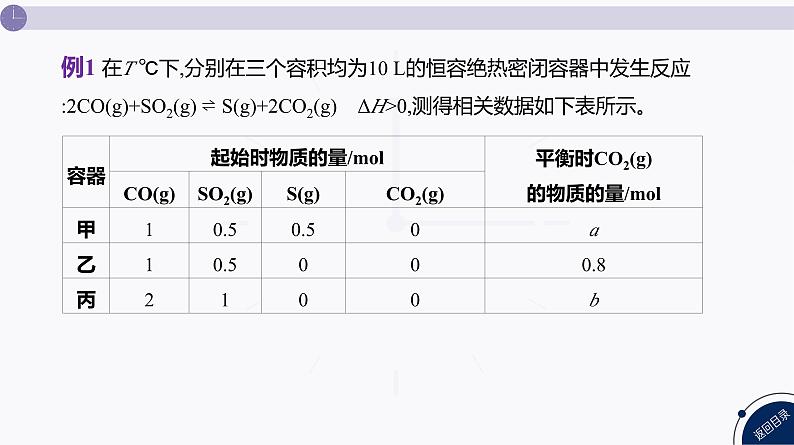
例1 在T ℃下,分别在三个容积均为10 L的恒容绝热密闭容器中发生反应:2CO(g)+SO2(g) ⇌ S(g)+2CO2(g) ΔH>0,测得相关数据如下表所示。
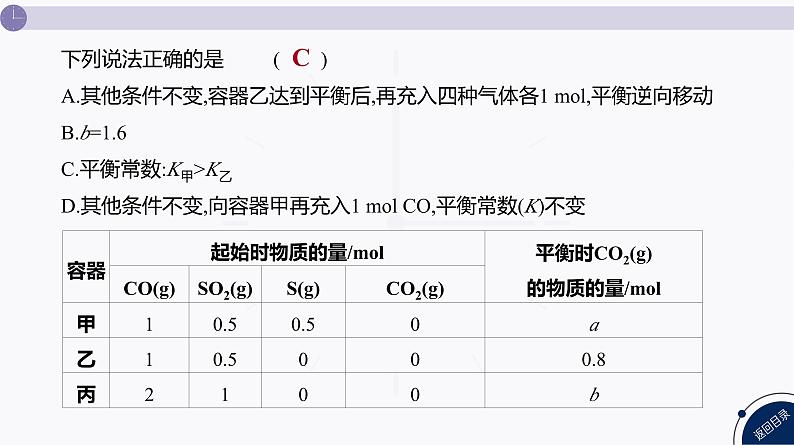
下列说法正确的是( )A.其他条件不变,容器乙达到平衡后,再充入四种气体各1 ml,平衡逆向移动B.b=1.6C.平衡常数:K甲>K乙D.其他条件不变,向容器甲再充入1 ml CO,平衡常数(K)不变
容器丙中加入的各物质的物质的量是乙的2倍,丙容器中生成物更多,温度更低,平衡逆向移动,b小于1.6,B项错误;由于是恒容绝热的密闭容器,该反应的正反应为吸热反应,甲容器多加了S(g),相对于乙容器来说,平衡逆向移动,所以甲容器温度比乙容器温度高,平衡常数K甲>K乙,C项正确;其他条件不变,向容器甲中再充入1 ml CO,平衡正向移动,温度发生变化,平衡常数发生改变,D项错误。
变式题 [2023·北京朝阳区一模] 向容积恒为1 L的密闭容器中充入一定量CH3OH(g),发生反应:2CH3OH(g) ⇌ CH3OCH3(g)+H2O(g) ΔH<0。下列说法不正确的是( )A.T1>T2B.T1 ℃,该反应的平衡常数K=4C.Ⅱ中存在:c(CH3OH)+2c(CH3OCH3)=0.2 ml·L-1D.T1 ℃时,向该容器中充入物质的量均为0.2 ml的3种气体,反应将逆向进行
探究点2 压强平衡常数的计算
1.Kp含义在化学平衡体系中,各气体物质的分压替代浓度,计算的平衡常数叫压强平衡常数,其单位与表达式有关。
例2 F.Daniels等曾利用测压法在刚性反应器中研究了25 ℃时N2O5(g)的分解反应:其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,N2O5(g)完全分解]:
已知:2N2O5(g) = 2N2O4(g)+O2(g) ΔH1=-4.4 kJ·ml-12NO2(g) ⇌ N2O4(g) ΔH2=-55.3 kJ·ml-125 ℃时N2O4(g) ⇌ 2NO2(g)反应的平衡常数Kp= kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
探究点一 浓度平衡常数的计算
1. 对于反应2SiHCl3(g) ⇌ SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是( )A.该反应的ΔH>0B.a、b处反应速率大小关系:va大于vbC.在343 K下,要提高SiHCl3的转化率,可以及时移去产物或增加反应物浓度D.343 K时,SiHCl3的平衡转化率为22%,可以求得该温度下的平衡常数约为0.02
[解析] 曲线a代表343 K时的反应,曲线b代表323 K时的反应,由图像知,温度越高,SiHCl3的平衡转化率越大,所以该反应的ΔH>0,A正确;a、b两点的转化率相等,可以认为各物质的浓度对应相等,而a点的温度更高,所以反应速率更快,即va>vb,B正确;及时移去产物,平衡正向移动,SiHCl3的转化率增大,增加反应物浓度,平衡正向移动,但SiHCl3 的转化率不变,C错误;
2. 将不同量的CO(g)和H2O(g)分别通入容积为2 L的恒容密闭容器中,发生反应CO(g)+H2O(g) ⇌ CO2(g)+H2(g),得到如下三组数据:
实验2和实验3中CO、H2O的起始量相等,实验3达到平衡所需时间比实验2短,则实验3的反应速率快,达到平衡时实验2和实验3中n(CO2)均为0.4 ml,而升高温度,平衡则会逆向移动,平衡时n(CO2)会减小,故改变的条件可能是使用了催化剂,不可能是改变温度,D错误。
[解析] H—Cl断裂表示正反应,而H—O断裂表示逆反应,根据方程式知当1 ml H—Cl断裂的同时有1 ml H—O断裂时,正、逆反应速率相等,则反应达到了平衡状态,A正确;由题干图像知,其他条件相同时升高温度,HCl的平衡转化率减小,即升高温度平衡逆向移动,说明正反应是放热反应,即该反应中反应物的总能量高于生成物的总能量,B正确;
当温度相同时,增大进料浓度比[c(HCl)∶c(O2)]的比值即增大HCl的浓度,O2的平衡转化率增大,而HCl的平衡转化率却减小,由图像信息可知,a、b、c三点中a点对应的O2平衡转化率最高,C正确;
4. 已知T1温度下在容积为10 L的密闭容器中发生可逆反应X(g)+Y(g) ⇌ 2Z(g)+2W(s) ΔH,起始时充入15 ml X与15 ml Y,10 min时反应达到平衡状态,测得平均速率v(Z)=0.12 ml·L-1·min-1。下列有关说法正确的是( )A.T1温度下该反应的平衡常数为2.56B.平衡时再充入一定量的X,平衡正向移动,X的转化率增大C.若T2>T1,T2时K=1.52,则该反应的ΔH>0D.若其他条件不变,T3温度下,K=1.96,则Y的平衡转化率约为41%
[解析] a点,NO2的转化率为40%,则a点反应三段式为 2C(s)+2NO2(g) ⇌ N2(g)+2CO2(g)起始/ml 1 0 0转化/ml 0.4 0.2 0.4a点/ml 0.6 0.2 0.4b点,NO的转化率为80%,则b点反应三段式为 2C(s)+2NO2(g) ⇌ N2(g)+2CO2(g)起始/ml 1 0 0转化/ml 0.8 0.4 0.8b点/ml 0.2 0.4 0.8
根据a点反应三段式、b点反应三段式和pV=nRT知,paV1=1.2RT,pbV2=1.4RT,由于V2>V1,故容器内的压强:pa∶pb>6∶7,A正确;相同时间内,b点比a点反应慢,但转化率达到80%,c点比a点反应更慢,转化率也是40%,说明a点为平衡点,c点为未平衡点,即图中c点所示条件下,v正>v逆,B错误;向a点平衡体系中充入一定量的NO2,相当于增大压强,平衡向左移动,达到平衡时,NO2的转化率比原平衡小,C错误;
探究点二 压强平衡常数的计算
[解析] 由题图知,m点时CO2还未达到平衡转化率,故反应正向进行,v正>v逆,A正确;过程Ⅰ较过程Ⅱ先达到平衡状态,说明反应速率快,则活化能:过程Ⅱ>过程Ⅰ,B正确;n点时CO2的平衡转化率为80%,列三段式: CO2(g)+3H2(g) ⇌ H2O(g)+CH3OH(g)起始/ml 1 2.8 0 0转化/ml 0.8 2.4 0.8 0.8平衡/ml 0.2 0.4 0.8 0.8
[解析] 该反应为气体分子总数减小的反应,故压强越大,平衡正向进行的程度越大,CH3OH(g)的平衡体积分数越高,即p1>p2,A正确;温度升高,CH3OH(g)的平衡体积分数减小,说明该反应为放热反应,ΔH<0,B错误;N点时对应该反应的平衡常数与M点相同,设起始H2、CO物质的量分别为2 ml、1 ml,列三段式: 2H2(g)+CO(g) ⇌ CH3OH(g)起始量/ml 2 1 0变化量/ml 2x x x平衡量/ml 2-2x 1-x x
10.[2023·河北保定一模] 我国力争在2060年实现碳中和,CO2的资源化对于实现碳中和具有重要意义。回答下列问题:CH4与CO2重整生成H2和CO的反应为CH4(g)+CO2(g) ⇌ 2H2(g)+2CO(g) ΔH=+247.6 kJ·ml-1(1)已知则表示CH4燃烧热的热化学方程式为 。
CH4(g)+2O2(g) = CO2(g)+2H2O(l) ΔH=-890.0 kJ·ml-1
(2)在恒温恒容装置中通入等体积CO2和CH4,发生上述反应,起始压强为p,CO2的平衡转化率为α,达平衡时,容器内总压强为 ,该反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
11.[2023·湖北武汉调研] 低碳烯烃是基础有机化工原料,工业上可利用合成气直接或间接制取。主要反应方程式如下。间接制取低碳烯烃:CO(g)+2H2(g) ⇌ CH3OH(l) ΔH1=-116 kJ·ml-12CH3OH(l) ⇌ C2H4(g)+2H2O(l) ΔH2=-35 kJ·ml-1直接制取低碳烯烃:2CO(g)+4H2(g) ⇌ C2H4(g)+2H2O(g) ΔH3回答下列问题:(1)已知H2O(g) = H2O(l) ΔH=-44 kJ·ml-1,则ΔH3= kJ·ml-1。
[解析] (1)已知 ①CO(g)+2H2(g) ⇌ CH3OH(l) ΔH1=-116 kJ·ml-1;②2CH3OH(l) ⇌ C2H4(g)+2H2O(l) ΔH2=-35 kJ·ml-1;③H2O(g) = H2O(l) ΔH=-44 kJ·ml-1,由盖斯定律知,2×①+②-2×③得:2CO(g)+4H2(g) ⇌ C2H4(g)+2H2O(g) ΔH3=2×(-116 kJ·ml-1)+ (-35 kJ·ml-1)-2×(-44 kJ·ml-1)=-179 kJ·ml-1。
(2)将N2、CO和H2以体积比为1∶1∶2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度、压强的关系如图所示,则p1 (填“>”“<”或“=”,下同)p2,M点的正反应速率 N点的逆反应速率。在500 K、压强为p1的条件下,该反应的Kp= (列出计算式)。
12.[2023·河北邯郸一模] 研究CO、CO2在一定条件下与H2催化合成CH4等有机化工产品,对实现“碳中和”目标具有重要的意义。在一定条件下CO(g)与H2(g)可发生如下反应:反应Ⅰ:CO(g)+3H2(g) ⇌ CH4(g)+H2O(g) ΔH1=-206.4 kJ·ml-1反应Ⅱ:CO2(g)+4H2(g) ⇌ CH4(g)+2H2O(g) ΔH2反应Ⅲ:CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ΔH3=+41.2 kJ·ml-1(1)100 kPa下,由最稳定的单质生成1 ml某纯物质的热效应为该物质的标准摩尔生成焓。部分物质的标准摩尔生成焓数据如表所示:
则x= ;ΔH2= kJ·ml-1。
[解析] (1)根据标准摩尔生成焓的定义及表格数据,ΔH1=[(-74.6+x)-(-110+0×3)] kJ·ml-1=-206.4 kJ·ml-1,解得x=-241.8;根据盖斯定律,Ⅱ=Ⅰ+Ⅲ,ΔH2=ΔH1+ΔH3=(-206.4+41.2) kJ·ml-1=-165.2 kJ·ml-1。
[解析] (2)①根据题图所示,T1 K时,反应Ⅰ和反应Ⅱ的lg Kp相等,反应Ⅲ=反应Ⅱ-反应Ⅰ,则lg Kp3=lg Kp2-lg Kp1,Kp3=1。②A、B两点都是平衡点,温度越高反应速率越大,A点温度高于B点,因此v正(A)>v逆(B)。
[解析] (3)①结合已知条件,可知反应相同时间,CO2初始分压越大,反应速率越快,α(CO2)越大,故p0-(a)>p0-(c)>p0-(b)。
p0-(a)>p0-(c)>p0-(b)
则在1 MPa时,表示CH4和CO的平衡体积分数随温度变化关系的曲线依次是 (填“a”“b”“c”或“d”,下同)和 ;在T ℃、一定压强下,反应在M点达到化学平衡,平衡时CH4的分压p(CH4)= MPa,反应Ⅲ的压强平衡常数Kp= 。
[解析] ②反应Ⅱ为放热反应,反应Ⅲ为吸热反应,根据已知条件知,a、b表示甲烷的平衡体积分数随温度的变化关系,c、d表示CO的平衡体积分数随温度的变化关系;反应Ⅱ的正向反应为气体分子数减小的反应,反应Ⅲ为反应前后气体分子数不变的反应,加压,反应Ⅱ的平衡正向移动,可推出在1 MPa时,表示CH4和CO的平衡体积分数随温度变化关系的曲线依次是b、c。设CO2和H2初始物质的量分别为1 ml和3 ml,生成的CH4和CO的物质的量均为x ml,列出三段式: CO2(g)+4H2(g) ⇌ CH4(g)+2H2O(g)起始量/ml 1 3 0 0变化量/ml x 4x x 2x平衡量/ml 1-2x 3-5x x 3x
2025版高考化学一轮总复习第7章化学反应速率和化学平衡第25讲化学平衡常数及转化率的计算课件: 这是一份2025版高考化学一轮总复习第7章化学反应速率和化学平衡第25讲化学平衡常数及转化率的计算课件,共60页。PPT课件主要包含了化学平衡,浓度幂之积,正反应,逆反应,K1·K2,-45,图2反应机理,p1p2p3,33%等内容,欢迎下载使用。
2025版高考化学一轮复习真题精练第七章化学反应速率与化学平衡第19练化学平衡常数转化率的相关计算课件: 这是一份2025版高考化学一轮复习真题精练第七章化学反应速率与化学平衡第19练化学平衡常数转化率的相关计算课件,共21页。PPT课件主要包含了新考法等内容,欢迎下载使用。
2024届高中化学一轮复习课件:平衡思想——化学平衡常数K、Kp的计算: 这是一份2024届高中化学一轮复习课件:平衡思想——化学平衡常数K、Kp的计算,共3页。PPT课件主要包含了信息解读,p1p2p3等内容,欢迎下载使用。












