





所属成套资源:2024--2025年高考化学一轮复习全套知识课件(新教材,新一轮)
课件 高考化学一轮复习第八单元 化学反应速率与化学平衡 第三十讲 化学平衡及影响因素
展开
这是一份课件 高考化学一轮复习第八单元 化学反应速率与化学平衡 第三十讲 化学平衡及影响因素,共60页。PPT课件主要包含了夯实必备知识,可逆反应,正反应,逆反应,化学平衡状态,逐渐减小,逐渐增大,保持不变,3化学平衡特点,正反应速率等内容,欢迎下载使用。
第30讲 化学平衡及影响因素
考点一 可逆反应与化学平衡状态考点二 化学平衡常数考点三 化学平衡移动考点四 等效平衡经典真题·明考向作业手册
夯实必备知识 | 提升关键能力
考点一 可逆反应与化学平衡状态
(1)概念:在一定条件下的 反应中,当正、逆反应速率 时,反应物和生成物的浓度均保持不变,即体系的组成不随时间而改变,表明该反应中物质的转化达到了“限度”,这时的状态称之为化学平衡状态。
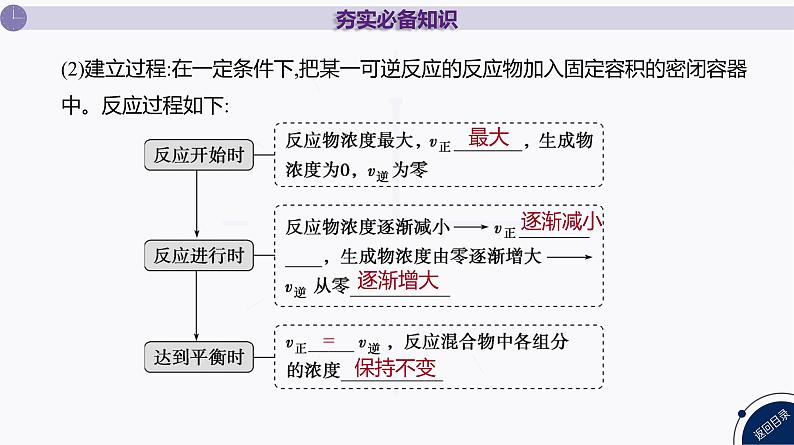
(2)建立过程:在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。反应过程如下:
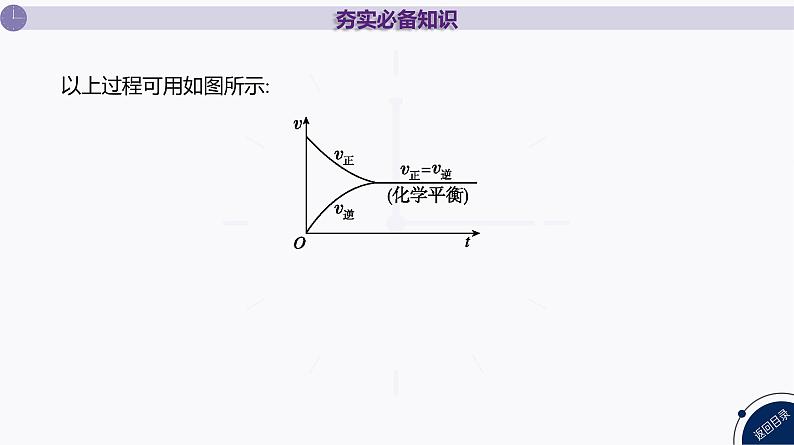
以上过程可用如图所示:
3. 判断化学平衡状态的两种方法
②静态标志(各种“量”不变)a.各物质的质量、物质的量或浓度不变。b.各物质的百分含量(物质的量分数、质量分数等)不变。c.温度(绝热容器)、压强(化学反应前后气体分子数不相等)或颜色(某组分有颜色)不变。总之,若物理量由变量变成了不变量,则表明该可逆反应达到平衡状态;若物理量恒为不变量,则不能作为平衡标志。
1.判断正误(正确的打“√”,错误的打“×”)(1)反应2NaHCO3 Na2CO3+CO2↑+H2O、Na2CO3+CO2+H2O = 2NaHCO3互为可逆反应( )(2)对反应A(g)+B(g) ⇌ C(g)+D(g),压强不随时间而变,说明反应已达到平衡状态( )
[解析] (2)反应A(g)+B(g) ⇌ C(g)+D(g)在反应前后气体的物质的量不变,故压强不随时间而变,错误。
[解析] (1)两反应条件不同,不属于可逆反应,错误。
(3)在一恒温恒容的密闭容器中充入2 ml SO2、1 ml O2,一定条件下发生反应,在相同的容器中充入2 ml SO3,在相同条件下发生反应,二者最终达到平衡时,各组分的百分含量对应相同( )(4)可逆反应都具有一定的限度,化学反应的限度可以通过改变反应条件而改变( )
[解析] (4)可逆反应的反应物不能都转化为生成物,所以具有一定的限度。一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度,条件改变平衡可能会发生移动,其限度会发生变化,正确。
[解析] (3)根据等效平衡的建立条件,二者属于恒温恒容等量投料,建立的平衡等效,正确。
(5)在恒温恒压条件下,对于反应A(g)+B(g) ⇌ 2C(g)+D(g),当密度保持不变时,反应达到化学平衡状态( )(6)由2SO2(g)+O2(g) ⇌ 2SO3(g) ΔH=-196.6 kJ·ml-1知,2 ml SO2与1 ml O2在恒压密闭容器中充分反应,可放出196.6 kJ的热量( )
[解析] (6)2 ml SO2与1 ml O2并不能完全反应,放出的热量小于196.6 kJ。
2.在一个温度恒定、容积固定的密闭容器中,发生可逆反应mA(s)+nB(g) ⇌ pC(g)+qD(g),已知m+n=p+q,且该反应为放热反应,反应达到平衡的标志是 。 ①体系的压强不再改变②气体的密度不再改变③各气体的浓度不再改变④各气体的质量分数不再改变⑤反应速率v(C)∶v(D)=p∶q⑥单位时间内n ml B断键反应,同时p ml C也断键反应
【易错警示】 规避化学平衡状态判断的两个易错点(1)化学平衡状态判断“三关注”①关注反应条件,是恒温恒容、恒温恒压,还是绝热恒容容器。②关注反应特点,是等气体分子数反应,还是非等气体分子数反应。③关注特殊情况,是否有固体参加或生成,或固体的分解反应。
(2)不能作为化学平衡状态“标志”的四种情况①反应组分的物质的量之比等于化学方程式中相应物质的化学计量数之比。②恒温恒容下的气体分子数不变的反应,体系的压强或总物质的量不再随时间而变化,如2HI(g) ⇌ H2(g)+I2(g)。③全是气体参加的气体分子数不变的反应,体系的平均相对分子质量不再随时间而变化,如2HI(g) ⇌ H2(g)+I2(g)。④全是气体参加的反应,恒容条件下体系的密度保持不变。
1.在一密闭容器中进行反应:2X(g)+Y(g) ⇌ 2Z(g)。已知反应过程中某一时刻X、Y、Z的浓度分别为0.3 ml·L-1、0.1 ml·L-1、0.4 ml·L-1,当反应达到平衡时,不可能存在的是( )A.c(X)=0.5 ml·L-1B.c(Y)+c(X)=0.5 ml·L-1C.c(Y)+c(Z)=1.05 ml·L-1D.c(X)+c(Y)+c(Z)=0.75 ml·L-1
[解析] 不确定下一时刻反应进行的方向,因此需要考虑反应进行的方向并结合极限思想解答。若该时刻后反应正向进行且Y全部转化为Z,则 2X(g)+Y(g) ⇌ 2Z(g)某时刻/(ml·L-1) 0.3 0.1 0.4转化/(ml·L-1) 0.2 0.1 0.2极限/(ml·L-1) 0.1 0 0.6若反应逆向进行,且Z全部转化为X和Y,则 2X(g)+Y(g) ⇌ 2Z(g)某时刻/(ml·L-1) 0.3 0.1 0.4转化/(ml·L-1) 0.4 0.2 0.4极限/(ml·L-1) 0.7 0.3 0
平衡时0.1 ml·L-1反应ⅡB.反应活化能:反应Ⅰ
相关课件
这是一份课件 高考化学一轮复习第八单元 化学反应速率与化学平衡 第二十九讲 化学反应速率及影响因素,共60页。PPT课件主要包含了使用建议,教学建议,考点一化学反应速率,夯实必备知识,表示方法,表达式及单位,化学计量数,m∶n∶p∶q,对点自测,提升关键能力等内容,欢迎下载使用。
这是一份高考化学一轮复习第8章化学反应速率与化学平衡第38讲化学反应速率及其影响因素课件,共43页。PPT课件主要包含了生成物浓度的增加,m∶n∶p∶q,Mg>Al,E1-E2等内容,欢迎下载使用。
这是一份2025届高考化学一轮总复习第8章化学反应速率与化学平衡第38讲化学反应速率及其影响因素课件,共42页。PPT课件主要包含了生成物浓度的增加,m∶n∶p∶q,Mg>Al,E1-E2等内容,欢迎下载使用。








