




所属成套资源:2024--2025年高考化学一轮复习全套知识课件(新教材,新一轮)
课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第38讲 沉淀溶解平衡
展开
这是一份课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第38讲 沉淀溶解平衡,共60页。PPT课件主要包含了夯实必备知识,沉淀溶解和沉淀生成,影响因素,本身的性质,溶解的方向,生成沉淀的方向,3方法,沉淀的溶解,沉淀的转化,溶解度小等内容,欢迎下载使用。
第38讲 沉淀溶解平衡
考点一 难溶电解质的沉淀溶解平衡及应用考点二 溶度积常数及其计算经典真题·明考向作业手册
夯实必备知识 | 提升关键能力
考点一 难溶电解质的沉淀溶解平衡及应用
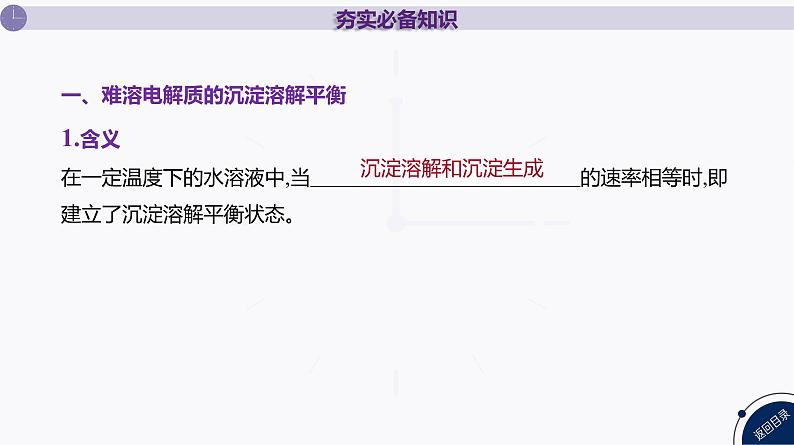
一、难溶电解质的沉淀溶解平衡1.含义在一定温度下的水溶液中,当 的速率相等时,即建立了沉淀溶解平衡状态。
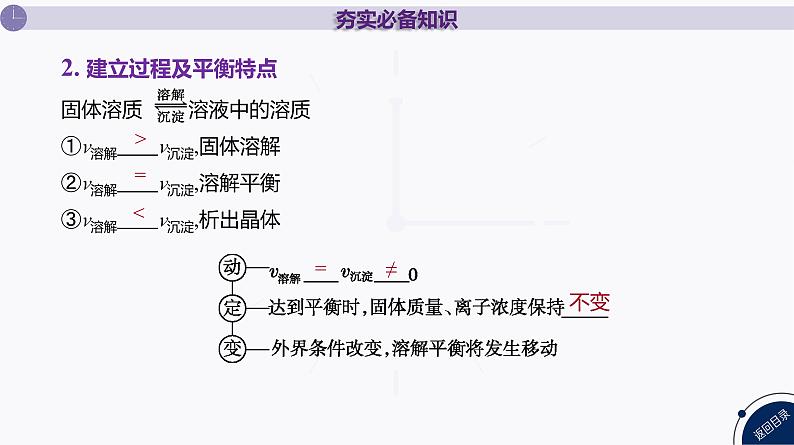
2. 建立过程及平衡特点
固体溶质 溶液中的溶质①v溶解 v沉淀,固体溶解 ②v溶解 v沉淀,溶解平衡 ③v溶解 v沉淀,析出晶体
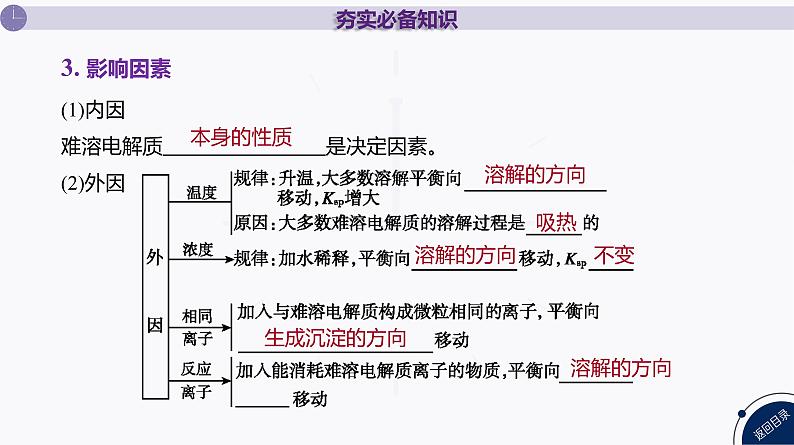
(1)内因难溶电解质 是决定因素。 (2)外因
二、难溶电解质的沉淀溶解平衡的应用1.沉淀的生成(1)原理:当Q>Ksp时,难溶电解质的溶解平衡向生成沉淀的方向移动。(2)应用:可利用生成沉淀达到除去溶液中杂质离子的目的。
Cu2++H2S = CuS↓+2H+
[微点拨2] 若一种沉淀剂可使溶液中多种离子产生沉淀时,则可控制条件,使这些离子先后分别沉淀。①对同一类型的沉淀,Ksp越小越先沉淀,且Ksp相差越大分步沉淀的效果越好。如在Cl-、Br-、I-的混合溶液中,由于AgCl、AgBr、AgI的Ksp相差较大,逐滴加入Ag+可按I-、Br-、Cl-的顺序先后沉淀,即Ksp最小的首先沉淀出来。②对不同类型的沉淀,其沉淀先后顺序要利用Ksp计算溶液中离子的浓度,根据离子浓度的大小判断沉淀的先后顺序,如AgCl和Ag2CrO4的分步沉淀,可通过控制Ag+的浓度来完成。
当沉淀溶解平衡体系中的离子发生反应时,其浓度会降低,沉淀溶解平衡就会向溶解的方向移动,从而使沉淀溶解。
AgCl+2NH3·H2O = [Ag(NH3)2]++Cl-+2H2O
[微点拨3] 用沉淀法除杂不可能将杂质离子全部生成沉淀除去,一般认为残留在溶液中的离子浓度小于1×10-5 ml·L-1时,已经沉淀完全。
(1)实质:沉淀溶解平衡的移动。(2)举例:MgCl2溶液 Mg(OH)2 Fe(OH)3,则Ksp[Mg(OH)2]>Ksp[Fe(OH)3]。(3)规律:一般说来, 的沉淀转化成 的沉淀容易实现。
Cu2+(aq)+PbS(s) ⇌ CuS(s)+Pb2+(aq)
(3)因溶解度小的沉淀易向溶解度更小的沉淀转化,故向ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀[Ksp(ZnS)>Ksp(CuS)]( )(4)升高温度,沉淀溶解平衡一定正向移动( )
[解析] (4)升高温度时Ca(OH)2的溶解度减小,沉淀溶解平衡不一定正向移动,错误。
[解析] (3)Ksp(ZnS)>Ksp(CuS),因溶解度小的沉淀易向溶解度更小的沉淀转化,故向ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀,正确。
(5)难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动( )(6)向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色沉淀:2AgCl+S2- = Ag2S+2Cl-( )
[解析] (6)向AgCl悬浊液中滴加Na2S溶液,AgCl溶解产生的Ag+与S2-生成更难溶的电解质,白色沉淀变成黑色沉淀,离子方程式为2AgCl+S2- = Ag2S+2Cl-,正确。
[解析] (5)难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡不移动,错误。
题组一 沉淀溶解平衡及其影响因素
1.溶液中存在平衡:Ca(OH)2(s) ⇌ Ca2+(aq)+2OH-(aq) ΔHKsp(AgI)( )(4)向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,生成黑色沉淀,Ksp(CuS) Ksp(YS) > Ksp (ZS),则直线①②③分别代表ZS、YS、XS,A错误;当pS=0时pX=14,即c(S2-)=1 ml·L-1,c(X2+)=10-14 ml·L-1,Ksp (XS) = c(X2+)·c(S2-)=1×10-14,B错误;
2. [2023·辽宁卷] 某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 ml·L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lg c关系如下图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为ml·L-1。已知Ksp(NiS)>Ksp(CdS),下列说法正确的是( )A.Ksp(CdS)=10-18.4B.③为pH与-lg c(HS-)的关系曲线C.Ka1(H2S)=10-(H2S)=10-14.7
由点(1.6,6.5)和点(4.2,3.9)可知④代表HS-,则③代表S2-;随pH增大,Ni2+和Cd2+的浓度逐渐减小,则-lg c(Ni2+)和-lg (Cd2+)随着pH增大而增大,由Ksp(NiS)>Ksp(CdS)可知,当c(S2-)相同时,c(Ni2+)>c(Cd2+),则-lg c(Ni2+)c([Ag(NH3)]+)>c(Ag+)
[解析] AgCl饱和溶液中,c(Ag+)=c(Cl-),向其中滴加氨水,c(Ag+)减小,c(Cl-)增大,且c([Ag(NH3)]+)增大,再继续滴加氨水,c([Ag(NH3)2]+)增大幅度大于 c([Ag(NH3)]+)增大幅度,最终以[Ag(NH3)2]+、Cl-为主,则曲线Ⅰ、Ⅱ、Ⅲ、Ⅳ分别代表[Ag(NH3)2]+、[Ag(NH3)]+、Ag+、Cl-。随NH3浓度增大,AgCl溶解度增大,则代表Cl-的曲线Ⅳ可视为AgCl溶解度随NH3浓度变化曲线,而非曲线Ⅰ,故A项错误;
由分析可知,曲线①代表含硫酸锶(s)的0.1 ml·L-1硫酸钠溶液的变化曲线,则硫酸锶的溶度积Ksp(SrSO4)=10-5.5×0.1=10-6.5,温度不变,溶度积不变,则含硫酸锶的1.0 ml·L-1硫酸钠溶液中,锶离子的浓度为10-6.5 ml·L-1,则a为-6.5,故B正确;由分析可知,曲线④表示含碳酸锶(s)的1.0 ml·L-1碳酸钠溶液的变化曲线,故C正确;由图可知,曲线②和④相交于一点,此时pH=6.9,则含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 ml·L-1的混合溶液,pH≥6.9时才发生沉淀转化,故D错误。
[解析] 由于Ksp[Zn(OH)2]
相关课件
这是一份课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第37讲 粒子浓度的大小比较,共60页。PPT课件主要包含了夯实必备知识,cH+,cCl-,cOH-,③①②,元素守恒规律,质子守恒规律,对点自测,提升关键能力,经典真题·明考向等内容,欢迎下载使用。
这是一份课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第36讲 盐类的水解,共60页。PPT课件主要包含了考点一盐类的水解,夯实必备知识,盐类的水解,弱电解质,弱酸根阴离子,弱碱阳离子,OH-,电离平衡,酸碱中和,第一步等内容,欢迎下载使用。
这是一份课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第35讲 酸碱中和滴定及拓展应用,共60页。PPT课件主要包含了夯实必备知识,实验原理,滴定终点,实验用品,⑥使用注意事项,⑦使用方法,是否漏水,3mL,“0”刻度,粉红色等内容,欢迎下载使用。









