





- 1.2.2 反应热的计算(第1课时 反应热的计算)2024-2025学年高二化学同步课件精讲(人教版2019选择性必修1) 课件 0 次下载
- 2.1.1 化学反应速率(第1课时 化学反应速率)(课件精讲)2024-2025学年高二化学同步课件精讲(人教版2019选择性必修1) 课件 0 次下载
- 2.1.3 化学反应速率(第3课时 活化能)(课件精讲)2024-2025 学年高二化学同步课件精讲(人教版2019选择性必修1) 课件 0 次下载
- 2.2.1 化学平衡(第1课时 化学平衡状态)(课件精讲)2024-2025学年高二化学同步课件精讲(人教版2019选择性必修1) 课件 0 次下载
- 2.2.2 化学平衡(第2课时 化学平衡常数)(课件精讲)2024-2025学年高二化学同步课件精讲(人教版2019选择性必修1) 课件 0 次下载
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率精品ppt课件
展开学习目标 CONTENT
不同的化学反应会有不同的反应速率
反应物本身性质(内因)
( 反应物组成、结构和性质等 )
同一化学反应的速率,受到外界因素的影响
上个学期,我们有浅学过影响化学反应速率的因素,大家还记得吗?
影响化学反应速率的因素
浓度、压强、温度、催化剂、固体表面积 等
反应物的化学性质越活泼,ν 越快
反应物本身的性质(主)
如何定性与定量研究影响化学反应速率的因素呢?
这些因素如何影响 ν ?如何测定 ν ?
1. 浓度 对 ν 的影响
Na2S2O3+H2SO4 = Na2SO4+SO2 ↑+S↓+H2O
2mL0.1 ml/L Na2S2O3溶液 ① + 2mL 0.1 ml/L H2SO4溶液
② +2mL 0.5 ml/L H2SO4溶液
增大反应物浓度,加快 ν ;
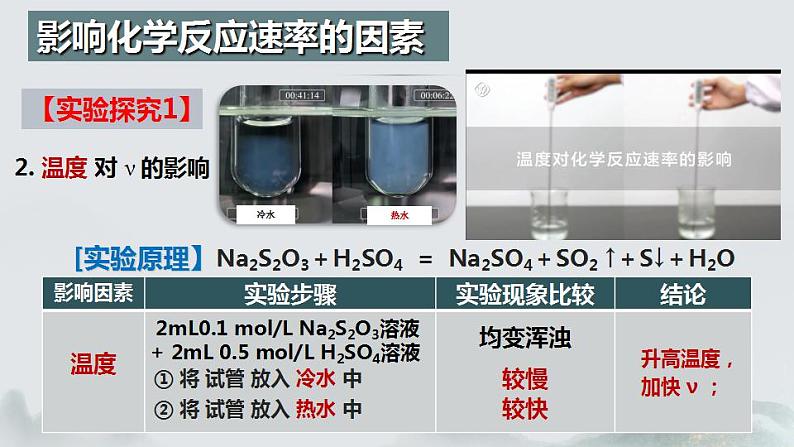
2. 温度 对 ν 的影响
2mL0.1 ml/L Na2S2O3溶液 + 2mL 0.5 ml/L H2SO4溶液
① 将 试管 放入 冷水 中
② 将 试管 放入 热水 中
升高温度,加快 ν ;
3. 催化剂 对 ν 的影响
2H2O2 = 2H2O + O2 ↑
2 mL 5% H2O2溶液
① + 1mL 的 1 ml/L FeCl3溶液
② + 0mL 的 1 ml/L FeCl3溶液
其他条件相同时,催化剂可改变化学反应速率
1、锥形瓶内放入2g锌粒,通过分液漏斗加入40 mL 1 ml/L的稀硫酸,测量并记录收集10 mL H2所用的时间。
2、用4 ml/L的稀硫酸代替1 ml/L的稀硫酸重复上述实验。
其他条件相同时,反应物浓度大,化学反应速率快
思考:压强对化学反应速率的影响?
恒容时,向反应2SO2+O2 2SO3充入N2气,化学反应速率如何变化?恒压时,向反应2SO2+O2 2SO3充入N2,化学反应速率如何变化?
他条件相同时,增大反应物浓度反应速率增大;减小减小。
1. 此规律只适用于有气体参加或在溶液中进行的反应,对于固体或纯液体反应物,一般情况下其浓度视为常数,因此改变它们的量不会改变化学反应速率。2. 气体或溶液浓度的改变与反应速率的关系并不是一概如此,若随着浓度的改变,物质的本质发生了变化,那么反应速率的含义也不同了。
对于有气体参加的反应来说,增大压强,化学反应速率加快。 减小压强,化学反应速率减慢。
对于气体有下列几种情况:
⑴恒温时:增大压强→体积减小→C增大→反应速率增大
⑵恒温时,恒容密闭容器中:
⑶恒压时:充入“无关气体”(如He)→引起体积增大,→各反应物浓度减小→反应速率减慢。
①充入气体反应物→反应物浓度增大→总压增大→反应速率增大;
②充入“无关气体”(如He)→引起总压增大,但各反应物的分压不变,各物质的浓度不变→反应速率不变
N2 + 3H2 2NH3
其他条件相同时,增大反应物浓度反应速率增大;减小减小。
其他条件相同时,对于有气体参加的反应来说,增大压强,化学反应速率加快。 减小压强,化学反应速率减慢。
其他条件相同时,升高温度反应速率增大,降低温度反应速率减小。
2. 温度对反应速率的影响,无论固体、液体、气体都适用。
一般,温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
1. 温度对化学反应速率的影响对放热反应和吸热反应都适用。
其他条件相同时,催化剂通常可以加快化学反应速率。
增大反应物的浓度,加快 ν ;
有气体参加的反应:增大压强(减小容器容积), ν 加快
增大反应物的表面积(即粉碎), ν 加快
形成原电池,通常能 加快 ν
温度每升高10℃,反应速率通常增加2 ~ 4倍
一般:温度对 ν 的影响比浓度、压强对 ν 的影响要大
1、在下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是( )①升高温度 ②使用催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末 ⑤增大压强A.①②③⑤B.①②④⑤C.①②④D.①②③④
3、下列各组反应(表中物质均为反应物)刚开始时,放出H2速率最快的是( )
4、(2021·天水市田家炳中学高二月考)将一块质量为5.0 g的铝片投入盛有500 mL 0.5 ml·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图所示的曲线来表示,回答下列问题:(1)曲线O→a段不产生氢气的原因是_______。(2)曲线a→b段产生氢气的速率较慢的原因是_______。(3)曲线b→c段产生氢气的速率增加较快的主要原因是反应放出的热量使溶液的温度升高而加快反应速率。曲线c点以后产生氢气的速率逐渐下降的主要原因是_______。
【答案】铝片表面有Al2O3,硫酸首先与Al2O3反应 氧化膜未完全反应掉,铝与硫酸接触的表面积较小 随着反应的进行,硫酸溶液的浓度下降
5.在带有活塞的密闭容器中发生如下反应:3Fe(s)+4H2O(g) = Fe3O4(s)+4H2(g),分析改变下列条件化学反应速率如何改变(填“变大”“变小”或“不变”),阐述理由。(1)增加铁片的质量(不考虑表面积的变化)_____,理由_____________________。(2)保持容器的体积不变,增加水蒸气的通入量_____,理由________________________________。(3)保持容器内压强不变,充入一定量的氩气_____,理由_____________________________________________________________________________。(4)保持容器的容积不变,充入一定量的氩气_____,理由_____________________________________________________________________________。
纯固体的浓度视为常数,改变用量不影响化学反应速率
入氩气,容器体积增大,水蒸气的浓度变小,因而化学反应速率变小
充入氩气,反应物和生成物的浓度均不改变,因而化学反应速率不变
6、教材采用图1实验装置测定锌与稀硫酸反应的速率。
(1)分别取2g颗粒大小相同的锌粒分别与体积均为40mL的1ml/L硫酸、4ml/L硫酸反应,收集25mLH2时所需时间后者比前者_____。(2)同学们在实验操作中发现,本实验设计存在明显不足,例如(举两例)_______________________________________________________________。
分液漏斗中溶液滴下占据体积引起气体体积读数误差(或收集25mLH2时所需时间间隔太短)
(3)某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有: a在多孔塑料袋中装入锌粒;b.在锥形瓶中加入40mL1ml/L硫酸; c塞好橡胶塞,_______________________时立即用秒表计时;d.注射器内每增加5mL气体时读取一次秒表。(4)实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是_____________________________,反应进行一定时间后速率逐渐减慢,原因是__________________________。⑸测得产生H2的体积与反应时间的关系曲线如图,t1~t2时间段氢气体积略有减小的原因是__________________ ;在64s内用H+浓度表示的平均反应速率v(H+)= ___________________(此时,溶液体积仍为40mL,气体摩尔体积为25L/ml)。
反应放热,温度升高反应速率加快
0.001 25 ml·L-1·s-1
高中化学人教版 (2019)选择性必修1第一节 化学反应速率一等奖ppt课件: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002419_t3/?tag_id=26" target="_blank">第一节 化学反应速率一等奖ppt课件</a>,共28页。PPT课件主要包含了活化能的概念,碰撞理论,活化能,简单的碰撞理论,基元反应,②2I·→I2,自由基,每一步反应,互相接触发生碰撞,没足够的能量等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 化学反应速率优质课件ppt: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002419_t3/?tag_id=26" target="_blank">第一节 化学反应速率优质课件ppt</a>,共27页。PPT课件主要包含了化学反应速率概念,“三段式”计算,化学反应速率的测定,新课导入,平均速率,化学反应速率,浓度的变化量,H2O,反应速率之比,vN2等内容,欢迎下载使用。
化学选择性必修1第二节 反应热的计算完美版课件ppt: 这是一份化学选择性必修1<a href="/hx/tb_c4002416_t3/?tag_id=26" target="_blank">第二节 反应热的计算完美版课件ppt</a>,共27页。PPT课件主要包含了盖斯定律的意义,盖斯定律的应用,典例分析,盖斯定律,反应热研究简史,反应热,途径角度理解盖斯定律,h300m,ΔH2−ΔH1,CO2g等内容,欢迎下载使用。













