





第八章 第36讲 化学平衡状态及平衡移动-2025年高考化学一轮总复习课件
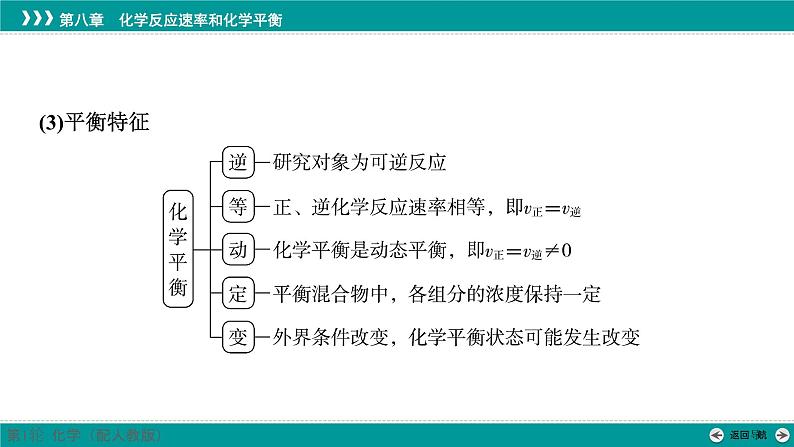
展开2.化学平衡状态(1)概念一定条件下的可逆反应中,当正反应速率与逆反应速率_______时,反应物和生成物的浓度均保持_______,即体系的组成不随时间而改变的状态。
(2)建立过程相同条件下,无论可逆反应从正向开始,还是从逆向开始,均可建立相同的平衡状态:
3.判断化学平衡状态的方法(1)动态标志:v(正)=v(逆)≠0①同种物质:同一物质的生成速率_______消耗速率。②不同物质:必须标明是“异向”的反应速率关系,且速率之比等于其化学计量数之比。例如,aA(g)+bB(g)⥫⥬cC(g)+dD(g),若v正(A)∶v逆(B)=_______时,该反应达到平衡状态。
(2)静态标志:各种“物理量”不变,如质量、物质的量(或浓度)、百分含量(物质的量分数、质量分数等)等。总之,若物理量由变量变成不变量,则表明该可逆反应达到平衡状态;若物理量为“不变量”,则不能作为平衡标志。
考向一 可逆反应的理解及应用 [例1] 在密闭容器中进行反应:X2(g)+Y2(g)⥫⥬2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 ml/L、0.3 ml/L、0.2 ml/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )A.Z为0.3 ml/L B.Y2为0.4 ml/LC.X2为0.2 ml/L D.Z为0.4 ml/L
利用“极端转化法”确定各物质的最大浓度和最小浓度范围:①假设反应正向进行到底,此时c(X2)=0,c(Y2)=0.2 ml/L,c(Z)=0.4 ml/L;②假设反应逆向进行到底,此时c(Z)=0,c(X2)=0.2 ml/L,c(Y2)=0.4 ml/L,从而推知c(X2)介于0~0.2 ml/L之间,c(Y2)介于0.2~0.4 ml/L之间,c(Z)介于0~0.4 ml/L之间,不包括两个极值点,A正确。
[练1] (2024·河南项城五校联考)在一密闭容器中进行反应:2X(g)+Y(g)⥫⥬2Z(g)。已知反应过程中某一时刻X、Y、Z的浓度分别为0.3 ml/L、0.1 ml/L、0.4 ml/L,当反应达到平衡时,可能存在的是( )A.c(Z)=0.7 ml/LB.c(Y)+c(X)=1.0 ml/LC.c(Y)+c(Z)=1.05 ml/LD.c(X)+c(Y)+c(Z)=0.75 ml/L
利用“极端转化法”进行分析,确定Z的浓度范围,c(Z)介于0~0.6 ml/L之间,A错误;反应逆向进行到底,c(X)、c(Y)达最大值,分别为0.7 ml/L、0.3 ml/L,由于反应不能逆向进行到底,故c(X)+c(Y)<1.0 ml/L,B错误;同理,0.3 ml/L
[练2] (2024·北京清华附中统考)甲烷消除NO2污染的原理为CH4(g)+2NO2(g)⥫⥬N2(g)+CO2(g)+2H2O(g)。在一定温度下,向恒容密闭容器中充入一定量的CH4和NO2进行上述反应。下列表述能用来判断该反应达到化学平衡状态的是( )A.v正(CH4)=2v逆(NO2)B.容器中混合气体的平均密度不再变化C.容器中混合气体总压强不再发生变化D.单位时间内,消耗1 ml CH4同时生成1 ml CO2
v正(CH4)、v逆(NO2)分别代表正、逆反应速率,达到平衡时2v正(CH4)=v逆(NO2),A错误; 容器容积不变,混合气体总质量不变,则密度始终不变,则当容器中混合气体的平均密度不再变化,不能判断该反应达到化学平衡状态,B错误;容器容积不变,随反应进行,气体物质的量逐渐增大,压强会增大,则压强是一个变化的量,则当容器中混合气体总压强不再发生变化,能判断该反应达到化学平衡状态,C正确;无论反应是否达到平衡,单位时间内,消耗1 ml CH4,同时生成1 ml CO2,故不能判断该反应达到化学平衡状态,D错误。
1.化学平衡的移动(1)在一定条件下,当可逆反应达到平衡状态后,若反应条件(如温度、浓度、压强等)发生变化,平衡混合物中各组分的浓度也会随之改变,从而在一段时间后达到新的平衡状态,这种由___________状态达到_________状态的过程,叫做化学平衡的移动。
(2)化学平衡移动的过程
[微点拨1]①化学反应条件改变,使正、逆反应速率不再相等,化学平衡才会发生移动。②化学平衡发生移动,化学反应速率一定改变。
2.判断化学平衡移动的方向(1)根据正、逆反应速率判断
(2)根据浓度商(Q)和平衡常数(K)判断
[微点拨2]温度一定时,化学平衡常数(K)是定值,浓度商(Q)是变量,平衡发生移动,Q发生变化,最终达到Q=K的平衡状态。
3.影响化学平衡的外界因素其他条件保持不变,改变温度、浓度、压强等因素,对化学平衡的影响如下表所示:
5.勒夏特列原理(化学平衡移动原理)如果改变影响化学平衡的条件之一(如温度、压强以及参加反应的化学物质的浓度),平衡将向着能够_______这种影响的方向移动。
考向一 化学平衡移动的方向及结果分析[例1] (2022·海南卷)某温度下,反应CH2===CH2(g)+H2O(g)⥫⥬CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是( )A.增大压强,v正>v逆,平衡常数增大B.加入催化剂,平衡时CH3CH2OH(g)的浓度增大C.恒容下,充入一定量的H2O(g),平衡向正反应方向移动D.恒容下,充入一定量的CH2===CH2(g),CH2===CH2(g)的平衡转化率增大
增大压强,平衡正向移动,则有v正>v逆,由于温度不变,则平衡常数不变,A错误;加入催化剂,平衡不移动,CH3CH2OH(g)的浓度不变,B错误;恒容下,充入一定量的H2O(g),反应物的浓度增大,平衡向正反应方向移动,C正确;恒容下,充入一定量的CH2===CH2(g),平衡正向移动,H2O(g)的平衡转化率增大,但CH2===CH2(g)的平衡转化率反而减小,D错误。
分析化学平衡移动及结果的思维流程
a.温度越高,反应速率越大b.α=0.88的曲线代表平衡转化率c.α越大,反应速率最大值对应温度越低d.可根据不同α下的最大速率,选择最佳生产温度答案:cd
该反应为放热反应。从图像看,随着温度升高,反应速率先增大后减小,a错误;随着温度升高,反应的转化率应逐渐减小,图像中曲线为不同温度下的等转化率下的反应速率曲线,b错误;由题图可知,转化率越高对应的反应速率最高的温度越低,c正确;结合图像的转化率与速率最高的温度可选取最佳生产温度,d正确。
平衡移动方向与转化率的关系以反应aA(g)+bB(g)⥫⥬cC(g)+dD(g)为例进行分析:
(3)若按原起始投料比同倍数增加(或减小)A、B的浓度,等效于压缩(或扩大)容器体积,气体反应物的转化率与化学计量数有关:
[练2] (2024·山东聊城期初统考)在容积固定的密闭容器中,发生反应N2(g)+3H2(g)⥫⥬2NH3(g) ΔH<0,改变条件,下列说法正确的是( )A.增大压强,平衡正向移动,平衡常数增大B.将部分NH3分离出来,氮气转化率和v(正)均增大C.增加氮气的物质的量,平衡正向移动,氮气的转化率降低D.使用高效催化剂,可以提高氢气的平衡转化率
平衡常数只与温度有关,改变压强,温度不变,K不变,A错误;将部分NH3分离出来,平衡正向移动,但反应物浓度也减小,v(正)相应也减小,B错误;增加氮气的物质的量,平衡正向移动,但氮气的转化率降低,C正确;催化剂只能增大反应速率,不能提高平衡转化率,D错误。
1.(2024·湖北省名校联盟联考)对于可逆反应2NO2(g)⥫⥬N2O4(g),下列说法错误的是( )A.当2v正(N2O4)=v逆(NO2)时,该反应达到平衡状态B.该反应在一定条件下能自发进行,则ΔH<0C.恒温恒容条件下,若混合气体的颜色保持不变,则该反应达到平衡状态D.恒温恒容条件下,达平衡状态后,再充入一定量的NO2,NO2转化率将减小
v正(N2O4)代表正反应速率,v逆(NO2)代表逆反应速率,当2v正(N2O4)=v逆(NO2)时,正、逆反应速率之比等于其化学计量数之比,该反应达到平衡状态,A正确;该反应的ΔS<0,在一定条件下能自发进行,应满足ΔH-TΔS<0,推知ΔH<0,B正确;恒温恒容条件下,若混合气体的颜色保持不变,说明c(NO2)不变,则该反应达到平衡状态,C正确;恒温恒容条件下,达平衡状态后,再充入一定量的NO2,相当于增大压强,而增大压强,平衡正向移动,NO2的转化率增大,D错误。
2.可逆反应:2NO2(g)⥫⥬2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )①单位时间内生成n ml O2的同时生成2n ml NO2②单位时间内生成n ml O2的同时,生成2n ml NO③NO2、NO、O2的物质的量浓度均保持不变④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的平均相对分子质量不再改变的状态A.①③④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
单位时间内生成n ml O2,必然消耗2n ml NO2,若同时生成2n ml NO2,则达到平衡状态,①正确;O2和NO都是生成物,单位时间内生成n ml O2,必然生成2n ml NO,不能判断反应是否达到平衡状态,②错误;达到平衡时,各物质的浓度均不变,③正确;只有NO2是红棕色气体,混合气体的颜色不变,说明c(NO2)不变,达到平衡状态,④正确;各物质均是气体,密闭容器中混合气体的密度始终不变,⑤错误;混合气体的总质量不变,若平均相对分子质量不再改变,则气体总物质的量不变,达到平衡状态,⑥正确。
3.(2024·辽宁沈阳二中月考)某温度下,在恒容密闭容器中加入一定量X,发生反应2X(s)⥫⥬Y (s)+Z(g),一段时间后达到平衡。下列说法错误的是( )A.升高温度,若c(Z)增大,则ΔH>0B.加入一定量Z,达新平衡后m(Y)减小C.加入等物质的量的Y和Z,达新平衡后c(Z)增大D.加入一定量氩气,平衡不移动
升高温度,若c(Z)增大,说明升高温度,平衡正向移动,则正反应为吸热反应,即ΔH>0,A正确;加入一定量Z,生成物浓度增大,平衡逆向移动,则m(Y)减小,B正确;达到新平衡时,加入等物质的量的Y和Z,由于K=c(Z)不变,故达新平衡后c(Z)不变,C错误;体积不变,加入一定量氩气,Z的浓度不变,则平衡不移动,D正确。
5.(2023·北京卷)下列事实能用平衡移动原理解释的是( )A.H2O2溶液中加入少量MnO2固体,促进H2O2分解B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深C.铁钉放入浓硝酸中,待不再变化后,加热能产生大量红棕色气体D.锌片与稀硫酸反应过程中,加入少量CuSO4固体,促进H2的产生
MnO2会催化 H2O2分解,与平衡移动无关,A错误; NO2转化为N2O4的反应是放热反应,升温平衡逆向移动, NO2浓度增大,混合气体颜色加深,B正确;常温下铁在浓硝酸中钝化,加热会使表面的氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体,与平衡移动无关,C错误;加入硫酸铜以后,锌置换出铜,构成原电池,从而使反应速率增大,与平衡移动无关,D错误。
A.x1
第28讲 化学平衡状态 化学平衡的移动 课件—2025届高考化学大一轮复习: 这是一份第28讲 化学平衡状态 化学平衡的移动 课件—2025届高考化学大一轮复习,共60页。PPT课件主要包含了必备知识·强基固本,关键能力·核心突破,素养评价·真题演练,知识梳理,自主评价等内容,欢迎下载使用。
2025届高考化学一轮总复习第8章化学反应速率与化学平衡第39讲化学平衡状态化学平衡的移动课件: 这是一份2025届高考化学一轮总复习第8章化学反应速率与化学平衡第39讲化学平衡状态化学平衡的移动课件,共36页。PPT课件主要包含了正反应,逆反应,逐渐减小,逐渐增大,保持不变,3特征,浓度或百分含量等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习第7章化学反应速率与化学平衡第35讲化学平衡状态及平衡移动课件: 这是一份备战2025届新高考化学一轮总复习第7章化学反应速率与化学平衡第35讲化学平衡状态及平衡移动课件,共43页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,可逆反应,正反应,逆反应,3特点,浓度或百分含量,关键能力•提升等内容,欢迎下载使用。












