










所属成套资源:沪科版化学选择性必修一课件+练习+素材
化学选择性必修1第1章 化学反应的热效应1.3燃料的合理利用试讲课课件ppt
展开
这是一份化学选择性必修1第1章 化学反应的热效应1.3燃料的合理利用试讲课课件ppt,文件包含13燃料的合理利用同步课件pptx、13燃料的合理利用分层练习-原卷版docx、13燃料的合理利用分层练习-解析版docx等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
1.知道物质的燃烧热,了解提高燃料利用率的常见途径2.分析能源的利用对自然环境和社会发展的影响
考虑标准燃烧热或热值大小
考虑燃料的稳定性、来源、价格、运输、对环境的影响、使用的安全性等多方面的因素
在101kPa下,1 ml物质完全燃烧生成稳定产物时所放出的热量叫做该物质的燃烧焓,习惯上又称为该物质的燃烧热。
是指物质中含有的N转化为N2(g),H转化为H2O(l),C转化为CO2(g)。
CO(g) + O2(g) CO2(g) ∆H=−283 kJ/ml
2CO(g) + O2(g) 2CO2(g) ∆H=−566 kJ/ml
标准燃烧热是反应热的一种
单位为kJ·ml-1或kJ/ml
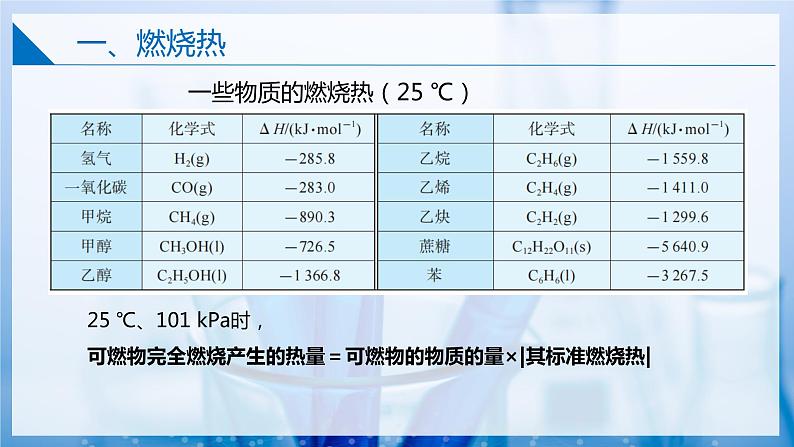
一些物质的燃烧热(25 ℃)
25 ℃、101 kPa时,可燃物完全燃烧产生的热量=可燃物的物质的量×|其标准燃烧热|
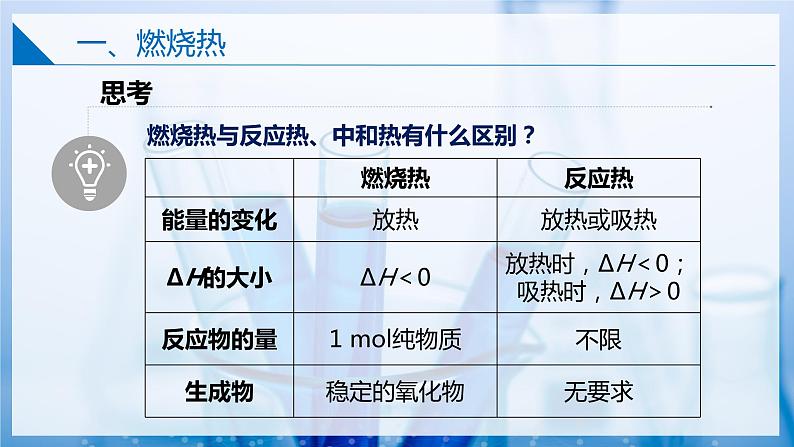
燃烧热与反应热、中和热有什么区别?
“表示燃烧热的热化学方程式”与“可燃物燃烧的热化学方程式”的书写相同吗?
不同。前者可燃物的化学计量数必须为1,后者不强调可燃物的物质的量,可为任意值。
在101 kPa下,1 ml H2(g) 与1 ml CO(g)完全燃烧放出的热,分别为285.8 kJ和283.0 kJ,两者非常接近。
单位质量产生热量: ≈ 13.2 kJ/g
237.5 kJ2 g+16 g
单位质量产生热量: ≈ 6.4 kJ/g
283 kJ28 g+16 g
H2(l) + O2(l) H2O(g) ∆H=−237.5 kJ/ml
CO(g) + O2(g) CO2 (g) ∆H=−283 kJ/ml
热值:100 kPa 时,单位质量或单位体积的燃料完全燃烧所放出的热量叫做该燃料的热值。
热值是燃料质量优劣的重要参数
例1、下列关于反应热的描述中不正确的是( )A.氢气的燃烧热为-285.8 kJ•ml-1,则水电解的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=571.6 kJ•ml-1B.CO(g)的燃烧热是-283.0 kJ•ml-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=2×283.0 kJ•ml-1C.反应热有正负之分,燃烧热ΔH全部是负值D.HCl和NaOH反应的中和热ΔH=-57.3 kJ•ml-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ•ml-1
目前世界各国消耗的能源大多来自化石燃料
二、燃料的充分燃烧和利用
实现可持续发展的基本途径
开发低碳环保的可再生资源
增加燃料跟空气的接触面积
固体燃料粉碎把液体燃料喷成雾状
空气也不是越多越好,因为通入过多的空气会带走一部分热能,造成能量损失。
例2、液态肼(N2H4)和液态双氧水可作为火箭推进剂的原料,它们混合时发生反应,生成N2和水蒸气,并放出大量的热。已知1 g液态肼完全反应生成气态水放出的热量为20 kJ。(1)H2O(l)===H2O(g) ΔH=44 kJ•ml-1,写出液态肼与液态双氧水反应生成N2和液态水的热化学方程式:____________________________________。
N2H4(l)+2H2O2(l)===N2(g)+4H2O(l)
ΔH=-816 kJ•ml-1
(2)以N2和H2为原料通过一定途径可制得N2H4,已知断裂1 ml N—N键、N≡N键、N—H键、H—H键所需的能量分别为193 kJ•ml-1、946 kJ•ml-1、390.8 kJ•ml-1、436 kJ•ml-1,试写出由N2、H2合成气态肼(N2H4)的热化学方程式为________________________________________________。
N2(g)+2H2(g)===N2H4(g) ΔH=61.8 kJ•ml-1
(3)温度在150 ℃以上时,H2O2便迅速分解为H2O和O2,发射火箭时用过氧化氢作强氧化剂就是利用这个原理,已知:①H2(g)+O2(g)===H2O2(l)ΔH1=-134.3 kJ•ml-1;②H2O(l)===H2(g)+ O2(g)ΔH2=286 kJ•ml-1。则反应③H2O2(l)===H2O(l)+ O2(g)的ΔH=______________。
-151.7 kJ•ml-1
燃料的充分燃烧热能的充分利用
计算填空:(1)在25 ℃、101 kPa时,一定量氢气在足量的氧气中完全燃烧生成3.6 g H2O(l)放出57.16 kJ的热量。H2的标准燃烧热为 ,该条件下氢气的热值为 kJ·g-1。(2) 在25 ℃、101 kPa时,CH4的热值为55.625 kJ·g-1,该条件下CH4的标准燃烧热为 。CH4气体112 L(标准状况下),完全燃烧生成CO2和液态水时放出的热量为 。
-285.8 kJ·ml-1
-890 kJ·ml-1
相关课件
这是一份沪科技版(2020)选择性必修11.1 化学反应与能量变化优质课ppt课件,文件包含11化学反应与能量变化同步课件pptx、11化学反应与能量变化分层练习原卷版docx、11化学反应与能量变化分层练习解析版docx等3份课件配套教学资源,其中PPT共26页, 欢迎下载使用。
这是一份高中化学沪科技版(2020)必修第一册氯气的性质优质课件ppt,文件包含212氯气的性质同步课件pptx、212氯气的性质分层练习原卷版docx、212氯气的性质分层练习解析版docx等3份课件配套教学资源,其中PPT共21页, 欢迎下载使用。
这是一份化学必修第一册分散系一等奖课件ppt,文件包含112分散系同步课件pptx、112分散系分层练习原卷版docx、112分散系分层练习解析版docx等3份课件配套教学资源,其中PPT共26页, 欢迎下载使用。










