





鲁科版选修4 化学反应原理第4节 离子反应教课内容课件ppt
展开溶液中离子之间,以及离子与原子或分子之间的反应。
使溶液中某种或某些离子浓度降低
Fe3+ + 3SCN- = Fe(SCN)3
Ag+ + 2NH3·H2O == [Ag(NH3)2]+ + 2H2O
AgCl + 2NH3·H2O == [Ag(NH3)2]+ + Cl— +2H2O
写成离子形式:强酸、强碱、(大多数)可溶盐
六大强酸:H2SO4 HCl HNO3 HBr HI HClO4四大强碱:KOH NaOH Ca(OH)2 Ba(OH)2盐的溶解性:钾钠铵盐硝酸盐,都能溶于水中间。 不溶的有氯化银、硫酸钡和硫酸铅。 其他阴离子的盐、可溶只有钾钠铵四大微溶物:Ca(OH)2 CaSO4 Ag2SO4 MgCO3
Ca(OH)2的特殊处理:澄清石灰水写离子符号Ca2++2OH—; 石灰乳写化学式Ca(OH)2(作难溶物对待)
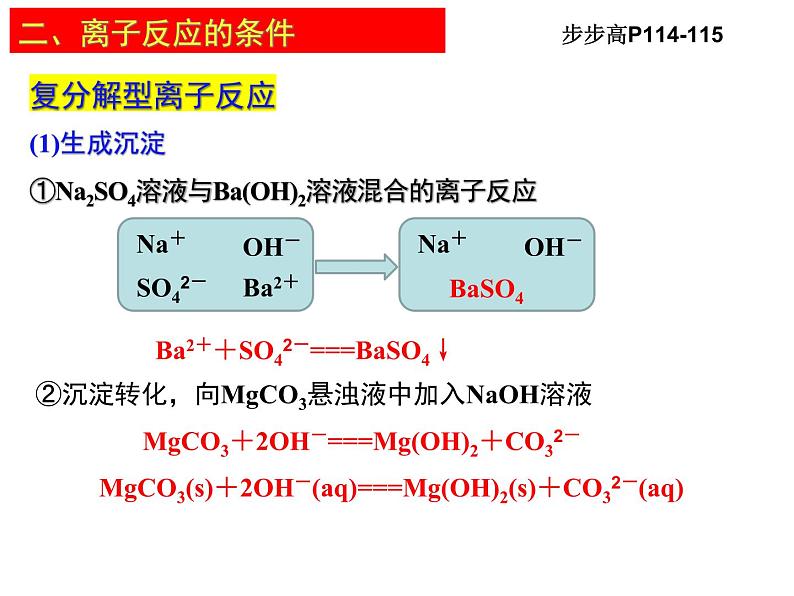
复分解型离子反应(1)生成沉淀①Na2SO4溶液与Ba(OH)2溶液混合的离子反应
②沉淀转化,向MgCO3悬浊液中加入NaOH溶液
步步高P114-115
Ba2++SO42-===BaSO4↓
MgCO3+2OH-===Mg(OH)2+CO32-
MgCO3(s)+2OH-(aq)===Mg(OH)2(s)+CO32-(aq)
(2)生成弱电解质①NaOH溶液与盐酸混合
②盐酸与CH3COONa溶液混合
③向NH4NO3稀溶液中加入NaOH溶液
(3)生成气体①Na2CO3溶液与稀硫酸混合
②NH4NO3溶液中加入NaOH浓溶液
H++OH-===H2O
H++CH3COO-===CH3COOH
NH4++OH-===NH3·H2O
CO32-+2H+===H2O+CO2↑
NH4++OH-===NH3↑+H2O
生成气体与生成弱电解质本质上是相同的,他们生成的也是弱电解质,只是某些弱电解质不稳定,进一步分解生成气体逸出。
(一)复分解反应型离子反应
生成气体(易挥发性物质)
生成弱电解质(水、弱酸、弱碱(强制弱))
3HCO3-+Al3+ ==Al(OH)3↓+3CO2↑
彻底双水解:互促,彻底
不彻底双水解:互促,微弱
(1)根据“强酸制弱酸”的反应原理, H2S通入CuSO4溶液不会发生反应Cu2++H2S===CuS↓+2H+( )(2)强酸与强碱中和反应的离子方程式都可表示为H++OH-===H2O( )(3)NaHCO3和NaHSO4两种溶液混合后,实际参加反应的离子是H+和CO32-( )(4)NH3遇氯化氢气体生成白烟(NH4Cl小颗粒),因为生成了离子化合物,所以是离子反应( )(5)任何一种离子的浓度在离子反应中一定变小( )
酸式盐的电离:弱酸的酸式盐 = Mn+ + 弱酸的酸式酸根离子硫酸的酸式酸 = Mn+ + H+ + SO42-
HCO3- + H+
CH3COOH+NH3·H2O==CH3COO-+NH4++H2O
特殊:弱酸制强酸 CuSO4+H2S===CuS↓+H2SO4 (CuS难溶于H2SO4)
Ba2++2OH- +2H++ SO42- = BaSO4↓+ 2H2O
一般:强酸制弱酸 FeS+H2SO4===FeSO4+H2S↑ (实验室制H2S)
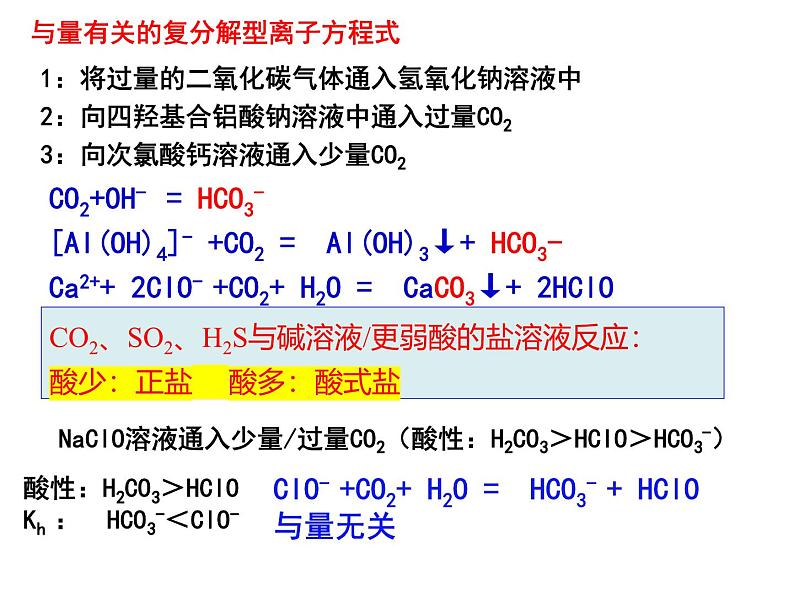
与量有关的复分解型离子方程式
CO2、SO2、H2S与碱溶液/更弱酸的盐溶液反应:酸少:正盐 酸多:酸式盐
1:将过量的二氧化碳气体通入氢氧化钠溶液中2:向四羟基合铝酸钠溶液中通入过量CO23:向次氯酸钙溶液通入少量CO2
CO2+OH- = HCO3-[Al(OH)4]- +CO2 = Al(OH)3↓+ HCO3-Ca2++ 2ClO- +CO2+ H2O = CaCO3↓+ 2HClO
NaClO溶液通入少量/过量CO2(酸性:H2CO3>HClO>HCO3-)
ClO- +CO2+ H2O = HCO3- + HClO与量无关
酸性:H2CO3>HClOKh : HCO3-<ClO-
4:氯化铝溶液中加入过量的氢氧化钠溶液5:Na[Al(OH)4]溶液与过量盐酸反应
Al3++4OH- = [Al(OH)4]-
[Al(OH)4]- + 4H+ = Al3+ + 4H2O
Al(OH)3是两性氢氧化物,溶于强酸强碱 不溶于碳酸、氨水
6:NH4HSO4溶液与过量稀NaOH溶液的反应
NH4+ + H+ + 2OH- = NH3·H2O + H2O
强者先行:①中和 ②沉淀 ③气体 ④沉淀溶解
例:向含有H+、Al3+、NH4+的溶液中,逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为
Al3++3OH-===Al(OH)3↓
Al(OH)4+OH- = [Al(OH)4]-
Ca2++ 2HCO3- + 2OH- = CaCO3↓+ 2H2O + CO32-
7:Ca(HCO3)2与足量的NaOH溶液相混合8:Ca(HCO3)2与少量的NaOH溶液相混合
OH- + HCO3- +Ca2+ = CaCO3↓+ H2O
少量为1(按角标比反应) 以少定多
分析实质:HCO3- + OH- = CO32-+ H2O CO32- + Ca2+ = CaCO3↓
9:向Ba(OH)2溶液滴加NaHSO4溶液至Ba2+沉淀完全
n[Ba(OH)2]∶n(NaHSO4)=1∶1
1 2 1 1
Ba2++ OH- + H++ SO42- = BaSO4↓+ H2O
例:下列离子方程式书写正确的是( ) A. 向碳酸氢铵溶液中加入过量氢氧化钠溶液: HCO3- + OH- === H2O + CO32- B. 少量CO2通入澄清石灰水中: CO2 + OH- === HCO3- C. 向碳酸氢钙溶液中滴加少量氢氧化钠溶液: HCO3- + OH- + Ca2+ === CaCO3↓+ H2O D. 向碳酸钠溶液中加入过量醋酸溶液: CO32- + 2H+ === H2O + CO2↑
(二)氧化还原反应型离子反应
1:非原电池、电解池的反应
2:原电池、电解池的反应
例1:硫酸亚铁溶液中加入酸性的高锰酸钾反应的离子方程式
Fe2+ + MnO4- + H+ = Fe3+ + Mn2+ + H2O
5
例2:惰性电极电解硫酸铜溶液的离子方程式
阴极:2Cu2+ + 4e- == 2Cu 阳极:4OH- - 4e- == O2↑+ 2H2O 2H2O - 4e- == O2↑+ 4H+
8 4
(2)在含等浓度Fe3+、Cu2+、H+的溶液中加入铁粉,反应的先后顺序如何?
氧化性:Fe3+>Cu2+>H+
(3)向FeBr2溶液中通入少量Cl2,哪种离子先被氧化?若改为FeI2呢?
还原性:I->Fe2+>Br-向FeBr2溶液中通入Cl2,首先被氧化的是Fe2+;向FeI2溶液中通入少量Cl2,首先被氧化的是I-。
Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
思考讨论:将少量的Cl2通入到过量的FeI2溶液中,发生反应 的离子方程式?若Cl2过量呢?
当氯气少量时: 2I- + Cl2 = I2 + 2Cl-
当氯气过量时: 2Fe2+ + 4I- + 3Cl2 = 2Fe3+ + 2I2 + 6Cl-
想一想:向FeBr2溶液中通入等物质的量的Cl2?
2Fe2+ + Cl2 + Cl2 + 2Br- = 2Fe3+ + Br2 + 4Cl-
与量有关的氧化还原型离子方程式
分析实质: 2I- + Cl2 = I2 + 2Cl- 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
1 : 2
2Fe2+ +2Cl2 + 2Br- = 2Fe3+ + Br2 + 4Cl-
还原性:I->Fe2+>Br-
三:离子方程式正误的判断
离子在溶液中不能共存:离子之间发生反应主要有哪些原因? (1)发生复分解反应 ①生成沉淀 ②生成弱电解质 ③生成气体 ④彻底双水解
(2)发生氧化还原反应 (3)发生络合反应 Fe3+ + SCN-
补:Al(OH)4— 和HCO3—不能大量共存:Al(OH)4— +HCO3— ==Al(OH)3 +H2O+CO32—
例:下列各组离子,溶液中能大量共存的是 A.Fe2+ NO3- SO42- H+ B.Fe3+ SCN- H+ Cl-C.Na+ Al3+ SO42- HCO3– D.NO3- [Al(OH)4]– K+ Na+
1.无色溶液常见的有色离子:Fe3+(黄)、 Fe2+(浅绿)、 Cu2+(蓝)、MnO4- (紫红)、 Cr2O72-(桔红)等2.酸性溶液、碱性溶液①使pH试纸变红色的溶液②由水电离出的c(H+)=1×10-12的溶液③加入铝能放出氢气的溶液
可以是强酸,也可以是强碱
可以是强酸(不含NO3-),也可以是强碱
2Al+ 6H+ = 2Al3+ + 3H22Al+ 2OH- + 6H2O = 2[Al(OH)4]- + 3H2
例:下列各组离子,在所给条件下能够大量共存的是 A.pH=0的溶液中,Fe3+、Mg2+、 SO42-、Cl- B.水电离出的[H+]=1×10-11的溶液中,K+、HCO3-、Cl-、S2- C.使pH试纸显深蓝色的溶液中,Cu2+、Fe3+、 NO3- 、 SO42- D.在AlCl3溶液中,[Al(OH)4]-、Na+、 NO3- 、 SO42-、
1、离子的检验2、测定溶液中离子的浓度3、物质的制备和纯化4、胃酸过多的治疗5、硬水的形成及软化
答题模板:取样→试剂→现象→结论
①CO32- SO32-
Ba2+ + SO32+ = BaSO3↓BaSO3+2H+ = SO2↑+H2O+Ba2+
CO32- 加入BaCl2或CaCl2溶液后生成白色沉淀,再加稀盐酸沉淀溶解,并放出无色无味的气体。
SO32- 加入BaCl2溶液,产生白色沉淀,再加稀盐酸,放出无色有刺激性气味,且能使品红溶液褪色的气体。
Ca2+ + CO32+ = CaCO3↓CaCO3+2H+ = CO2↑+H2O+Ca2+
★排除HCO3- HSO3- 干扰HCO3-+H+= CO2↑+H2O HSO3-+H+ = SO2↑+H2O 与BaCl2或CaCl2溶液不反应与H+
先加稀盐酸无现象,再加BaCl2溶液,产生白色沉淀。
★排除CO32- SO32- Ag+干扰CO32-+Ba2+= BaCO3↓ SO32-+Ba2+= BaSO3↓ Ag++ Cl-= AgCl↓
Ba2+ + SO42+ = BaSO4↓
SO32-被HNO3氧化为SO42-——避免NO3-
③Cl- Br- I-
法1:沉淀法 AgNO3溶液、稀HNO3
Ag++ Cl-= AgCl ↓
Ag++ Br-= AgBr ↓
Ag++ I-= AgI ↓
I-→滴入氯水和淀粉溶液,溶液变 。
法2:氧化萃取法 氯水、萃取剂(苯 ρ<水 CCl4 ρ>水)
2Br- + Cl2 = Br2 + 2Cl-
2I- + Cl2 = I2 + 2Cl-
①常规检验法 a. 加碱法
b.用焰色试验可检验出溶液中的K+和Na+
4Fe(OH)2+O2+2H2O=4Fe(OH)3
(1)向某溶液中加入BaCl2溶液后生成白色沉淀,再加入稀盐酸沉淀不消失,说明溶液中存在SO42- ( )(2)向某溶液中加入Ca(OH)2溶液,有白色沉淀生成,溶液中一定存在CO32-( )(3)用Ba(NO3)2除去矿盐(主要成分是NaCl,还有SO42-等其他可溶性杂质的离子)中的SO42-( )(4)向某溶液中滴加氯水,再加入KSCN溶液,溶液变红色,溶液中不一定存在Fe2+( )(5)做某溶液的焰色试验,火焰呈黄色,溶液中一定存在钠元素,不可能存在钾元素( )
HCO3-+OH-= CO32-+H2O HSO3-+OH-= SO32-+H2O
CO32- HCO3- SO32- HSO3- Mg2+
黄光遮盖紫光;K元素的焰色需要透过蓝色钴玻璃观察
高中化学鲁科版 (2019)选择性必修1第4节 离子反应课文内容ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修1第4节 离子反应课文内容ppt课件,共60页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,Ba2+,称量沉淀质量,Fe2+,2滴定,Mg2+,Na2CO3等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第4节 离子反应课前预习课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第4节 离子反应课前预习课件ppt,共55页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,离子反应,原子或分子,浓度降低,离子方程式,答案C,答案B等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第4节 离子反应习题ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修1第4节 离子反应习题ppt课件,文件包含2022_2023学年新教材高中化学第3章物质在水溶液中的行为第4节离子反应第2课时离子反应的应用课件鲁科版选择性必修1pptx、2022_2023学年新教材高中化学第3章物质在水溶液中的行为第4节离子反应第2课时离子反应的应用课后习题鲁科版选择性必修1doc等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。













