











所属成套资源:人教版高一化学必修一同课件(含练习)
高中化学人教版 (2019)必修 第一册第三节 物质的量精品ppt课件
展开
这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量精品ppt课件,文件包含第二章第三节第3课时物质的量浓度pptx、第二章第三节第3课时物质的量浓度教师版docx、第二章第三节第3课时物质的量浓度学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
1.能从宏观和微观的角度理解物质的量浓度的含义及其微观粒子间的关系。2.掌握物质的量浓度的有关计算,逐步提升证据推理思维能力。
核心素养 发展目标
二、物质的量浓度的相关计算
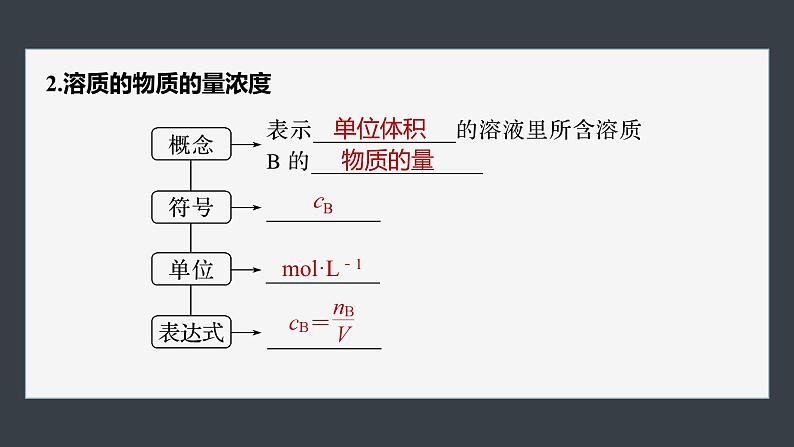
2.溶质的物质的量浓度
【思考1】 利用溶质的质量分数和溶质的物质的量浓度的表达式,推导出两者之间的定量关系。并利用得出的表达式计算:市售浓硫酸中溶质的质量分数为98%,密度为1.84 g·cm-3,则市售浓硫酸中硫酸的物质的量浓度为多少?
提示 ①设溶液体积为1 L,则
M:溶质B的摩尔质量(单位:g·ml-1);ρ:溶液密度(单位:g·mL-1);w为溶质的质量分数。
【思考2】 (1)1 L 0.5 ml·L-1的Al2(SO4)3溶液中n(Al3+)= ,c(Al3+)= ,n( )= ,c( )= ,c[Al2(SO4)3]∶c(Al3+)∶c( )= ,由此可知,对于同一溶液中,不同微粒的浓度之比等于 。(2)某BaCl2溶液中,测得c(Cl-)=0.5 ml·L-1,则c(Ba2+)= 。(3)下列与0.2 ml·L-1 AlCl3溶液中c(Cl-)相同的是 (填序号)。①0.2 ml·L-1 NaCl溶液 ②0.3 ml·L-1 MgCl2溶液 ③0.6 ml·L-1 KCl溶液 ④0.2 ml·L-1 BaCl2溶液
0.25 ml·L-1
1.判断正误(1)将58.5 g NaCl投入1 000 mL水中形成的溶液的物质的量浓度为1 ml·L-1(2)从200 mL 0.1 ml·L-1盐酸中取出50 mL溶液,其物质的量浓度仍为0.1 ml·L-1(3)标准状况下,将2.24 L HCl气体溶于1 L水中,得到3.24 L溶液(4)0.1 ml·L-1的NaCl溶液中含有Na+的物质的量为0.1 ml(5)将25 g CuSO4·5H2O溶于水配成1 L溶液,所得溶液的物质的量浓度为0.1 ml·L-1
2.将2.86 g Na2CO3·10H2O溶于水配成1 L溶液,则:(1)该溶液的溶质为________,其物质的量浓度为______ ml·L-1。(2)从所配溶液中取出10 mL溶液,取出溶液的物质的量浓度为______ ml·L-1,溶液中溶质的质量为___________ g。
特别提醒 ①c= 的体积(V)是指溶液的体积,不是溶剂的体积。②确定溶液中溶质的几种特殊情况:带有结晶水的物质如CuSO4·5H2O溶于水时,其溶质是CuSO4,NH3溶于水后溶质为NH3·H2O,但计算浓度时是以NH3分子作为溶质。
物质的量浓度的相关计算
1.与定义式有关的计算根据cB= ,欲求cB,先求nB和V。计算溶质的物质的量浓度的关键是从已知条件中找出溶质的物质的量(ml)和溶液的体积(L),据此求出溶质的物质的量浓度cB。
将标准状况下体积为V L的HCl气体溶于1 L水中,所得溶液的密度为ρ g·cm-3,计算所得溶液中溶质的物质的量浓度。
2.溶液稀释(或浓缩)有关的计算溶质的物质的量不变:c(浓)·V(浓)=c(稀)·V(稀);溶液的质量守恒:m(稀)=m(浓)+m(水)。
从1 L 1 ml·L-1氢氧化钠溶液中取出100 mL,将其加水稀释至500 mL,所得溶液的物质的量浓度是_____________。
3.溶质相同的两溶液混合溶质的物质的量不变:c1V1+c2V2=c(混)·V(混);溶质的质量不变:m1w1+m2w2=m(混)·w(混)。
取100 mL 0.3 ml·L-1和300 mL 0.25 ml·L-1的硫酸混合后再加水至溶液体积为500 mL,所得混合溶液中H+的物质的量浓度是______ ml·L-1。
4.电荷守恒关系在溶液中阳离子所带的正电荷总数=阴离子所带的负电荷总数。如Na2SO4和NaCl的混合溶液中:c(Na+)=2c( )+c(Cl-)。
已知:溶液呈电中性的原因是溶液中阴、阳离子所带的负、正电荷总数相等。在KCl、CaCl2、Ca(NO3)2形成的混合溶液中,c(K+)=0.2 ml·L-1,c(Ca2+)=0.5 ml·L-1,c(Cl-)=0.4 ml·L-1,则c( )为A.0.3 ml·L-1 B.0.8 ml·L-1C.0.4 ml·L-1 D.0.5 ml·L-1
1.判断正误(1)溶液的体积越小,浓度越大(2)将1 L 2 ml·L-1的稀硫酸加水稀释到2 L,所得溶液中溶质的物质的量浓度为1 ml·L-1(3)向100 mL 1 ml·L-1 K2SO4溶液中加入900 mL水,混合溶液的体积是1 L(4)把100 mL 1 ml·L-1的NaCl溶液加水稀释成200 mL,则稀释后溶液中所含的NaCl的物质的量变为原来的一半
(1)同一溶质、不同浓度的溶液混合,在混合前后溶质的质量、物质的量保持守恒,溶液的质量保持守恒,但溶液的体积一般不守恒。(2)混合后溶液的体积:①若指出不考虑溶液体积改变,可认为是溶液的体积之和;
1.(2022·遵义期末)钠元素在人体血液中以钠离子的形式存在,正常指标参考值为135~145 ml·L-1。表示该指标的物理量是A.物质的量 B.物质的量浓度C.质量分数 D.摩尔质量
2.(2023·杭州期末)下列溶液含有的氯离子的物质的量浓度最大的是A.1 mL 0.2 ml·L-1 CaCl2溶液B.1 mL 0.5 ml·L-1 KClO3溶液C.2 mL 0.3 ml·L-1 NaCl溶液D.4 mL 0.1 ml·L-1 AlCl3溶液
3.下列说法正确的是A.1 L水中溶解1 ml NaCl所形成溶液的物质的量浓度为1 ml·L-1B.标准状况下,22.4 L HCl气体溶于1 L水中形成的溶液的体积为1 LC.标准状况下,将33.6 L HCl气体溶于水形成1 L溶液,其物质的量浓度 是1.5 ml·L-1D.1 ml CaCl2溶于水形成1 L溶液,所得溶液中c(Cl-)等于1 ml·L-1
题组一 物质的量浓度1.下列溶液与20 mL 1 ml·L-1 硝酸钠溶液中 的物质的量浓度相等的是A.10 mL 1 ml·L-1 硝酸镁溶液B.5 mL 0.8 ml·L-1 硝酸铝溶液C.10 mL 2 ml·L-1 硝酸银溶液D.10 mL 0.5 ml·L-1 硝酸铜溶液
2.(2022·上海七一中学高一期中)下列各溶液中,氯离子(Cl-)物质的量浓度最小的是A.1 000 mL 0.2 ml·L-1的MgCl2溶液B.200 mL 0.25 ml·L-1的NaCl溶液C.300 mL 0.5 ml·L-1的KCl溶液D.400 mL 0.1 ml·L-1的AlCl3溶液
3.(2022·重庆高一期末)下列溶液中溶质的物质的量浓度为1 ml·L-1的是A.将40 g NaOH溶解于1 L水中B.将0.5 ml Na2O加入适量水中,配成1 L溶液C.将100 mL 2 ml·L-1NaCl溶液移去50 mL后剩余的溶液D.将11.2 L HCl气体通入水配成0.5 L的溶液
4.(2022·广西钦州高一期末)下列说法正确的是A.将44.8 L的HCl气体溶于水配成1 L溶液,溶液的浓度为2 ml·L-1B.1 ml·L-1的NaCl溶液是指此溶液中含有1 ml NaClC.2 L 0.2 ml·L-1的NaCl溶液与5 L 0.4 ml·L-1的NaCl溶液的Cl-浓度之 比为1∶2D.从100 mL硫酸溶液中取出10 mL,则这10 mL硫酸溶液的物质的量浓度 是原溶液的
题组二 与物质的量浓度有关的计算5.(2022·河南新乡高一期末)下列判断正确的是A.1 L H2O中溶解了22.4 L HCl,则该溶液的物质的量浓度为1 ml·L-1B.从1 L 1 ml·L-1 NaCl溶液中取出100 mL溶液,其物质的量浓度为 0.1 ml·L-1C.1.5 ml·L-1 Fe2(SO4)3溶液中, 的物质的量浓度为0.5 ml·L-1D.1 L KCl溶液中含有7.45 g KCl,则该溶液的物质的量浓度为0.1 ml·L-1
6.(2023·合肥高一期中)将30 mL 0.5 ml·L-1 NaOH溶液加水稀释到300 mL,稀释后溶液中NaOH的物质的量浓度为A.0.5 ml·L-1 ml·L- ml·L-1 D.5.0 ml·L-1
7.36.5 g HCl溶解在1 L水中(水的密度近似为1 g·cm-3)所得溶液的密度为ρ g·cm-3,质量分数为w,物质的量浓度为c ml·L-1,NA表示阿伏加德罗常数的值,则下列叙述正确的是A.所得溶液的物质的量浓度为1 ml·L-1B.36.5 g HCl气体占有的体积为22.4 L
8.(2022·长沙高一期中)某一由硫酸钾、硫酸铝和硫酸组成的混合溶液中:c(H+)=0.1 ml·L-1,c(Al3+)=0.4 ml·L-1,c( )=0.8 ml·L-1,则c(K+)为 ml·L-1 B.0.2 ml·L-1C.0.3 ml·L-1 D.0.4 ml·L-1
9.(2022·吉林高一检测)下列说法正确的是A.同浓度的三种溶液:Na2SO4、MgSO4、Al2(SO4)3,其体积比为3∶2∶1, 则 浓度比为3∶2∶3B.将2 ml·L-1的NaCl溶液和1 ml·L-1的BaCl2溶液等体积混合后,忽略 体积变化,c(Cl-)=1.5 ml·L-1C.常温常压下73 g HCl溶于1 L水,盐酸的物质的量浓度为2 ml·L-1D.若a g某气体含有分子数为b,则c g该气体在标准状况下的体积是
10.(2022·合肥高一月考)在等体积的NaCl、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为A.1∶2∶3 B.3∶2∶1C.1∶1∶1 D.6∶3∶2
11.(2022·河南焦作高一期末)将1 L Na2CO3溶液加水稀释,稀释过程中c(Na+)随溶液体积的变化曲线如图,下列说法正确的是A.将Na2CO3溶液稀释需用到烧杯、玻璃棒、漏斗等仪器B.图中x=9C.将该Na2CO3溶液与足量盐酸反应最多收集100.8 L CO2D.Na2CO3溶液的初始浓度为4.5 ml·L-1
12.(2022·石家庄正定中学高一月考)某结晶水合物的化学式为R·nH2O,其相对分子质量为M。25 ℃时,a g该晶体能够溶于b g水中形成V mL饱和溶液。下列关系中不正确的是
13.回答下列问题。(1)100 mL 0.2 ml·L-1 Na2SO4溶液中Na+的物质的量浓度为___________。
(2)从1 L Al2(SO4)3溶液中取出100 mL,向其中加入200 mL 0.9 ml·L-1的BaCl2溶液恰好使 完全沉淀,则原溶液中Al3+的物质的量浓度为____________。
(3)12.4 g Na2R含0.4 ml Na+,则Na2R的摩尔质量为__________,R的相对原子质量为_____。
(4)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2 L“人造空气”的质量是4.8 g,其中氧气和氦气的分子数之比是_______。
14.计算填空。(1)将14.2 g无水硫酸钠溶于水配制成500 mL硫酸钠溶液的物质的量浓度为____________,蒸发浓缩,使溶液体积为50 mL,所得Na2SO4溶液的物质的量浓度为___________,所得溶液中Na+的物质的量浓度为____________。
(2)硫酸钠和硫酸铝的混合溶液中,测得Al3+浓度为0.1 ml·L-1,加入等体积0.3 ml·L-1的氯化钡溶液恰好使 完全沉淀,则原混合溶液中Na+的浓度为____________。(3)将0.1 ml·L-1的硫酸钠溶液、0.2 ml·L-1的硫酸铝溶液和纯水混合,要使混合液中Na+、Al3+、 的浓度分别为0.1 ml·L-1、0.1 ml·L-1、0.2 ml·L-1,则硫酸钠溶液、硫酸铝溶液、纯水三者的体积比为_________(忽略体积的变化)。
(4)某混合溶液中,含有K+、Mg2+、Al3+、Cl-和 五种离子(不考虑溶液中少量的H+和OH-),其中c(K+)=3 ml·L-1、c(Mg2+)=2 ml·L-1、c(Al3+)=2 ml·L-1、c(Cl-)=7 ml·L-1,则溶液中 的物质的量浓度是___________。
15.(2022·成都石室中学高一月考)按要求计算并填空。(1)200 mL某硫酸盐溶液中含 1.5NA个,含金属离子NA个,则该硫酸盐溶液的物质的量浓度为______ ml·L-1。
(2)把V mL含有Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,一份加入含足量NaOH的溶液并加热,铵根离子完全反应生成a ml NH3(已知 NH3↑+H2O);另一份加入含b ml BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中Al3+的浓度为____________ ml·L-1。
(3)A、B、C三种一元碱,它们的摩尔质量之比是3∶5∶7,如果把7 ml A、5 ml B和3 ml C混合均匀,取混合碱5.36 g恰好能中和0.15 ml HCl。试求A的摩尔质量为_____ g·ml-1。
由酸与碱中和反应的实质可知n(H+)=n(OH-),据此计算5.36 g混合一元碱的总的物质的量,混合碱5.36 g恰好能中和0.15 ml HCl,所以n(OH-)=0.15 ml,所以一元碱的总物质的量也为0.15 ml,设A、B、C三种碱的摩尔质量分别为3x、5x、 7x,故一元碱的平均摩尔质量即为
(4)将W g胆矾(CuSO4·5H2O)溶解在V mL水中,得到饱和溶液,测得该饱和溶液的密度为ρ g·cm-3,则溶液的物质的量浓度为______________,该温度下,CuSO4的溶解度为____________。
(5)取8.58 g Na2CO3·xH2O溶于水配成溶液然后逐滴滴入质量分数为36.5%,密度为1.20 g·cm-3的盐酸直至没有气体放出,用去盐酸5.0 mL。则生成标况下CO2气体的体积为________;x的值为_____。
相关课件
这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量精品ppt课件,共23页。PPT课件主要包含了溶液的组成,物质的量浓度,06mol,molL,Na2CO3,06×10-2等内容,欢迎下载使用。
这是一份化学必修 第一册第三节 物质的量课堂教学课件ppt,共67页。
这是一份高中化学第三节 物质的量评课ppt课件,共40页。PPT课件主要包含了溶质的质量分数,物质的量浓度,是否漏水,合作探究·提素养,问题生成,答案体积,答案不需要,随堂检测·精评价,②①③⑧⑤⑥⑦④,检查容量瓶是否漏水等内容,欢迎下载使用。










