










所属成套资源:人教版高一化学必修一同课件(含练习)
化学必修 第一册第二节 金属材料多媒体教学课件ppt
展开
这是一份化学必修 第一册第二节 金属材料多媒体教学课件ppt,文件包含第三章第二节第2课时物质的量在化学方程式计算中的应用pptx、第三章第二节第2课时物质的量在化学方程式计算中的应用教师版docx、第三章第二节第2课时物质的量在化学方程式计算中的应用学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
1.能从物质的量的角度认识物质的组成及化学变化,能运用物质的量与其他物 理量之间的换算关系进行有关计算。2.能结合物质的量在化学方程式计算中的应用,进一步体会守恒思想,强化宏 观辨识与微观探析的能力。
核心素养 发展目标
一、根据化学方程式计算
二、化学计算中的关系式法和方程组法
1.以物质的量为中心的转化
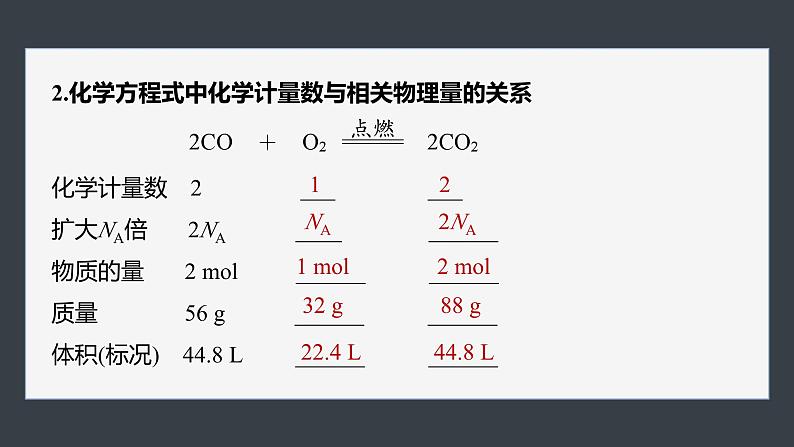
2.化学方程式中化学计量数与相关物理量的关系
化学计量数 2 ___ ___扩大NA倍 2NA ____ ______物质的量 2 ml ______ ______质量 56 g ______ ______体积(标况) 44.8 L ______ ______
【思考1】 根据上面化学方程式中化学计量数与相关物理量的关系,归纳各物质的化学计量数与物质的量、同温同压下气体的体积之间的关系。
提示 (1)同一个化学方程式中各物质的化学计量数之比等于其物质的量之比。(2)对于有气体参加的反应,在同温同压下各气体的化学计量数之比也等于其体积之比。
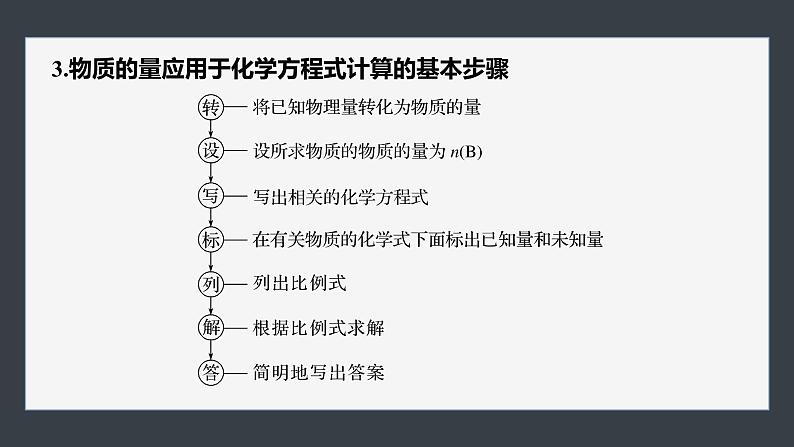
3.物质的量应用于化学方程式计算的基本步骤
【思考2】 5.4 g铝与足量NaOH溶液反应生成的氢气在标准状况下的体积是多少?请尝试用以下两种方法解答,并体会第2种方法的简便快捷。
2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑2 30.2 ml n(H2)
提示 设生成标准状况下H2的体积为V(H2)2Al+2NaOH+6H2O===2Na[Al(OH)4]+3H2↑2×27 g 3×22.4 L5.4 g V(H2)
g金属钠与水反应,得到100 mL溶液,试计算:(1)生成的气体在标准状况下的体积。(2)反应后所得溶液的物质的量浓度。
答案 设生成标准状况下气体的体积为V,反应后所得溶液的物质的量浓度为c。2Na + 2H2O===2NaOH + H2↑2×23 g 2 ml 22.4 L1.15 g 0.1 L×c V
2.10.2 g Al2O3与100 mL 1 ml·L-1 NaOH溶液反应,求产物Na[Al(OH)4]的浓度(忽略溶液体积变化)。
答案 NaOH溶液不足,按NaOH的物质的量计算。Al2O3+2NaOH+3H2O===2Na[Al(OH)4] 2 21 ml·L-1×0.1 L n{Na[Al(OH)4]}
解得n{Na[Al(OH)4]}=0.1 ml
根据化学方程式计算的注意事项(1)书写格式规范化:各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。(2)单位运用对应化:如果题目所给的两个量单位不一致,要注意两个量的单位要“上下一致,左右相当”。(3)如果两种反应物的量都是已知的,求解某种产物的量时,必须先判断哪种物质过量,然后根据量不足的物质进行计算。
化学计算中的关系式法和方程组法
1.关系式法当已知量和未知量之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。然后将“关系式”当作化学方程式使用,一步计算求出未知量。
(1)根据化学方程式确定关系式根据化学方程式确定关系式时,首先要写出化学方程式,然后要找出方程式变化中的“中间量”,通过“中间量”找出“已知量”与“未知量”之间的物质的量的关系,如由硫黄制取H2SO4的三步反应:
反应中已知量与未知量之间的关系:已知量——中间量——中间量——未知量S ~ SO2 ~ SO3 ~ H2SO41 ml 1 ml 1 ml 1 ml即S~H2SO4。
(2)根据原子守恒确定关系式上述例子中也可以由硫原子守恒直接得出关系式“S~H2SO4”。2.方程组法方程组法一般用于解决两种物质的混合物计算,一般读题时能找到两个已知量时,均可以利用二元一次方程组进行求算未知量。
1.已知Fe+S FeS,FeS+2HCl===FeCl2+H2S↑,2H2S+3O2 2SO2+2H2O。将一定量的铁粉和9 g硫粉混合加热,待其充分反应后再加入过量盐酸,将生成的气体完全燃烧,共收集到9 g水,则加入铁粉的质量为A.14 g B.42 g C.56 g D.28 g
2.已知CO、CO2的混合气体质量共16.0 g,标准状况下体积为8.96 L,则该混合气体中CO的质量为______ g,所含CO2在标准状况下的体积为_____ L。
CO的质量为0.1 ml×28 g·ml-1=2.80 g,CO2在标准状况下的体积为0.3 ml×22.4 L·ml-1=6.72 L。
1.(2022·上海徐汇中学高一月考)已知二氧化锰与浓盐酸在加热条件下发生反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,用8.7 g二氧化锰与足量的浓盐酸混合加热,充分反应,计算:(1)消耗浓盐酸中溶质的物质的量为__________。(2)产生的Cl2在标准状况下的体积为________。(3)将反应后的溶液加水稀释至400 mL,则此溶液中MnCl2的物质的量浓度是_____________。
0.25 ml·L-1
2.在室温下,向100 mL CuSO4饱和溶液中加入足量的经硫酸酸化的KI溶液,发生反应:2Cu2++4I-===2CuI↓+I2,反应完全后,用0.625 ml·L-1的Na2S2O3溶液进行测定: ,消耗了20 mL Na2S2O3溶液,计算原饱和溶液中CuSO4的物质的量浓度。
答案 设硫酸铜的物质的量浓度为x,根据反应方程式可得关系式:
2 2 0.1 L×x 0.625 ml·L-1×0.02 L
3.把1.1 g铁、铝混合物溶于200 mL 5 ml·L-1盐酸中,反应后盐酸的浓度变为4.6 ml·L-1(溶液体积变化忽略不计)。求:(1)反应中消耗HCl的物质的量。
答案 消耗HCl的物质的量:0.2 L×5 ml·L-1-0.2 L×4.6 ml·L-1=0.08 ml。
(2)该混合物中铝、铁的物质的量。
答案 设Al、Fe的物质的量分别为x、y。2Al + 6HCl===2AlCl3+3H2↑2 6x 3xFe + 2HCl===FeCl2+H2↑1 2y 2y
解得x=0.02 ml,y=0.01 ml。即n(Al)=0.02 ml,n(Fe)=0.01 ml。
题组一 应用化学方程式计算1.把一小块钠放入足量水中,会发生如下反应:2Na+2H2O===2NaOH+H2↑。下列有关该反应的说法正确的是A.反应中Na与NaOH的质量相等B.反应中H2O与H2的质量相等C.反应中H2O与H2的质量之比为2∶1D.反应中Na与NaOH的物质的量之比为1∶1
2.在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,该NaOH溶液的浓度为A.1.0 ml·L-1 B.2.0 ml·L-1C.1.5 ml·L-1 D.3.0 ml·L-1
3.实验室利用反应2KClO3 2KCl+3O2↑制取氧气,现有24.5 g KClO3参加反应,则得到标准状况下的氧气的体积是 L L C.44.8 L L
题组二 过量判断4.(2023·洛阳高一期末)标准状况下,将钠、镁各0.3 ml分别放入100 mL 1 ml·L-1的硫酸中,反应产生的气体体积之比是A.1∶1 B.2∶3C.3∶2 D.2∶1
5.(2022·成都高一月考)将1.12 g铁粉加入25 mL 2 ml·L-1氯化铁溶液中充分反应(忽略溶液体积变化),下列分析正确的是A.铁粉有剩余B.Cl-浓度减小C.向溶液中滴入KSCN溶液,溶液变红色D.溶液质量增加5.6 g
题组三 应用关系式法和方程组法计算6.向200 mL 0.1 ml·L-1的FeSO4溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为 g g C.1.6 g g
kg kg kg
8.(2022·广州高一期末)将3.9 g Mg、Al组成的混合物与足量盐酸反应,产生4.48 L(标准状况下)氢气。下列推断正确的是A.参加反应的HCl为0.2 mlB.Mg、Al在反应中共失去0.2 ml电子C.参加反应的Mg为2.4 gD.若与足量的氢氧化钠溶液反应能产生0.15 ml H2
9.把过量铁屑加入FeCl3、CuCl2的混合溶液中,反应结束后,称得剩余固体的质量与所加铁屑的质量相等。则原溶液中FeCl3与CuCl2的物质的量之比是A.7∶2 B.3∶2C.2∶3 D.2∶7
10.(2022·山东师范大学附中高一月考)在标准状况下,将6.5 g锌和4.6 g钠分别与2.24 L氯化氢溶于水形成的盐酸反应,则放出H2的体积A.锌和钠放出氢气的体积一样大B.锌放出氢气的体积大C.钠放出氢气的体积大D.无法比较
11.向一定量的Fe、FeO、Fe3O4的混合物中加入100 mL 2 ml·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)气体,所得溶液中加入KSCN溶液无红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是A.11.2 g B.5.6 gC.2.8 g D.无法计算
12.现有由氧化铁和铝组成的铝热剂,某实验小组分别进行如下实验:①取a g样品,向其中加入足量的NaOH溶液,测得生成气体的体积为b L(标准状况下);②另取a g样品,高温条件下二者恰好完全反应:2Al+Fe2O3 Al2O3+2Fe,待其冷却后,加入足量盐酸,测得生成气体的体积为c L(标准状况下)。则c∶b等于A.1∶1 B.1∶2 C.2∶3 D.3∶4
13.把铁、氧化铁、氧化铜的混合物粉末放入110 mL 4 ml·L-1盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g,过滤,滤液中无Cu2+,将滤液加水稀释到200 mL,测得其中c(H+)=0.4 ml·L-1。请回答下列问题:(1)残留固体1.28 g为_____(填化学式)。(2)原混合物粉末中,m(CuO)=____ g。
(3)滤液稀释到200 mL后,c(Fe2+)=______ ml·L-1。
(4)稀释后,加入足量的硝酸银,产生沉淀的物质的量n(AgCl)=_____ ml。
(5)原混合物总质量为m(总)=_____ g。
14.某研究小组取一定质量的镁铝合金材料投入200 mL稀硫酸中,待固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。(1)加入NaOH溶液0~20 mL时,发生反应的离子方程式为___________________。
(2)加入NaOH溶液体积为220 mL时,沉淀的成分是_________________________________。
0.15 ml Mg(OH)2、
0.1 ml Al(OH)3
(3)该合金材料中,镁、铝的物质的量之比为______。
(4)稀硫酸的物质的量浓度为____________。
加入200 mL NaOH溶液时,沉淀量最大,此时沉淀为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,
15.铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题:(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是______。
(2)足量的两份铝分别投入等体积、等物质的量浓度的盐酸和氢氧化钠溶液中,相同条件下产生H2的体积之比是______。
(3)足量的两份铝分别投入等体积、一定物质的量浓度的盐酸、NaOH溶液中,二者产生的H2相等,则盐酸和NaOH溶液的物质的量浓度之比是______。
(4)甲、乙两烧杯中各盛有100 mL 3 ml·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,相同条件下测得生成的气体体积之比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为_____(填字母)。A.5.4 g B.3.6 g C.2.7 g D.1.8 g
相关课件
这是一份高中化学人教版 (2019)必修 第一册第二节 金属材料试讲课课件ppt,共24页。PPT课件主要包含了cB∙V,化学计量数之比,物质的量之比,气体体积之比,mFe,9molL,mol等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量教学ppt课件,共32页。
这是一份高中化学第三节 物质的量一等奖ppt课件,共1页。










