

新教材宁陕2024届高考化学一轮复习学案第4章非金属及其化合物第22讲氮及其氧化物硝酸鲁科版
展开考点一 氮及其氧化物
1.氮的固定
2.氮气
(1)物理性质:____色____味的气体,密度比空气略小,____溶于水。
(2)化学性质
写出有关化学方程式:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(3)下列氮气的用途叙述中,分别应用了氮气的什么性质?
①文物馆将贵重文物保存在氮气中_________________________________________________。
②氮气是合成氨工业的重要原料___________________________________________________。
③雷电是自然界重要的固氮方式___________________________________________________。
④医疗上,液氮是常见的冷冻剂___________________________________________________
_______________________________________________________________________________。
3.氮的氧化物
(1)氮有多种价态的氧化物,氮元素从+1→+5价都有对应的氧化物,如N2O、____、N2O3、NO2(或________)、N2O5,其中属于酸性氧化物的是N2O3、________。
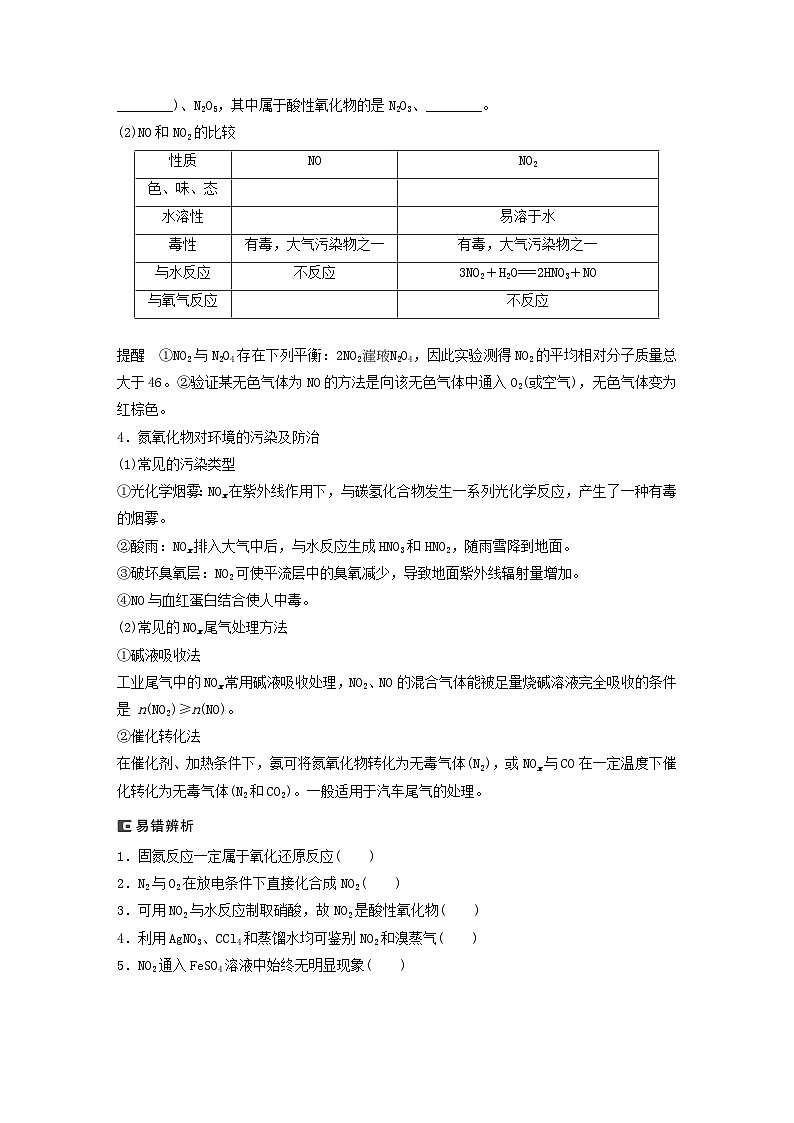
(2)NO和NO2的比较
提醒 ①NO2与N2O4存在下列平衡:2NO2N2O4,因此实验测得NO2的平均相对分子质量总大于46。②验证某无色气体为NO的方法是向该无色气体中通入O2(或空气),无色气体变为红棕色。
4.氮氧化物对环境的污染及防治
(1)常见的污染类型
①光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
②酸雨:NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面。
③破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
④NO与血红蛋白结合使人中毒。
(2)常见的NOx尾气处理方法
①碱液吸收法
工业尾气中的NOx常用碱液吸收处理,NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是 n(NO2)≥n(NO)。
②催化转化法
在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N2),或NOx与CO在一定温度下催化转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理。
1.固氮反应一定属于氧化还原反应( )
2.N2与O2在放电条件下直接化合成NO2( )
3.可用NO2与水反应制取硝酸,故NO2是酸性氧化物( )
4.利用AgNO3、CCl4和蒸馏水均可鉴别NO2和溴蒸气( )
5.NO2通入FeSO4溶液中始终无明显现象( )
一、氮气、NO和NO2的性质
1.氮是生命活动不可缺少的重要元素。下列叙述错误的是( )
A.液氮可用于医学和高科技领域,制造低温环境
B.点燃的镁条在氮气中不反应
C.氮气是工业合成氨的原料之一
D.氮的固定是将大气中的氮气转化成氮的化合物
2.下列有关氮的氧化物的说法正确的是( )
A.NO和NO2混合气体的尾气可以用水吸收
B.4.6 g NO2和N2O4混合气体中含有的氧原子数目小于0.2NA
C.用湿润的淀粉-KI试纸鉴别Br2(g)和NO2
D.除去NO中混有少量NO2气体时,可以用水洗涤后再干燥
二、氮的氧化物与O2、H2O反应定量关系应用
3.将盛有12 mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL无色气体。
(1)若剩余的气体是_______________,则NO2、O2的体积分别是________________________。
(2)若剩余的气体是_______________,则NO2、O2的体积分别是________________________。
三、废气中氮氧化物的治理
4.(1)汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:______________________________
______________________________________________________________________________。
(2)用氨可将氮氧化物转化为无毒气体。如4NH3+6NOeq \(=====,\s\up7(催化剂),\s\d5(△))5N2+6H2O,写出氨气转化NO2的化学方程式:________________________________________________________________,
该反应中氧化产物与还原产物的质量之比为________________________________________。
(3)工业尾气中氮的氧化物常采用碱液吸收法处理。
①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:____________________________________________________________________________
______________________________________________________________________________。
②NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是________________。
考点二 硝酸
1.物理性质
硝酸是____色、____挥发、____________气味的液体。
2.化学性质
(1)不稳定性
反应:________________________________________________________________________。
(2)强氧化性
硝酸无论浓、稀都具有强氧化性,而且浓度越大,氧化性越强。
①与金属反应
稀硝酸与铜反应的化学方程式:__________________________________________________
______________________________________________________________________________;
浓硝酸与铜反应的化学方程式:__________________________________________________
______________________________________________________________________________。
②与非金属反应
浓硝酸与C反应的化学方程式:__________________________________________________
______________________________________________________________________________。
③与还原性化合物反应
硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+等还原性物质。
稀硝酸与FeSO4溶液反应的离子方程式:__________________________________________
______________________________________________________________________________。
(3)与有机物反应
①硝化反应(与反应):
________________________________________________________________________;
②显色反应:含有苯环的蛋白质遇到浓硝酸加热后变____色。
1.常温下,铁、铝在浓硝酸中的钝化为化学变化( )
2.可用稀HNO3与FeS固体反应制取H2S( )
3.铜、碳分别与浓HNO3反应,都体现了浓硝酸的强氧化性和酸性( )
4.在酸性条件下,NOeq \\al(-,3)与I-、Fe2+、SOeq \\al(2-,3)等离子均不能大量共存( )
5.Cu在KNO3溶液和稀H2SO4中均不溶解,但能溶解在其混合液中( )
6.试管内壁上的银镜可用稀HNO3除去,也可用氨水除去( )
7.浓HNO3和氯水均用棕色试剂瓶保存,其原理相同( )
8.浓HNO3溅到皮肤上,皮肤会变黄( )
一、金属与硝酸反应的定性分析
1.用动态观点理解Cu与浓HNO3的反应
向一定量的浓硝酸中加入过量的铜片。
(1)反应开始阶段产生__________色气体,化学方程式为______________________________。
(2)反应进行一段时间后又产生无色气体,此时的化学方程式为________________________。
(3)待反应停止后,再加入少量的稀硫酸,这时Cu片上又有气泡产生,原因是__________
_____________________________________________________________________________。
二、金属与硝酸反应的定量计算
2.将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为____ L,NO2的体积为______ L。
(2)参加反应的HNO3的物质的量是________________________________________________。
(3)待产生的气体全部释放后,向溶液中加入V mL a ml·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为_________________________________ml·L-1。
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________ g。
3.(2022·河北唐山高三期末)向含x ml HNO3和y ml H2SO4的混合稀溶液中缓慢加入铁粉,其氧化产物与所加铁粉的物质的量关系如图所示:
回答下列问题:
(1)Oa段发生反应的离子方程式为________________________________________________
______________________________________________________________________________。
(2)dc段表示的是________(填“Fe2+”或“Fe3+”)物质的量变化。
(3)x=________,y=________。
(4)反应至c点,可收集到标准状况下的气体为________L。
金属与硝酸反应计算的思维流程
1.正误判断,正确的打“√”,错误的打“×”。
(1)浓HNO3和稀HNO3与Cu反应的还原产物分别为NO2和NO,故稀HNO3氧化性更强(2021·河北,10D)( )
(2)向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2(2021·山东,5C)( )
2.(2022·江苏,8)氮及其化合物的转化具有重要应用。下列说法不正确的是( )
A.自然固氮、人工固氮都是将N2转化为NH3
B.侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl
C.工业上通过NH3催化氧化等反应过程生产HNO3
D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
3.(2022·北京,12)某MOFs的多孔材料刚好可将N2O4“固定”,实现了NO2与N2O4分离并制备HNO3,如图所示:
已知:2NO2(g)N2O4(g) ΔH<0
下列说法不正确的是( )
A.气体温度升高后,不利于N2O4的固定
B.N2O4被固定后,平衡正移,有利于NO2的去除
C.制备HNO3的原理为:2N2O4+O2+2H2O===4HNO3
D.每制备0.4 ml HNO3,转移电子数约为6.02×1022
4.(2017·北京,12)下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸产生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应性质
NO
NO2
色、味、态
水溶性
易溶于水
毒性
有毒,大气污染物之一
有毒,大气污染物之一
与水反应
不反应
3NO2+H2O===2HNO3+NO
与氧气反应
不反应
①
②
③
2025年高考化学一轮复习讲义(新高考版) 第5章 第25讲 氮及其氧化物 硝酸: 这是一份2025年高考化学一轮复习讲义(新高考版) 第5章 第25讲 氮及其氧化物 硝酸,文件包含第5章第25讲氮及其氧化物硝酸docx、2025年高考化学一轮复习讲义新高考版第5章第25讲氮及其氧化物硝酸docx等2份学案配套教学资源,其中学案共26页, 欢迎下载使用。
高考化学一轮复习第5章非金属及其化合物第23讲硝酸氮及其化合物的相互转化学案: 这是一份高考化学一轮复习第5章非金属及其化合物第23讲硝酸氮及其化合物的相互转化学案,共19页。
高考化学一轮复习第5章非金属及其化合物第22讲氮及其氧化物氨和铵盐学案: 这是一份高考化学一轮复习第5章非金属及其化合物第22讲氮及其氧化物氨和铵盐学案,共23页。












