




高中化学人教版 (2019)选择性必修1第一节 化学反应速率教学ppt课件
展开
这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率教学ppt课件,共28页。PPT课件主要包含了第3课时活化能等内容,欢迎下载使用。
第一节 化学反应速率
分子相互碰撞是引发反应的必要条件。
2.分子间发生化学反应的必要条件是什么?
1.化学反应的本质是什么?
反应物中旧化学键的断裂生成物中新化学键的形成
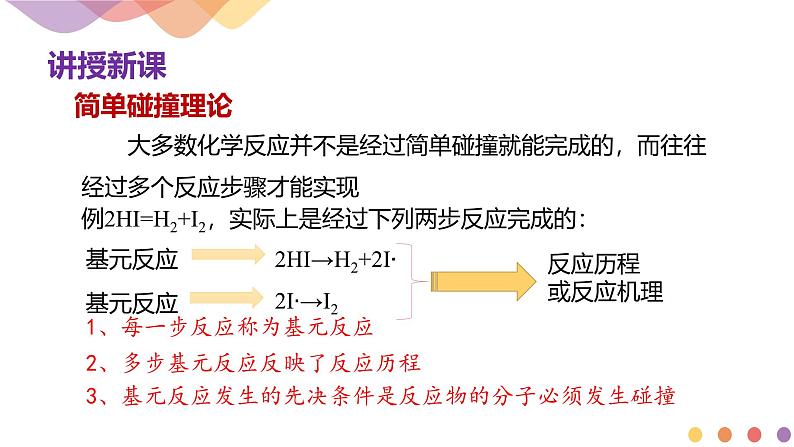
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现
2HI→H2+2I∙2I∙→I2
例2HI=H2+I2,实际上是经过下列两步反应完成的:
1、每一步反应称为基元反应
2、多步基元反应反映了反应历程
3、基元反应发生的先决条件是反应物的分子必须发生碰撞
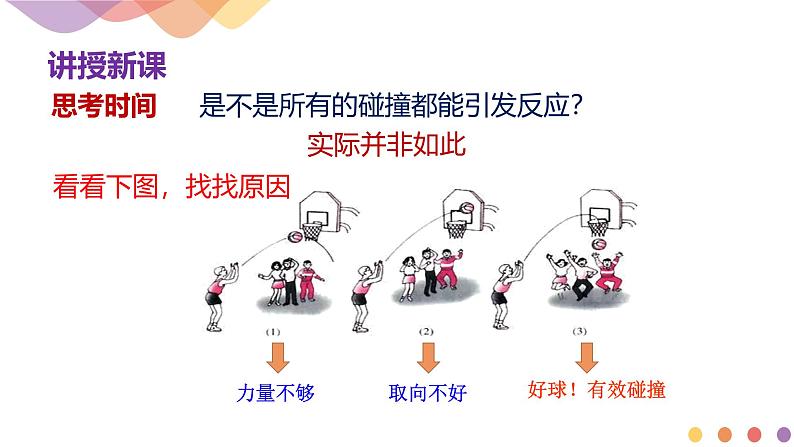
是不是所有的碰撞都能引发反应?
概念:能够发生化学反应的碰撞
碰撞 是发生化学反应的必要条件
有效碰撞 是发生化学反应的充分条件
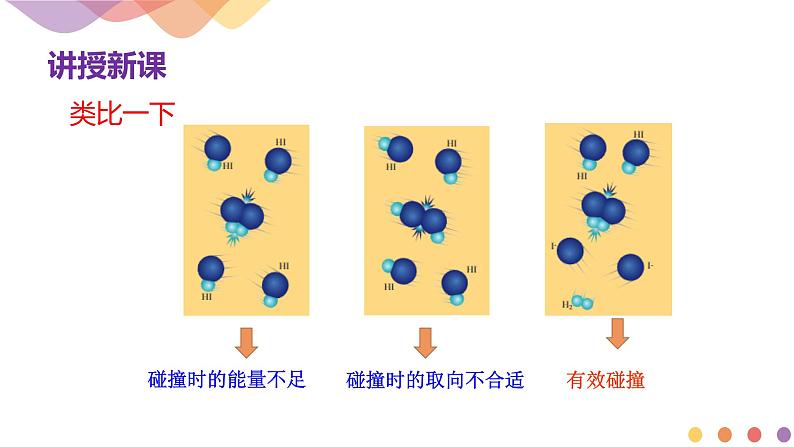
①必须是活化分子间的碰撞
②碰撞时要有合适的取向
具有较高能量,能够发生有效碰撞的分子
注意:1、发生有效碰撞的分子一定是活化分子; 2、活化分子的碰撞不一定是有效碰撞;(由于取向问题)
4、有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关。
3、其他条件不变时,同一反应活化分子在反应物中所占的百分数是一定的。
下列说法正确的是A、一定条件下,增大反应物的量会加快化学反应速率。B、增大压强,肯定会加快化学反应速率。C、活化分子间所发生的碰撞为有效碰撞。D、能够发生有效碰撞的分子叫活化分子。
活化分子变成生成物分子放出的能量
该反应是吸热反应还是放热反应?
活化能与反应热有关吗?
活化分子所多出普通分子的那部分能量E1。
2.活化能和反应速率的关系:活化能越低,单位体积内活化分子数越多,单位时间单位体积内有效碰撞的次数就越多,化学反应速率就会越快。
1.活化能的大小虽然意味着一般分子成为活化分子的难易,但是却对这个化学反应前后的能量变化并不产生任何影响。
练习.下列说法不正确的是( )A.能量较高、有可能发生有效碰撞的分子称为活化分子B.活化分子的平均能量与所有分子的平均能量之差称为活化能C.催化剂能参与反应,可降低原反应所需活化能D.非活化分子也有可能发生有效碰撞
一个反应要发生一般要经历哪些过程?
四、活化分子、有效碰撞与反应速率的关系
反应物浓度增大,即单位体积内反应物分子总数增大
单位体积内活化分子数增加
(1)浓度对反应速率的影响
1:将盐酸滴到碳酸钠粉末上,能使反应的最初速率加快的是 A、盐酸浓度增加一倍,用量减至1/2 B、盐酸浓度不变,使用量增大一倍 C、增大Na2CO3粉末的量
2:用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是A、加热B、不用稀硫酸,改用98%的浓硫酸C、滴加少量CuSO4溶液D、不用铁片,改用铁粉
(2)压强对反应速率的影响
如果反应物是固体、液体或溶液时,改变压强对它们又有什么影响?
应用:反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是A.增加C的量B.将容器的体积缩小一半C.保持体积不变,充入N2使体系压强增大D.保持压强不变,充入N2使容器体积变大
单位体积内活化分子数增多(活化分子百分数增大)
三、温度对反应速率的影响
【原因】温度升高(1)分子获得能量,活化分子百分数提高;(2)分子热运动加快,碰撞频率提高。
应用:设NO+CO2⇌2CO(正反应吸热)反应速率为v1;N2+3H2 ⇌ 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为A、同时增大 B、 同时减小 C、v1减少,v2增大 D、v1增大,v2减小
四、催化剂对反应速率的影响
活化分子百分数增大(活化分子数目增多)
(1)使用适当的催化剂能减少过程中的能耗。
(2)使用催化剂能改变反应速率,但反应热没变。
应用:下列关于催化剂的说法,正确的是 A.催化剂能使不起反应的物质发生反应B.催化剂在化学反应前后,化学性质和质量都不变C.催化剂能改变化学反应速率 D.任何化学反应,都需要催化剂
练习:下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( ) A、增大浓度 B、增大压强 C、升高温度 D、使用催化剂
影响化学反应速率的外因
相关课件
这是一份人教版 (2019)选择性必修1第一节 化学反应速率获奖ppt课件,共38页。PPT课件主要包含了学习目标,新课导入,化学反应速率,反应物浓度的减少量,生成物浓度的增加量,均取正值,新课讲解,气体体积,体系压强,颜色深浅等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率教课内容ppt课件,共20页。PPT课件主要包含了思考与讨论,不同化学反应的速率,同一化学反应的速率,外界条件外因,内因决定性因素,外因重要影响因素等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率优秀ppt课件,共4页。










