

所属成套资源:高考化学 知识点专项
高考化学 化学反应速率和化学平衡 专项训练(WORD版)
展开
这是一份高考化学 化学反应速率和化学平衡 专项训练(WORD版),共23页。试卷主要包含了化学反应速率的概念与表示方法,化学反应速率与化学计量数的关系,化学反应速率计算——“三段式”,2 ml·L-1等内容,欢迎下载使用。
考点 化学反应速率
1.化学反应速率的概念与表示方法
2.化学反应速率与化学计量数的关系
对于已知反应mA(g)+nB(g)===pC(g)+qD(g),其化学反应速率可用不同的反应物或生成物来表示,当单位相同时,化学反应速率的数值之比等于方程式中各物质的化学计量数之比,即v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q。
3.同一化学反应中反应快慢的比较方法
由于同一化学反应的反应速率用不同物质表示时数值可能不同,所以比较反应的快慢不能只看数值的大小,而要进行一定的转化。
(1)看单位是否统一,若不统一,换算成相同的单位。
(2)换算成同一物质表示的速率,再比较数值的大小。
(3)比较化学反应速率与化学计量数的比值,即对于一般反应aA(g)+bB(g)===cC(g)+dD(g),比较eq \f(vA,a)与eq \f(vB,b),若eq \f(vA,a)>eq \f(vB,b),则用A物质表示的反应速率比用B物质表示的大。
4.化学反应速率计算——“三段式”
(1)写出有关反应的化学方程式。
(2)找出各物质的起始量、转化量、某时刻量。
(3)根据已知条件列方程式计算。例如:反应 mA(g)+nB(g) pC(g)
起始浓度(ml·L-1) a b c
转化浓度(ml·L-1) x eq \f(nx,m) eq \f(px,m)
某时刻浓度(ml·L-1) a-x b-eq \f(nx,m) c+eq \f(px,m)
题组一 化学反应速率概念的理解与计算
1.(2022天津六校联考)反应4A(s)+3B(g)===2C(g)+D(g),经2 min B的浓度减少0.6 ml·L-1。有关反应速率的说法正确的是( )
A.用A表示的反应速率是0.4 ml·L-1·min-1
B.分别用A、B、C、D表示反应的速率,其比值是4∶3∶2∶1
C.在2 min末的反应速率,用B表示速率小于0.3 ml·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是逐渐增大的
2.(2021浙江1月选考)取50 mL过氧化氢水溶液,在少量I-存在下分解:2H2O2===2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2浓度(c)如下表:
下列说法不正确的是( )
A.反应20 min时,测得O2体积为224 mL(标准状况)
B.20~40 min,消耗H2O2的平均速率为0.010 ml·L-1·min-1
C.第30 min时的瞬时速率小于第50 min时的瞬时速率
D.H2O2分解酶或Fe2O3代替I-也可以催化H2O2分解
3.(1)F.Daniels等曾利用测压法在刚性反应器中研究了25 ℃ 时N2O5(g)分解反应:
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,N2O5(g)完全分解]:
研究表明,N2O5(g)分解的反应速率v=2×10-3×pN2O5(kPa·min-1)。t=62 min时,测得体系中pO2=2.9 kPa,则此时的pN2O5=________kPa,v=________ kPa·min-1。
(2)用O2将HCl转化为Cl2,可提高效益,减少污染。
一定条件下测得反应过程中n(Cl2)的数据如下:
计算2.0~6.0 min内以HCl的物质的量变化表示的反应速率(以ml·min-1为单位,写出计算过程)。
(3)硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.050 ml·L-1,15 ℃时测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示。回答下列问题:
计算该反应在120~180 s与180~240 s 区间的平均反应速率__________、__________;比较两者大小可得出的结论是______________。
题组二 利用速率常数计算
4.(2022福建漳州质检)反应2NO(g)+Cl2(g)===2NOCl(g)在295 K时,反应物浓度与反应速率关系的数据如表:
注:ⅰ.反应物浓度与反应速率关系式为v(Cl2)=k·cm(NO)·cn(Cl2)(式中速率常数k=Ae-eq \f(Ea,RT),其中Ea为活化能,A、R均为大于0的常数,T为温度);ⅱ.反应级数是反应速率方程式中各反应物浓度的指数之和。
下列说法不正确的是( )
A.m=2,n=1,反应级数为3
B.当c(NO)=0.200 ml·L-1,c(Cl2)=0.300 ml·L-1时,v(NO)=0.192 ml·L-1·s-1
C.加入催化剂可以改变反应途径,也可以使速率常数k增大,从而加快反应速率
D.升高温度,可以增大反应的活化能Ea,从而使速率常数k增大
5.(2021河北化学)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①M+N===X+Y;②M+N===X+Z,反应①的速率可表示为v1=k1c2(M),反应②的速率可表示为v2=k2c2(M)(k1、k2为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是( )
A.0~30 min时间段内,Y的平均反应速率为6.67×10-8 ml·L-1·min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
题组三 化学反应速率大小的比较
6.(2022湖南长沙模拟)反应A(g)+3B(g)2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45 ml·L-1·s-1 ②v(B)=0.6 ml·L-1·s-1 ③v(C)=0.4 ml·L-1·s-1④v(D)=0.45 ml·L-1·s-1。下列有关反应速率的比较中正确的是( )
A.④>③=②>① B.①>④>②=③
C.①>②>③>④ D.④>③>②>①
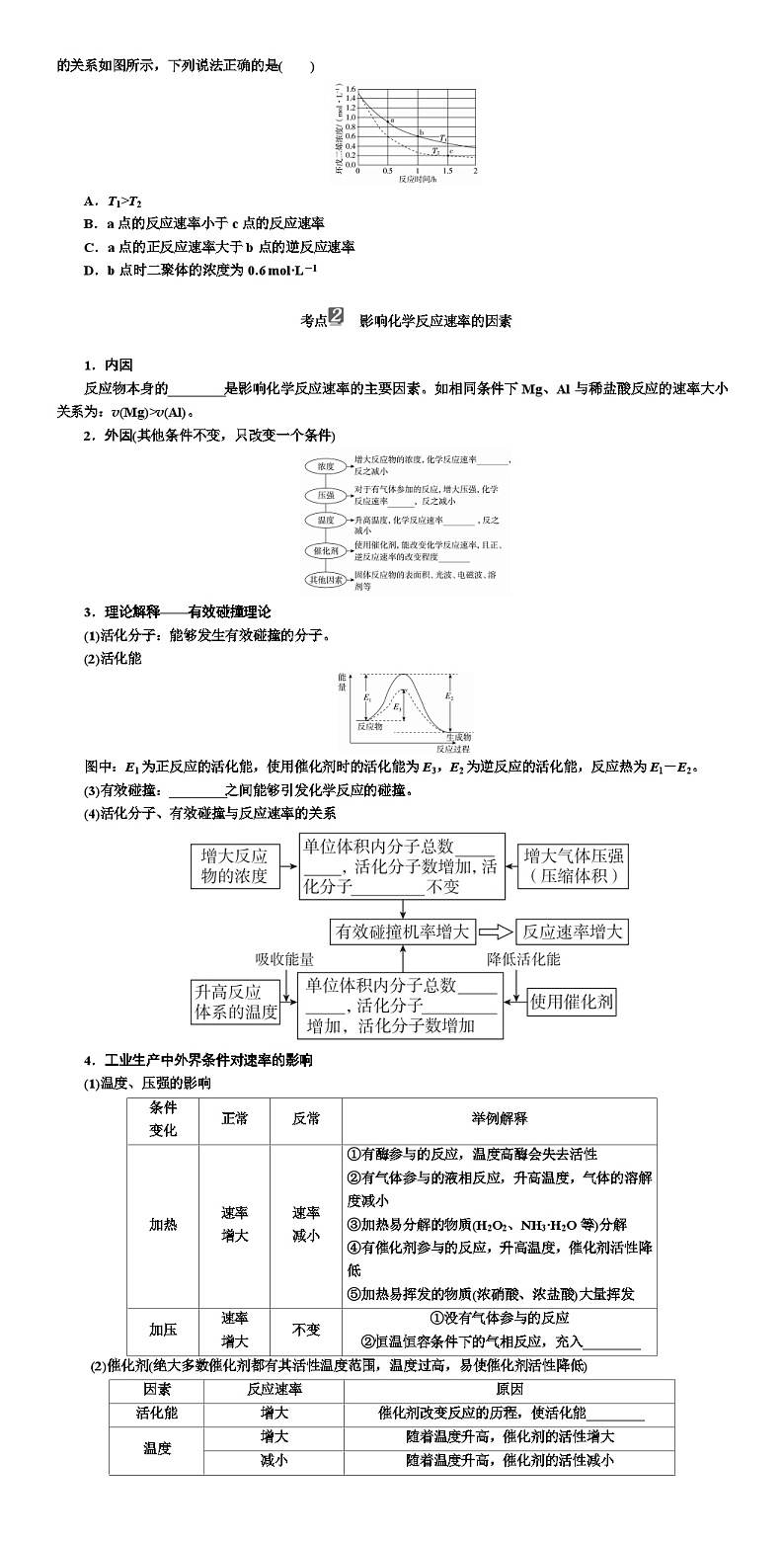
7.环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.6 ml·L-1
考点 影响化学反应速率的因素
1.内因
反应物本身的________是影响化学反应速率的主要因素。如相同条件下Mg、Al与稀盐酸反应的速率大小关系为:v(Mg)>v(Al)。
2.外因(其他条件不变,只改变一个条件)
3.理论解释——有效碰撞理论
(1)活化分子:能够发生有效碰撞的分子。
(2)活化能
图中:E1为正反应的活化能,使用催化剂时的活化能为E3,E2为逆反应的活化能,反应热为E1-E2。
(3)有效碰撞:________之间能够引发化学反应的碰撞。
(4)活化分子、有效碰撞与反应速率的关系
4.工业生产中外界条件对速率的影响
(1)温度、压强的影响
(2)催化剂(绝大多数催化剂都有其活性温度范围,温度过高,易使催化剂活性降低)
(3)在工艺流程中,提高矿石酸(碱)浸速率的常见方法
①将矿石粉碎(或粉碎过筛);
②充分搅拌;
③适当升高酸(碱)浸的温度;
④适当增大酸(碱)的浓度。
(4)减小反应速率常用的方法
①减小反应液的浓度;
②将装置置于冰水浴中;
③减慢滴加反应液的速率;
④用大颗粒(或块状)代替小颗粒(或粉末状)物质反应。
题组一 外因对化学反应速率的影响
1.(2021辽宁化学)某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是( )
A.其他条件相同时,催化剂浓度越大,反应速率越大
B.其他条件相同时,降冰片烯浓度越大,反应速率越大
C.条件①,反应速率为0.012 ml·L-1·min-1
D.条件②,降冰片烯起始浓度为3.0 ml·L-1时,半衰期为62.5 min
题组二 有效碰撞理论
2.1,3丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3丁二烯生成碳正离子();第二步Br-进攻碳正离子完成1,2加成或1,4加成。反应进程中的能量变化如图所示。已知在0 ℃和40 ℃时,1,2加成产物与1,4加成产物的比例分别为70∶30和15∶85。下列说法正确的是( )
A.1,2加成产物比1,4加成产物稳定
B.与0 ℃相比,40 ℃时1,3丁二烯的转化率增大
C.从0 ℃升至40 ℃,1,2加成正反应速率增大,1,4加成正反应速率减小
D.从0 ℃升至40 ℃,1,2加成正反应速率的增大程度小于其逆反应速率的增大程度
题组三 “控制变量法”探究影响化学反应速率的因素
3.(2022福建厦门模拟)将0.48 g镁粉分别加入10.0 mL下列介质中,反应6小时,用排水法收集产生的气体,介质组成与H2体积(已换算成标准状况下的体积)的关系如下表。下列说法不正确的是( )
A.由实验2、3可得,NHeq \\al(+,4)浓度越大,镁和水反应速率越快
B.由实验1、4、5可得,Cl-对镁和水的反应有催化作用
C.由实验3、7可得,反应过程产生的Mg(OH)2覆盖在镁表面,减慢反应
D.无论酸性条件还是碱性条件,NHeq \\al(+,4)都能加快镁和水的反应
4.(2022北京检测)研究不同条件对同体积同浓度的H2O2分解速率的影响,得到如下结果。由此不能得出的结论是( )
A.Cu2+与Fe3+对H2O2分解都有催化作用,但Cu2+催化效果更好
B.由Ⅰ与Ⅱ可知其他条件相同时,时间越长,H2O2分解越彻底
C.由Ⅰ与Ⅲ可知其他条件相同时,温度越高,H2O2分解越快
D.由Ⅰ与Ⅲ可知其他条件相同时,碱性越强,H2O2分解越快
考点 化学反应速率相关图像
1.速率—时间图像
此类图像的分析要抓住各个阶段影响速率的主要因素。如:Zn与足量盐酸的反应,反应速率随时间的变化曲线如图所示:
2.平衡建立图像
3.外界条件对化学反应速率的影响图像
(1)浓度对反应速率的影响
(2)温度对反应速率的影响
(3)压强对反应速率的影响[以反应aA(g)+bB(g)cC(g)+dD(g)为例]
a+b>c+d
(4)催化剂对反应速率的影响(未特殊说明,催化剂为正催化剂)
4.速率—温度(压强)图像
以可逆反应mA(g)+nB(g)pC(g)+qD(g)
ΔH为例:
(1)升高温度
(2)增大压强
(3)分析
改变温度或改变气体反应的压强,对正、逆反应速率的影响是相同的,但影响的程度可能不同。
①温度的影响:升高(降低)温度对吸热反应方向的反应速率影响程度较大。
②压强的影响:增大(减小)压强,化学计量数之和大的一侧反应速率增大(减小)的程度大。
(4)方法规律
有交点:正、逆反应速率曲线的交点右侧,哪条曲线在上,温度(或压强)对该方向的反应速率的影响程度就较大,该方向的反应就是吸热反应(或气体分子数减小的反应)。
题组一 时间—速率图像
1.(2022北京海淀区检测)把镁条(去除氧化膜)投入到盛有盐酸的敞口容器中,产生H2的速率v与时间t的关系如图所示,其中影响AB段速率的主要因素是( )
A.H+的浓度 B.体系的压强
C.溶液的温度 D.Cl-的浓度
2.(2022黑龙江大庆铁人中学模拟)可逆反应mA(g)+nB(g)pC(g)+qD(g)的vt图像如图甲所示。若其他条件都不变,只在反应前加入合适的催化剂,则其vt图像变化如图乙所示。下列判断不正确的是( )
A.a1t2
D.平衡时图甲和图乙中反应限度相同
题组二 物质的量(浓度)—时间图像
3.(2021广东化学)反应X===2Z经历两步:①X―→Y;②Y―→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是( )
A.a为c(X)随t的变化曲线
B.t1时,c(X)=c(Y)=c(Z)
C.t2时,Y的消耗速率大于生成速率
D.t3后,c(Z)=2c0-c(Y)
4.(2022浙江宁波十校模拟)某温度下,在容积为2 L的恒容密闭容器中投入一定量的A、B发生反应3A(g)+bB(g)cC(g) ΔH=-Q kJ·ml-1(Q>0),12 s时反应达到平衡,生成C的物质的量为0.8 ml,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。下列说法正确的是( )
A.前12 s内,A的平均反应速率为0.025 ml·L-1·s-1
B.12 s后,A的消耗速率与B的生成速率比值为3∶1
C.化学计量数之比b∶c=1∶1
D.12 s内,A和B反应放出的热量为0.2Q kJ
题组三 速率与外界条件图像
5.(2022唐山模拟)如图表示反应N2(g)+3H2(g)2NH3(g) ΔH=-92.2 kJ· ml-1 在t0~t6时间段内反应速率的变化图,已知在t1、t3、t4时改变外界条件,每次外界条件的改变都是单一条件的改变。下列有关说法正确的是( )
A.t1时改变的条件是压缩反应容器
B.t3时改变条件后反应的正活化能和ΔH均下降
C.平衡常数K(t0~t1)>K(t2~t3)=K(t5~t6)
D.氨气的体积分数φ(t2~t3)>φ(t3~t4)>φ(t5~t6)
6.已知:A(g)+2B(g)3C(g) ΔH
相关试卷
这是一份高考化学 化学反应速率和化学平衡 专项训练(WORD版) 答案解析,共10页。试卷主要包含了4-1,不参与反应的气体 减小等内容,欢迎下载使用。
这是一份高考化学 化学能与热能 专项训练(WORD版),共18页。试卷主要包含了化学反应中的能量变化,反应热和焓变,吸热反应和放热反应,燃烧热和中和热,热化学方程式等内容,欢迎下载使用。
这是一份高考化学 化学能与热能 专项训练(WORD版) 答案解析,共7页。试卷主要包含了物质 能量 质量 能量,3 kJ·ml-1 环形 泡沫,6 kJ·ml-1,4 L,D错误等内容,欢迎下载使用。









