



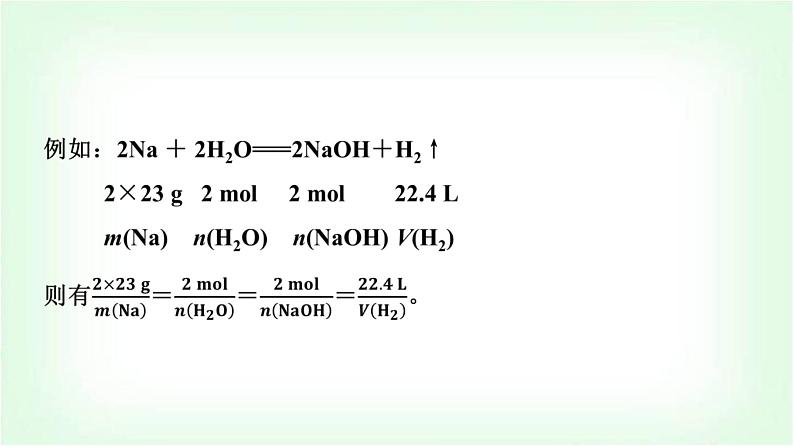


所属成套资源:全套人教版高中化学必修第一册课时教学课件
人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量课文配套课件ppt
展开
这是一份人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量课文配套课件ppt,共60页。PPT课件主要包含了粒子数目,物质的量,守恒法,随堂评估·知能落实,S~H2SO4,3mol,1mol,12L,Na2CO3,碳原子守恒等内容,欢迎下载使用。
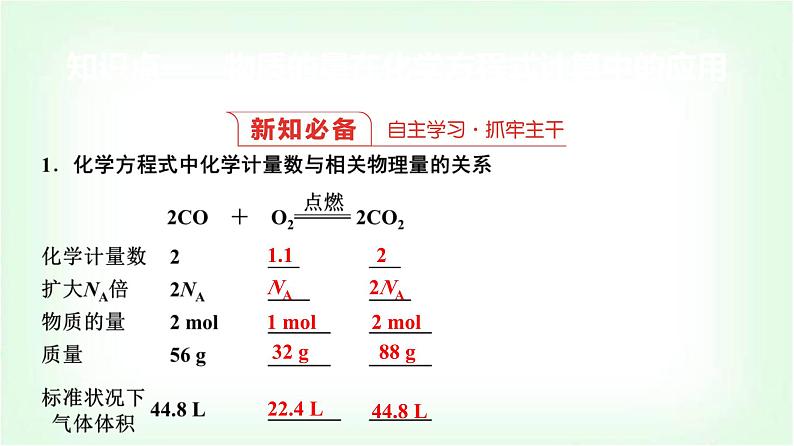
知识点一 物质的量在化学方程式计算中的应用
结论:(1)化学方程式中各物质的化学计量数之比等于其________之比,等于其________之比。(2)对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于其____之比。
2.物质的量应用于化学方程式计算的基本步骤
特别提醒 有关物质的量的计算中的“三个规范”(1)书写规范:各种符号的书写要规范,大写字母与小写字母的意义各不相同。如“M”表示摩尔质量,而“m”表示质量,“N”表示微粒数,而“n”表示物质的量。
(2)符号规范:①设未知数直接用各物理量的符号表示,且要注明物质(或粒子)的符号。如设参加反应的HCl溶液的体积为V[HCl(aq)]。②各物理量及单位、物质的名称、公式等尽量用符号表示。如已知NaOH溶液的体积和物质的量浓度,求NaOH溶液的质量时就写成:m(NaOH)=c(NaOH)×V[NaOH(aq)]×M(NaOH)。(3)单位规范:把已知量代入计算式中计算时都要带单位且单位要统一。
1.标准状况下,3.25 g锌与足量的盐酸反应生成x L氢气,下列比例式正确的是( )A.Zn+2HCl===ZnCl2+H2↑ 1 ml 1 ml 3.25 g x LC.Zn+2HCl===ZnCl2+H2↑ 1 ml 2 g 0.05 ml x L
B.Zn+2HCl===ZnCl2+H2↑ 65 g 22.4 L 3.25 g x LD.Zn+2HCl===ZnCl2+H2↑ 65 g 2 g 3.25 g x L
B [列比例关系时应注意单位要“上下一致,左右相当”。]
2.250 mL 2 ml·L-1的稀硫酸与足量的铁屑完全反应。计算:(1)参加反应的铁屑的物质的量;(2)生成的H2的体积(标准状况)。(写出解题步骤)
[答案] (1)参加反应的铁屑的物质的量为 0.5 ml。(2)标准状况下,生成H2的体积为11.2 L(步骤见解析)。
知识点二 化学计算中的常用方法
1.关系式法当已知量和未知量之间靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。(1)根据化学方程式确定关系式写出发生反应的化学方程式,根据量的关系写出关系式。例如:把CO还原Fe2O3生成的CO2通入澄清石灰水中,求生成沉淀的量。
3.差量法化学反应前后物质的量发生变化时均可用差量法。解题的一般步骤为(1)准确写出有关反应的化学方程式。(2)深入细致地分析题意,关键在于有针对性地找出产生差量的“对象”及“理论差量”。该“理论差量”可以是质量、物质的量、气体体积、压强等,且该差量的大小与参加反应的物质的有关量成正比。
2.(守恒法)将5.1 g Mg-Al合金投入250 mL 2 ml/L盐酸中,金属与盐酸恰好完全反应,又加入体积为V的 4 ml/L NaOH溶液,得到的沉淀最多为13.6 g,则V=__________________。
125 mL(或0.125 L)
4.(平均值法)两种金属混合物共15 g,投入足量的盐酸中,充分反应后得到11.2 L H2(标准状况),则原混合物的组成肯定不可能为( )A.Mg和Ag B.Zn和CuC.Al和ZnD.Al和Cu
B [本题可用平均摩尔电子质量(即提供1 ml电子所需金属的质量)法求解。反应中H+被还原生成H2,由题意可知15 g金属混合物可提供1 ml e-,其平均摩尔电子质量为15 g·ml-1。选项中金属Mg、Zn、Al的摩尔电子质量分别为12 g·ml-1、32.5 g·ml-1、9 g·ml-1,其中不能与盐酸反应的Ag和Cu的摩尔电子质量可看作无穷大。根据数学上的平均值原理可知,原混合物中一种金属的摩尔电子质量大于15 g·ml-1,另一种金属的摩尔电子质量小于15 g·ml-1。由此可判断出原混合物肯定不可能是Zn和Cu。]
1.0.56 g氧化钙恰好与20 mL盐酸反应,则此盐酸的物质的量浓度是( )A.0.10 ml·L-1 B.0.20 ml·L-1C.0.50 ml·L-1D.1.00 ml·L-1
2.将8 g铁片放入100 mL硫酸铜溶液中,溶液中的铜离子全部被还原时,固体质量变为8.2 g,则原硫酸铜溶液的物质的量浓度为( )A.0.5 ml·L-1 B.0.25 ml·L-1C.0.025 ml·L-1D.0.125 ml·L-1
4.向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,试计算:(1)Al的物质的量;(2)参加反应的NaOH的物质的量和溶液中NaOH的物质的量浓度;(3)在标准状况下生成H2的体积。
课时分层作业(二十二) 物质的量在化学方程式计算中的应用
2.将6.5 g Fe、Al合金加入足量稀硫酸中,充分反应后收集到的H2在标准状况下体积为3.36 L,则混合物中Al的质量为( )A.5.4 g B.2.7 g C.1.8 g D.0.9 g
3.由铁、锌、铝、镁四种金属中的两种组成的混合物10 g,与足量的盐酸反应产生的氢气在标准状况下的体积为11.2 L,则混合物中一定含有的金属是( )A.铁B.锌 C.铝D.镁
4.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。反应中镁和铝的( )A.物质的量之比为3∶2B.质量之比为3∶2C.摩尔质量之比为2∶3D.消耗硫酸的物质的量之比为2∶3
A [由题图可知,两个反应生成的氢气一样多,说明两种金属提供的电子数目一样多,则镁、铝的物质的量之比为3∶2,质量之比为4∶3, A项正确、B项错误;镁、铝的摩尔质量之比为8∶9,C项错误;由于反应生成的氢气一样多,则消耗硫酸的物质的量之比为1∶1,D项错误。]
5.将8.0 g镁铁合金加入500 mL稀盐酸中恰好完全反应,得到标准状况下氢气4.48 L。下列有关说法正确的是( )A.该合金中镁、铁的物质的量之比为2∶1B.反应中转移电子0.5 mlC.该盐酸的物质的量浓度为0.8 ml·L-1D.将标准状况下8.96 L HCl气体溶于500 mL水中即可配制成该盐酸
(选择题有一个或两个选项符合题目要求)8.将11.2 g铁粉加入250 mL 2 ml·L-1的氯化铁溶液中,充分反应后,下列说法正确的是( )A.铁没有剩余,溶液呈浅绿色 B.往溶液中滴入KSCN溶液,不显红色C.Fe2+与Fe3+的物质的量之比为6∶1D.氧化产物与还原产物的物质的量之比为2∶5
9.某学校化学兴趣小组从文献资料上获得如下信息:NaHCO3在潮湿空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该兴趣小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:(1)在一个质量为a g的蒸发皿中加入一些样品,称得总质量为b g。用酒精灯对其充分加热,冷却后称得其总质量为c g。残留在蒸发皿中的固体是____________________(填化学式)。
(2)另取相同质量的样品放入锥形瓶中,实验装置如图所示。为了保证实验成功,所选用针筒的最大刻度值应大于_______________mL(设实验在标准状况下进行)。
10.实验室有一包久置的生铁粉末(成分为碳、铁和氧化铁)。为测定各组分的质量分数,取两份质量均为m g的生铁粉末样品1和样品2,分别进行如图实验。Ⅰ.测定碳的含量
已知:过氧化氢溶液能将Fe2+转化为Fe3+。(1)步骤①的操作名称为________。(2)溶液乙与过氧化氢溶液发生反应的离子方程式为________________________________________,检验硫酸铁溶液中Fe3+存在的试剂是_____________。
H2O2===2Fe3++2H2O
(3)若无装置乙,会导致测得氧化铁的质量分数________(填“偏大”“偏小”或“不变”)。(4)装置戊的作用为________________________________。(5)原样品中氧化铁的质量分数为________________。
防止空气中水蒸气进入装置丁
[解析] Ⅰ.样品1(成分为碳、铁和氧化铁)中加入足量稀硫酸,然后过滤,得到滤渣甲为0.36 g碳,滤液乙中加入过氧化氢溶液,将硫酸亚铁转化为硫酸铁,硫酸铁溶液加入过量的氢氧化钠溶液,再经过过滤,得到滤渣丙为17.12 g氢氧化铁。Ⅱ.甲中锌和稀硫酸反应产生氢气,乙中浓硫酸进行干燥,丙中生铁粉末(成分为碳、铁和氧化铁)被氢气还原,丁中浓硫酸吸收水,戊中生石灰防止空气中水蒸气进入丁。
(1)操作①是分离不溶性固体的操作,为过滤。(2)滤液乙加入具有氧化性的过氧化氢与亚铁离子发生氧化还原反应,2Fe2++2H++H2O2===2Fe3++2H2O ;Fe3+与SCN-反应生成红色的Fe(SCN)3,可用于检验Fe3+。(3)装置乙的作用是吸收水,若无装置乙,氢气中含有的水蒸气能被装置丁吸收,会导致测得氧化铁的质量分数偏大。(4)根据分析,戊中的生石灰用来吸收空气中水蒸气,防止进入装置丁。
相关课件
这是一份人教版 (2019)必修 第一册第二节 金属材料教学ppt课件,共52页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第二节 金属材料教课课件ppt,共35页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量教学ppt课件,共32页。









