






所属成套资源:全套鲁科版高中化学选择性必修第一册课时教学课件
鲁科版高中化学选择性必修第一册第1章第2节第3课时新型化学电源能力课课件
展开
这是一份鲁科版高中化学选择性必修第一册第1章第2节第3课时新型化学电源能力课课件,共60页。
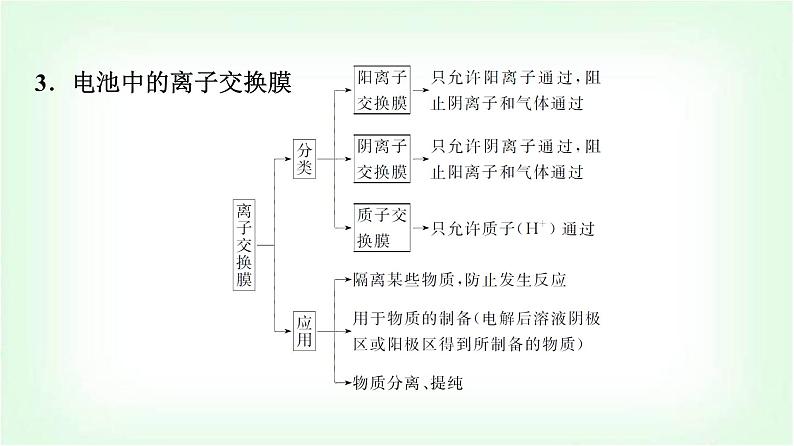
第3课时 新型化学电源(能力课)第1章 化学反应与能量转化 第2节 化学能转化为电能——电池1.知道常考新型化学电源的类型及考查方式。2.会分析新型化学电源的工作原理,能正确书写新型化学电源的电极反应式。1.高铁电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。(1)写出该电池放电时的负极反应:Zn-2e-+2OH-===Zn(OH)2。(2)根据该电池的总反应分析电池工作时,正极附近溶液的pH变大。(3)给该电池充电时应该怎样连接电极:正极接外接电源正极,负极接外接电源负极。 1.浓差电池:由于两极间电解质浓度不同或电极上反应物的浓度不同而产生电动势的一类电池。2.工作原理:两侧半电池中的特定物质存在浓度差,离子由“高浓度”移向“低浓度”形成电流。阴离子→ 负极区、阳离子→正极区。探究要点 挑战创新浓差电池3.电池中的离子交换膜 1.构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”。当电解质中某离子的浓度越大时其氧化性或还原性越强。如图将两个银电极插入不同浓度的AgNO3溶液中(c2>c1),实验开始观察到灵敏电流计的指针偏转,下列说法正确的是( )A.B极电极反应为Ag-e-===Ag+B.Ag+穿过交换膜由A极区移向B极区C.电流计指针偏转幅度始终不变D.A极发生氧化反应,A极区AgNO3溶液浓度不断增大√D [当电解质中某离子的浓度越大时其氧化性或还原性越强,AgNO3溶液中(c2>c1),则B极为正极,电极反应为Ag++e-===Ag,A错误;图示为阴离子交换膜,只允许阴离子通过,B错误;随着反应进行,浓度差有变化,则电流计指针偏转幅度也有变化,C错误;B极为正极,A极为负极,失电子发生氧化反应,电极反应式为Ag-e-===Ag+,生成银离子,A极区AgNO3溶液浓度不断增大,D正确。] 2.(双选)利用热再生氨电池可实现CuSO4电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的CuSO4电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是( )A.甲室Cu电极为正极B.隔膜为阳离子膜C.电池总反应为Cu2++4NH3===[Cu(NH3)4]2+D.NH3扩散到乙室将对电池电动势产生影响√√ 1.锂电池锂电池是一类由金属锂或锂合金为负极材料、使用非水电解质溶液的电池。锂电池的负极材料是金属锂或锂合金,电极反应均为Li-e-===Li+。锂电池与锂离子电池2.锂离子二次电池(1)构成:锂离子电池负极是Li(常嵌入到C中,如LixC6),正极常采用LiCoO2、LiNiO2或LiMn2O4。(2)实例:电池总反应:LixC6+Li3-xNiCoMnO6 C6+Li3NiCoMnO6。①放电负极:LixC6-xe-===xLi++C6;正极:Li3-xNiCoMnO6+xe-+xLi+===Li3NiCoMnO6。 ②充电阴极:xLi++C6+xe-===LixC6;阳极:Li3NiCoMnO6-xe-===Li3-xNiCoMnO6+xLi+。1.一种锂离子电池放电时的反应原理可表示为LixC6+Li1-xCoO2 ===6C+LiCoO2(x






