






所属成套资源:全套鲁科版高中化学选择性必修第一册课时教学课件
鲁科版高中化学选择性必修第一册第1章第3节第1课时电解的原理基础课课件
展开
这是一份鲁科版高中化学选择性必修第一册第1章第3节第1课时电解的原理基础课课件,共60页。
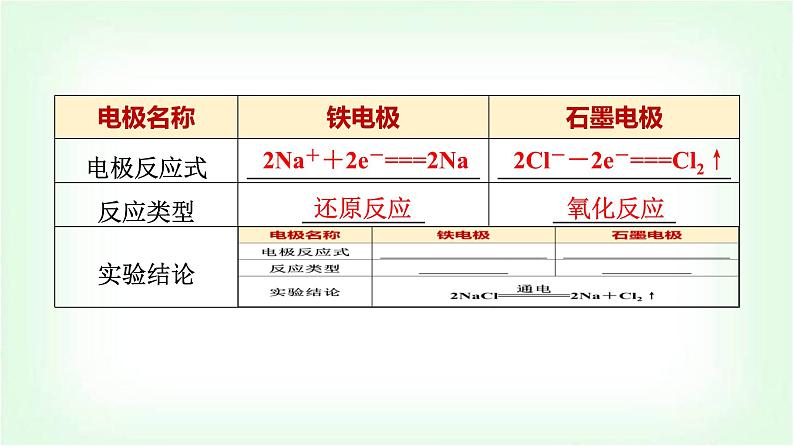
第1课时 电解的原理(基础课)第1章 化学反应与能量转化 第3节 电能转化为化学能——电解1.能通过对电解熔融氯化钠的探究,了解电解池的构成、工作原理,能正确书写电极反应式、电解总反应式。2.通过对常见物质的电解产物的分析,归纳出电极放电规律。1.固体氯化钠不能导电,但NaCl在水溶液或熔融状态下可发生电离,其电离方程式为NaCl===Na++Cl-,因此熔融的NaCl中含有的离子是Na+和Cl-。水是一种极弱的电解质,可发生微弱的电离产生极少量的H+和OH-,因此NaCl溶液中含有Na+、Cl-、H+、OH-四种离子。2.根据金属活动性顺序表,可得还原性顺序Zn>Fe>Sn> Pb>H2>Cu>Ag,则对应离子Zn2+、Fe2+、Sn2+、Pb2+、H+、Cu2+、Ag+氧化性由强到弱的顺序为Ag+>Cu2+>Pb2+ >Sn2+>Fe2+>Zn2+。3.常见非金属单质的氧化性Cl2>Br2>I2>S,则对应阴离子的还原性由强到弱的顺序为S2->I->Br->Cl-。一、电解熔融氯化钠实验1.实验装置必备知识 自主预习2.实验现象及分析 阳离子(Na+)阴离子(Cl-)2Na++2e-===2Na2Cl--2e-===Cl2↑还原反应氧化反应判一判 (正确的打“√”,错误的打“×”)(1)熔融NaCl中,Na+、Cl-处于自由运动状态。 ( )(2)电解熔融NaCl的装置中,Na+向阳极移动,Cl-向阴极移动。 ( )(3)电解质溶液导电是化学变化,金属导电是物理变化。 ( ) √×√二、电解和电解池 氧化还原电化学正极氧化负极还原负阴阳正阳阴想一想 某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在图中。请你分析电极a、b、c、d的名称以及Q离子是阴离子还是阳离子?提示:根据题图知,该装置有外接电源,所以属于电解池,根据电子流向知,c是负极,d是正极,a是阴极,b是阳极,电解时,电解质溶液中阳离子向阴极移动,阴离子向阳极移动,则Q离子是阳离子,P离子是阴离子。关键能力 情境探究实验目的:以电解氯化铜溶液为例研究电解的基本原理。实验步骤:在U形管中注入CuCl2溶液,插入两根石墨棒作电极(如图),把湿润的淀粉碘化钾试纸放在与直流电源正极相连的电极附近,接通电源。实验现象:阴极石墨棒上逐渐覆盖了一层红色的铜,在阳极石墨棒上有刺激性气味气体产生,且使湿润的淀粉碘化钾试纸变成蓝色。 电解池工作原理1.分析上述电解池工作时,电子的流向、离子的运动方向,并在上图的基础上,绘制出电解池工作时,是如何构成闭合回路的?提示:接通外接电源后,电子从电源的负极沿导线流入电解池的阴极,阳离子向阴极移动,在阴极上得电子,发生还原反应,阴离子向阳极移动,在阳极上失去电子,发生氧化反应,电子从阳极流出,并沿导线流回电源的正极,如图所示。2.根据上述实验现象分析,电解过程中在阴极、阳极上各发生什么反应?其电极反应分别是什么?电解的总反应是什么? 1.电解池的工作原理2.电解时电极产物的判断──“阳失阴得” 3.电解池的阴极、阳极的判断方法 4.电解池电极反应及电解总反应的书写步骤 1.用惰性电极电解稀硫酸、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上析出的物质分别是( )A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2 √2.(双选)图a~c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极)微观示意图。下列说法正确的是( )A.图示中的 代表的离子的电子式为B.图a中放入的是氯化钠固体,该条件下能导电C.能导电的装置中,X上均有气体产生D.能导电的装置中,Y的电极产物相同√√AC [图a表示NaCl固体,NaCl固体中含有Na+和Cl-,由于Cl-半径大于Na+半径,因此图示中的 代表的离子为Cl-,电子式为 ,A正确;氯化钠固体中离子不能自由移动,固体不导电,B错误;图b和图c装置中,电解质都能导电,X为阳极,都发生反应2Cl--2e-===Cl2↑,均有气体产生,C正确;图b和图c装置都能导电,图b中Y的电极产物为Na,图c中Y的电极产物为H2等,D错误。][教材 知识支持]将等物质的量的KI和CuCl2溶于水,用惰性电极电解,该电解反应可分为______个阶段(填表不一定填满)。4CuI2 CuCl2 KCl KOH 用惰性电极电解电解质水溶液的规律1.利用图中装置分别电解Na2SO4溶液、NaOH溶液和稀硫酸能产生装置中的现象吗?为什么?提示:能。因为电解Na2SO4溶液、NaOH溶液、稀硫酸实质上都是电解水。阳极(A试管内)发生:4OH--4e-===O2↑+2H2O;阴极(B试管内)发生:4H++4e-===2H2↑。2.利用图中装置分别电解饱和NaCl溶液、NaNO3溶液产生的现象相同吗?为什么?提示:不相同。因为电解饱和NaCl溶液,阳极(A试管内)发生:2Cl--2e-===Cl2↑,阴极(B试管内)发生:2H++2e-===H2↑,若不考虑Cl2、H2的溶解,理论上气体体积相同;电解NaNO3溶液实质是电解水,阳极(A试管内)发生:4OH--4e-===2H2O+O2↑,阴极(B试管内)发生:4H++4e-===2H2↑,两者的体积比为1∶2。易错提醒对于电解水型的电解池,阳极OH-放电,剩余H+,故阳极附近溶液中c(H+)大于c(OH-),溶液显酸性;阴极H+放电,剩余OH-,故阴极附近溶液中c(OH-)大于c(H+),溶液显碱性。因此,一般阳极OH-放电产生O2时,阳极附近溶液显酸性,阴极H+放电产生H2时,阴极附近溶液显碱性。【例题】 (双选)用惰性电极进行下列电解,有关说法正确的是( )①电解稀硫酸 ②电解Cu(NO3)2溶液③电解KOH溶液 ④电解NaCl溶液A.通电进行一段时间后四份溶液的pH均增大B.反应②中通电一段时间后,向溶液中加入适量的CuO固体可使溶液恢复到电解前的情况C.反应③中阳极消耗OH-,故溶液浓度变小D.反应④中阴、阳两极上气体产物的物质的量之比为1∶1√√BD [依据电解规律可知①为电解水型,②为放氧生酸型,③为电解水型,④为放氢生碱型,所以A、C错误;反应②电解产物为Cu和O2,所以加氧化铜固体可恢复,B正确;反应④阳极产生Cl2,阴极产生H2,物质的量之比为1∶1,D正确。][母题发散](1)反应③、④中需向溶液中加入什么物质可复原?(2)反应②中向溶液中加入Cu(OH)2可复原吗?提示:(1)③加H2O、④加HCl。(2)不可,因为Cu(OH)2和CuO相比,多了H2O,不能恢复到原浓度。方法技巧电解后溶液复原时遵循的原则少什么(元素的种类及原子个数比)加什么(按所少元素原子个数比组合成一种新物质加入)。1.用惰性电极电解Na2SO4、AgNO3、KCl的混合液,最先从阴极和阳极上析出的物质分别是( )A.H2和Cl2 B.Ag和Cl2 C.H2和O2 D.Ag和O2 √2.用惰性电极电解下列各组中的三种溶液,电解过程中,溶液中pH依次为减小、不变、增大的是( )A.HCl、HNO3、K2SO4B.AgNO3、CuCl2、Cu(NO3)2C.CaCl2、KOH、NaNO3D.CuSO4、Na2SO4、KCl √1.电解池:电能转化为化学能的装置。2.阳极:发生氧化反应、电子流出、阴离子移向的电极;阴极:发生还原反应、电子流入、阳离子移向的电极。3.阳极放电顺序:活性电极>阴离子(还原性强的阴离子先放电);阴极放电顺序:氧化性强的阳离子先放电。51.下列说法正确的是( )A.电解KCl溶液时,阴极上的电极反应为K++e-===KB.电解熔融NaCl的装置中,Na+向阳极移动、Cl-向阴极移动C.用石墨作电极电解熔融MgCl2,阴极上析出单质镁,阳极上会有气体产生D.在电解装置中,电子从阴极通过电解质溶液流向阳极学习效果 随堂评估√243题号15243题号1C [电解KCl溶液时,根据离子的放电顺序,阴极上H+得电子,即2H++2e-===H2↑,A项错误;接通电源后阴离子向阳极移动,阳离子向阴极移动,B项错误;用石墨作电极电解熔融MgCl2时,Mg2+在阴极上得电子,被还原,得到单质Mg,Cl-在阳极失电子被氧化,得到Cl2,C项正确;电解池中,电子不能通过电极进入电解质溶液,D项错误。]52.用石墨作电极,分别电解下列各物质的溶液:①CuCl2 ②CuSO4 ③NaCl ④NaNO3 ⑤HCl ⑥H2SO4 ⑦KOH。其中只有水被电解的有( )A.①②⑤ B.②④⑥⑦ C.④⑥⑦ D.③⑤⑥⑦23题号14√523题号14C [用石墨作电极,离子的放电顺序,阳极:S2->I->Br->Cl-> OH->含氧酸根离子,阴极:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水),所以①CuCl2溶液中放电的是铜离子和氯离子,CuCl2被电解;②CuSO4溶液中放电的是铜离子和氢氧根离子,硫酸铜和水都被电解;③NaCl溶液中放电的是氯离子和氢离子,氯化钠和水都被电解;④NaNO3溶液中放电的是氢离子和氢氧根离子,只有水被电解;⑤HCl溶液中放电的是氢离子和氯离子,氯化氢被电解;⑥H2SO4溶液中放电的是氢离子和氢氧根离子,只有水被电解;⑦KOH溶液中放电的是氢离子和氢氧根离子,只有水被电解。故只有水被电解的是④⑥⑦。]53.(双选)如图,两电极上发生的电极反应为a极:Cu2++2e-=== Cu;b极:Fe-2e-===Fe2+。下列说法正确的是( )A.装置中电解质溶液一定含有Cu2+B.该装置一定是化学能转化为电能C.a、b可能是同种电极材料D.a极上一定发生氧化反应23题号41√√523题号41AC [该装置既可构成原电池,也可构成电解池。当构成原电池时,a极材料是活动性比铁差的金属或石墨,b极材料为铁,电解质溶液含Cu2+;当构成电解池时,a极作阴极,b极作阳极且必须是铁电极,电解液中含Cu2+,A、C项符合题意。]5243题号14.某同学用如下装置进行实验①和②,在相同时间内,记录现象如下(溶液的温度变化均不明显)。5243题号1 √5243题号1D [利用惰性电极电解饱和Ca(OH)2溶液,在阴极,水电离出的氢离子得电子生成氢气,电极反应式为2H2O+2e-===H2↑+2OH-,A错误;②中阳极区产生白色浑浊,分离出该白色固体,加酸溶解,产生气泡,说明该白色浑浊的主要成分为碳酸钙,B错误;②中阳极上氢氧根离子失电子生成氧气,氧气与电极材料石墨反应生成二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙,这是产生白色浑浊的主要原因,C错误,D正确。]243题号15.如图是用铂丝做电极,电解稀MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色[指示剂变色范围的pH为6.8~8.0,酸性-红色,碱性-黄色,Mg(OH)2开始沉淀的pH=9]。接通电源一段时间后A管产生白色沉淀,回答下列问题:5243题号1(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是______(填编号)。①A管溶液由红变黄 ②B管溶液由红变黄 ③A管溶液不变色 ④B管溶液不变色(2)写出A管中发生的反应:_______________________________________________________________________________________。(3)写出B管中发生的反应:_______________________________________________________________________________________。5①④2H++2e-===H2↑、Mg2++2OH-=== Mg(OH)2↓[或2H2O+2e-+Mg2+===H2↑ +Mg(OH)2↓]4OH--4e-===2H2O+O2↑(或2H2O-4e-===O2↑ +4H+)243题号1(4)检验b管中气体的方法是________________________________________________________________________________________。(5)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是___________________________________________________。5 用拇指堵住管口,取出试管,放开拇指,将带有火星的木条伸入试管内,木条复燃白色沉淀溶解,溶液呈红色课时分层作业(七) 电解的原理题号135246879101112(选择题只有一个选项符合题目要求)1.用惰性电极电解足量的Cu(NO3)2溶液,下列说法中不正确的是( )A.阴极发生的电极反应为Cu2++2e-===CuB.阳极发生的电极反应为2H2O-4e-===4H++O2↑C.若有6.4 g金属Cu析出,放出的O2为0.05 molD.恰好电解完时,加入一定量的Cu(NO3)2使溶液恢复到原来的浓度√1314题号135246879101112D [用惰性电极电解足量的Cu(NO3)2溶液,阴极发生的电极反应为Cu2++2e-===Cu,阳极发生的电极反应为2H2O-4e-===4H++O2↑,若有6.4 g金属Cu(即0.1 mol)析出,转移电子是0.2 mol,放出的O2为0.05 mol,恰好电解完时,应加入一定量的CuO使溶液恢复到原来的浓度,A、B、C正确,D错误。]1314题号135246879101112 √1314题号135246879101112 1314题号1352468791011123.有关甲、乙、丙、丁四个图示的叙述正确的是( )√1314A.甲中负极反应为2H++2e-===H2↑B.乙中阳极反应为Ag++e-===AgC.丙中H+向碳棒方向移动D.丁中电解开始时阳极产生黄绿色气体题号135246879101112C [由图知,甲、丙为原电池,甲中Zn为负极,负极反应为Zn-2e-===Zn2+,A错;丙中Fe为负极,C为正极,H+向正极移动,C对;乙、丁为电解池,乙中Ag作阳极,本身失电子,B错;丁中放电顺序:I->Cl-,电解开始时阳极产生I2,D错。]1314题号1352468791011124.电解100 mL含c(H+)=0.3 mol·L-1的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是( )A.0.10 mol·L-1 Ag+B.0.20 mol·L-1 Cu2+C.0.30 mol·L-1 Mg2+D.0.40 mol·L-1 Ca2+√1314题号135246879101112B [A.Ag+在H+之前放电,0.10 mol·L-1 Ag+中Ag+物质的量为0.01 mol,电路中通过0.04 mol电子时,Ag+已经全部放电,析出金属银的质量是1.08 g;B.Cu2+在H+之前放电,0.20 mol·L-1Cu2+中Cu2+的物质的量为0.02 mol,电路中通过0.04 mol电子时,Cu2+已经全部放电,析出金属铜的质量是1.28 g;C.Mg2+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属Mg;D.Ca2+的放电顺序在H+后面,所以含有这种阳离子的盐溶液中,阴极上放出H2,不会析出金属Ca。]1314题号135246879101112 √1314题号135246879101112 1314题号1352468791011126.关于下图所示①、②两个装置的叙述,正确的是( )A.装置名称:①是原电池,②是电解池B.硫酸浓度变化:①增大,②减小C.电极反应:①中阳极:2H2O-4e-===4H++O2↑,②中正极:Zn-2e-===Zn2+D.离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动√1314题号135246879101112B [①中有外加电源,为电解池,②为原电池,A项错误;①中电解水,硫酸浓度增大,②中消耗硫酸,硫酸浓度减小,B项正确;②中正极反应为2H++2e-===H2↑,C项错误;②中H+向正极移动,D项错误。]1314题号1352468791011127.如图所示,甲池的总反应式为2CH3OH+3O2+4KOH=== 2K2CO3+6H2O。下列说法正确的是( )1314题号135246879101112 1314√题号135246879101112 1314题号1352468791011128.用Pt做电极,电解含c(Cu2+)∶c(Na+)∶c(Cl-)=1∶2∶4的混合溶液,在任何情况下,阴、阳两极下不可能同时发生的反应是( )A.阴极:2H++2e-===H2↑ 阳极:4OH--4e-===2H2O+O2↑B.阴极:2H++2e-===H2↑ 阳极:2Cl--2e-===Cl2↑C.阴极:Cu2++2e-===Cu 阳极:4OH--4e-===2H2O+O2↑D.阴极:Cu2++2e-===Cu 阳极:2Cl--2e-===Cl2↑√1314题号135246879101112C [阳离子的放电顺序:Cu2+> H+;阴离子的放电顺序:Cl-> OH-;c(Cu2+)∶c(Cl-)=1∶4;H+、OH-来源于溶液中水的电离;Cu2+和OH- 不能同时在阴极和阳极放电,C项符合题意。]1314题号1352468791011129.用如图所示的装置进行电解。通电一会儿,发现湿润的淀粉-KI试纸的C端变为蓝色。1314题号135246879101112(1)E为电源的_____极,F为电源的_____极。(2)A中发生反应的化学方程式为______________________________________________________________________________________。(3)D端的电极反应为_______________________________________。1314负正 4Ag+4HNO3+O2↑ 2H2O+2e-===2OH-+H2↑题号135246879101112[解析] 本题实质上是三个电解装置串联,首先判断电源的正、负极,根据C端变为蓝色可知,C端为阳极,D端为阴极,则E为负极,F为正极。A中是以Pt为阳极、Fe为阴极电解AgNO3溶液的电解池。D端为阴极,发生的电极反应为2H2O+2e-===2OH-+H2↑。1314题号135246879101112(选择题有一个或两个选项符合题目要求)10.用电解法可提纯含有某些含氧酸根离子杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是( )1314A.阳极反应为4OH--4e-===2H2O+O2↑B.通电后阴极区附近溶液pH会减小C.K+通过阳离子交换膜从阴极区移向阳极区D.提纯的KOH溶液从b出口导出√√题号135246879101112BC [电解除杂过程相当于电解水,阳极反应为4OH--4e-===2H2O+O2↑,A项正确;电解时,阴极反应为2H2O+2e-===2OH-+H2↑,氢氧根离子浓度增大,氢离子浓度减小,溶液的pH增大,B项错误;K+通过阳离子交换膜从阳极区移向阴极区,C项错误;在阴极附近产生氢氧根离子,钾离子向阴极移动,所以除去杂质后氢氧化钾溶液从b出口导出,D项正确。]1314题号13524687910111211.用惰性电极电解含0.2 mol CuSO4的溶液一段时间后,阳极上生成标准状况下4.48 L气体,欲使电解质溶液恢复电解前的状况,应加入( )A.0.2 mol CuSO4 B.0.2 mol CuOC.0.2 mol Cu(OH)2 D.0.2 mol CuCO3√1314题号135246879101112 1314题号13524687910111212.为增强铝的耐腐蚀性,现以铅蓄电池为外电源(左池),以Al作阳极、Pb作阴极,电解稀硫酸(右池),使铝表面的氧化膜增厚。反应原理如下:1314题号135246879101112 1314√√题号135246879101112 1314题号13524687910111213.如图所示,X和Y均为石墨电极:1314(1)若电解液为滴有酚酞溶液的饱和食盐水,电解反应的离子方程式为___________________________________________________________________。电解过程中________(填“阴” 或“阳” )极附近会出现红色。 +H2↑ +2OH-阴题号135246879101112(2)若电解液为500 mL含A溶质的某蓝色溶液,电解一段时间,观察到X电极表面有红色固体生成,Y电极有无色气体生成。当溶液中原有溶质完全电解后,取出X电极,洗涤、干燥、称量,电极增重1.6 g。①电解后溶液的c(H+)=___________。要使电解后溶液恢复到电解前的状态,需加入一定量的_________________(填物质的化学式,假设电解前后溶液的体积不变)。13140.1 mol·L-1CuO(或CuCO3)题号135246879101112②请推测原溶液中所含的酸根离子可能是_______________。设计实验验证推测,写出实验的操作步骤、现象和结论:______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。1314 取少量待测液于试管中,滴加盐酸无明显现象,继续滴入氯化钡溶液,若有白色沉淀产生,则证明含有硫酸根离子(或取少量待测液于试管中,滴加浓硫酸,再加入铜粉,若有红棕色气体产生,则证明含有硝酸根离子)题号135246879101112 1314题号13524687910111214.A、B、C为三种强电解质,它们在水中电离出的离子如下表所示:1314题号135246879101112图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。1314接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。据此回答下列问题:题号135246879101112(1)M为电源的______(填“正” 或“负” )极,电极b上发生的电极反应为_____________________________________________。(2)写出乙烧杯中的电池总反应:_______________________________________________________________________________________。1314负4OH--4e-===2H2O+O2↑ O2↑ +2H2SO4题号135246879101112(3)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?___________________________________________________________________________________________________。(4)若经过一段时间后,要使丙恢复到原来的状态,需要进行的操作是_______________________________________________________。1314能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水的反应向丙烧杯中加入一定量水题号135246879101112 1314





