



所属成套资源:全套鲁科版高中化学选择性必修第一册课时教学课件
鲁科版高中化学选择性必修第一册第3章章末复习建构课课件
展开
这是一份鲁科版高中化学选择性必修第一册第3章章末复习建构课课件,共60页。
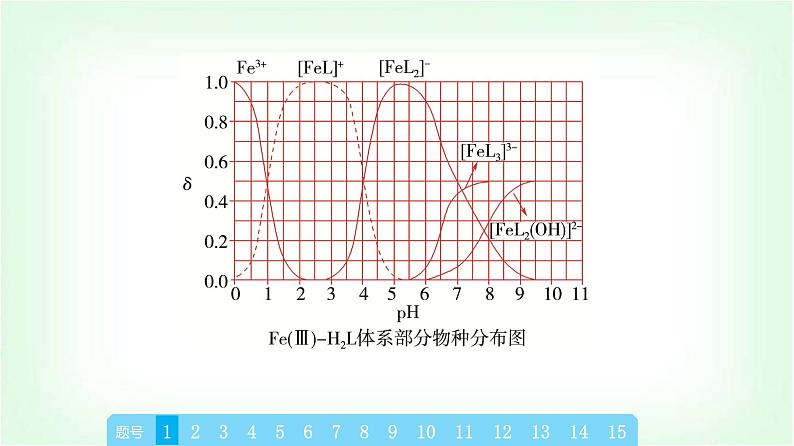
章末复习建构课第3章 物质在水溶液中的行为一、水与水溶液知识体系构建二、弱电解质的电离三、盐类的水解四、沉淀溶解平衡 高考真题体验题号135246879101112131415题号135246879101112131415A.当pH=1时,体系中c(H2L)>c([FeL]+)>c(OH-)>c(HL-)B.pH在9.5~10.5之间,含L的物种主要为L2-C.L2-+[FeL]+⥫⥬[FeL2]-的平衡常数的lg K约为14D.当pH=10时,参与配位的c(L2-)≈1.0×10-3 mol·L-1题号135246879101112131415√C [从图中可以看出Fe(Ⅲ)主要与L2-进行络合,在pH=1时,c([FeL]+)=1.0×10-4 mol·L-1,含L的物种主要为H2L,此时电离出的HL-较少,根据H2L的一级电离常数可以简单计算pH=1时溶液中c(HL-)≈5.0×10-9.46 mol·L-1,pH=1时c(OH-)=10-13 mol·L-1,因此这四种离子的浓度大小为c(H2L)>c([FeL]+)>c(HL-)>c(OH-),A错误;根据图示可以推导出,在pH≈9.9时HL-的含量最大,而H2L和L2-的含量最少,因此当pH在9.5~10.5之间时,含L的物种主要为HL-,B错误;该反应的平衡题号135246879101112131415 题号1352468791011121314152.(2023·浙江卷)草酸(H2C2O4)是二元弱酸。某小组做如下两组实验:实验Ⅰ:往20 mL 0.1 mol·L-1 NaHC2O4溶液中滴加0.1 mol·L-1 NaOH溶液。实验Ⅱ:往20 mL 0.10 mol·L-1NaHC2O4溶液中滴加0.10 mol·L-1CaCl2溶液。题号135246879101112131415 题号135246879101112√131415 题号135246879101112131415 题号135246879101112131415 题号1352468791011121314153.(2022·湖北卷)下图是亚砷酸As(OH)3和酒石酸(H2T,lg Ka1=-3.04,lg Ka2=-4.37)混合体系中部分物种的c-pH图(浓度:总As为5.0×10-4 mol·L-1,总T为1.0×10-3 mol·L-1)。下列说法错误的是( )题号135246879101112131415A.As(OH)3的lg Ka1为-9.1B.[As(OH)2T]-的酸性比As(OH)3的强C.pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高D.pH=7.0时,溶液中浓度最高的物种为As(OH)3题号135246879101112√131415D [左坐标浓度的数量级为10-3 mol·L-1,右坐标浓度的数量级为10-6 mol·L-1,横坐标为pH,随着pH的增大,c平{[As(OH)2T]-}先变大,然后再减小,同时c平{[AsO(OH)T]2-}变大,两者浓度均为右坐标,说明变化的程度很小,当pH=4.6时,c{[AsO(OH)T]2-}=c{[As(OH)2T]-},Ka=10-4.6 mol·L-1。pH继续增大,则c[As(OH)3]减小,同时c{[As(OH)2O]-}增大,当pH=9.1时,c{[As(OH)2O]-}=c[As(OH)3],Ka1=c平(H+)=10-9.1 mol·L-1,二者用左坐标表示,浓度比较大,说明变化的幅度比较大,但混合溶液中存在着酒石酸,电离常数远大于亚砷酸,且总T浓度也题号135246879101112131415 题号135246879101112131415为10-3mol·L-1,[As(OH)2T]-的浓度为右坐标,浓度的数量级为10-6 mol·L-1,所以pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高,C正确;由条件可知,酒石酸(H2T)的lg Ka1=-3.04,lg Ka2=-4.37,As(OH)3的lg Ka1为-9.1,即酒石酸的第一部电离常数远大于亚砷酸的第一步电离常数,所以酒石酸的酸性远强于As(OH)3,另外总As的浓度也小于总T的浓度,所以当pH=7.0时,溶液中浓度最高的物种不是As(OH)3,D错误。]题号135246879101112131415考向二 盐的水解4.(2023·北京卷)下列过程与水解反应无关的是( )A.热的纯碱溶液去除油脂B.重油在高温、高压和催化剂作用下转化为小分子烃C.蛋白质在酶的作用下转化为氨基酸D.向沸水中滴入饱和FeCl3溶液制备Fe(OH)3胶体题号135246879101112√131415B [因碳酸根离子水解使溶液显碱性,油脂在碱性条件下能水解生成易溶于水的高级脂肪酸盐和甘油,故可用热的纯碱溶液去除油脂,A不符合题意;重油在高温、高压和催化剂作用下发生裂化或裂解反应生成小分子烃,与水解反应无关,B符合题意;蛋白质在酶的作用下可以发生水解反应生成氨基酸,C不符合题意;Fe3+能发生水解反应生成Fe(OH)3,加热能增大Fe3+ 的水解程度,D不符合题意。]题号135246879101112131415 题号135246879101112131415A.Ka(CH3COOH)约为10-4.76 mol·L-1 B.点a:c平(Na+)=c平(Cl-)=c平(CH3COO-)+c平(CH3COOH)C.点b:c平(CH3COOH)c平(OH-)C.在CH3COONa溶液中,由水电离出的c水(OH-)≠c水(H+)D.水电离出的H+(或OH-)与盐中的弱酸根离子(或弱碱阳离子)结合,造成某些盐溶液呈碱(或酸)性章末综合测评(三) 物质在水溶液中的行为题号1352468791011121314151617181920√C [水电离出的c水(H+)=c水(OH-)一定成立;CH3COONa溶液显碱性,是由于水电离出的H+有一部分与CH3COO-结合成CH3COOH,从而使c平(H+)”“(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:题号1352468791011121314151617181920假设溶液混合前后的体积变化忽略不计,则a=______,实验②中由水电离产生的c水(OH-)=________mol·L-1。410-7(3)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:题号1352468791011121314151617181920①按丁方式混合后,所得溶液显_____性(填“酸”“碱”或“中”)。②写出按乙方式混合后,反应的离子方程式:_____________________________________________________________________________。③按甲方式混合后,所得溶液的pH为________。中 11 题号1352468791011121314151617181920 题号135246879101112131415161718192017.(12分)索尔维制碱法工艺流程如图所示,请回答下列问题:题号1352468791011121314151617181920(1)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO和Fe2O3,若某α-Fe催化剂中FeO和Fe2O3的物质的量相等,则其中Fe2+与Fe3+的物质的量之比为_______。1∶2(2)向饱和NaCl溶液中先通入NH3,效果更好。反应制得NaHCO3沉淀和NH4Cl溶液的化学方程式为__________________________________________________。(3)索尔维制碱法除了得到纯碱外,还会产生一种废渣________。侯氏制碱法在此工业上改进,不再使用CaCO3 制备CO2,而是在制备NH3的过程中制得CO2,则侯氏制碱法在得到纯碱的同时还制得了________,此物质在农业上的用途是作______。题号1352468791011121314151617181920NaCl+NH3+CO2+H2O===NaHCO3↓+NH4ClCaCl2NH4Cl氮肥[解析] (1)某α-Fe催化剂中FeO和Fe2O3的物质的量相等,则其中Fe2+与Fe3+的物质的量之比为1∶2。(2)为了增大二氧化碳的溶解性,所以向饱和NaCl溶液中先通入NH3,后通入CO2,效果更好,发生反应的化学方程式为NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl。(3)根据索尔维制碱法的流程使用CaCO3制备CO2,最后用氢氧化钙与氯化铵反应生成氨,同时生成氯化钙;而侯氏制碱法不再使用CaCO3制备CO2,在得到纯碱的同时还制得了NH4Cl,该物质在农业上的用途是作氮肥。题号135246879101112131415161718192018.(12分)蛋壳是一种很好的绿色钙源,其主要成分为CaCO3。以蛋壳为原料制备葡萄糖酸钙晶体M{[Ca(C6H11O7)2·H2O]=448 g·mol-1},并对其纯度进行测定,过程如下:题号1352468791011121314151617181920 步骤Ⅱ.产品纯度测定——KMnO4间接滴定法①称取步骤Ⅰ中制得的产品0.600 g置于烧杯中,加入蒸馏水及适量稀盐酸溶解;②加入足量(NH4)2C2O4溶液,用氨水调pH至4~5,生成白色沉淀,过滤、洗涤;③将②洗涤后所得的固体溶于稀硫酸中,用0.020 00 mol·L-1 KMnO4标准溶液滴定,消耗KMnO4标准溶液25.00 mL。题号1352468791011121314151617181920根据以上两个步骤,回答下列问题:(1)以上两个步骤中不需要使用的仪器有____(填字母)。题号1352468791011121314151617181920(2)步骤Ⅰ中“操作a”是_____________________、过滤、洗涤、干燥。C蒸发浓缩、冷却结晶(3)步骤Ⅱ中用氨水调pH至4~5的目的为_________________________________________________________________________________。(4)用KMnO4标准溶液滴定待测液的反应原理为__________________________________________________(用离子方程式表示),判断滴定达到终点的现象为__________________________________________________________________________________________________。(5)根据以上实验数据,测得产品中葡萄糖酸钙晶体的纯度为________(保留三位有效数字)。题号1352468791011121314151617181920中和溶液中的H+,增大 +6H+===2Mn2++10CO2↑+8H2O滴入最后半滴高锰酸钾标准溶液时,溶液由无色变为浅紫色,且半分钟内不褪色93.3%[解析] 蛋壳的主要成分是碳酸钙,洗涤、干燥后灼烧蛋壳,碳酸钙在高温下发生分解生成氧化钙和二氧化碳,加蒸馏水浸泡后氧化钙和水反应生成氢氧化钙,加入葡萄糖酸溶液,控制溶液pH在6~7的范围内,氢氧化钙与葡萄糖酸溶液反应生成葡萄糖酸钙和水,过滤得到葡萄糖酸钙溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到葡萄糖酸钙晶体。(1)过滤时要用到漏斗、煅烧时要用到坩埚、滴定时要用到酸式滴定管,则步骤Ⅰ和Ⅱ中不需要使用的仪器是圆底烧瓶,故答案为C;题号1352468791011121314151617181920题号1352468791011121314151617181920 题号1352468791011121314151617181920 19.(12分)(1)H3AsO4水溶液中含砷的各物种的分布系数(平衡时某微粒的浓度占各微粒浓度之和的分数)与pH的关系如图所示。题号1352468791011121314151617181920 题号13524687910111213141516171819202.28.7×10-7N2H6(HSO4)2 题号1352468791011121314151617181920 题号135246879101112131415161718192020.(12分)痛风是以关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:①HUr(尿酸,aq)⥫⥬Ur-(尿酸根离子,aq)+H+(aq)(37 ℃时,Ka=4.0×10-6 mol·L-1);②NaUr(s)⥫⥬Ur-(aq)+Na+(aq)。题号1352468791011121314151617181920(1)37 ℃时,1.0 L水中最多可溶解8.0×10-3 mol尿酸钠,此温度下尿酸钠的Ksp为_____________ mol2·L-2。(2)关节炎发作多在脚趾和手指的关节处,这说明温度降低时,尿酸钠的Ksp________(填“增大”“减小”或“不变”),生成尿酸钠晶体的反应是________(填“放热”或“吸热”)反应。(3)37 ℃时,某尿酸结石病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3 mol·L-1,其中尿酸分子的浓度为5.0×10-4 mol·L-1,该病人尿液的c平(H+)为___________(保留三位有效数字) mol·L-1,pH_____(填“>”“






