

















所属成套资源:浙教版八年级上册科学课件+教案+导学案+分层练习
科学浙教版第5节 物质的溶解一等奖ppt课件
展开
这是一份科学浙教版第5节 物质的溶解一等奖ppt课件,文件包含15物质的溶解第2课时教学课件pptx、15物质的溶解第2课时教学设计docx、15物质的溶解第2课时分层作业原卷版docx、15物质的溶解第2课时分层作业解析版docx、15物质的溶解第2课时导学案教师版docx、15物质的溶解第2课时导学案学生版docx等6份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
一定量的蔗糖能溶解在一定量的水中。当放入水中的蔗糖超过一定量后,无论怎么搅拌或摇晃,一部分蔗糖总是不能溶解。这说明在在一定的温度下,在一定量的溶剂中,物质能够溶解的量是有限的。
上节课我们向一定量的水中逐渐加入硫酸铜晶体,当加入到一定量之后硫酸铜不能再继续溶解。由此可知,在一定的温度下,在一定量的溶剂中,物质能够溶解的量是有限的。
我们把在一定温度下,在一定量的溶剂里不能继续溶解某种溶质的溶液,称为这种溶质的饱和溶液;还能继续溶解某种溶质的溶液,称为这种溶质的不饱和溶液。
思考与讨论:如何用实验证明两瓶溶液中,一瓶是饱和溶液,而另一瓶是不饱和溶液?
饱和溶液和不饱和溶液的判断判断依据:在一定温度下,溶质在该溶液里能否继续溶解;(1)饱和溶液的判断:①该溶液中有剩余固体溶质存在; ②温度不变时,继续加入该固 体溶质,该固体不再继续溶解;(2)不饱和溶液的判断:温度不变时,继续加入该固 体溶质,该固体会继续溶解。
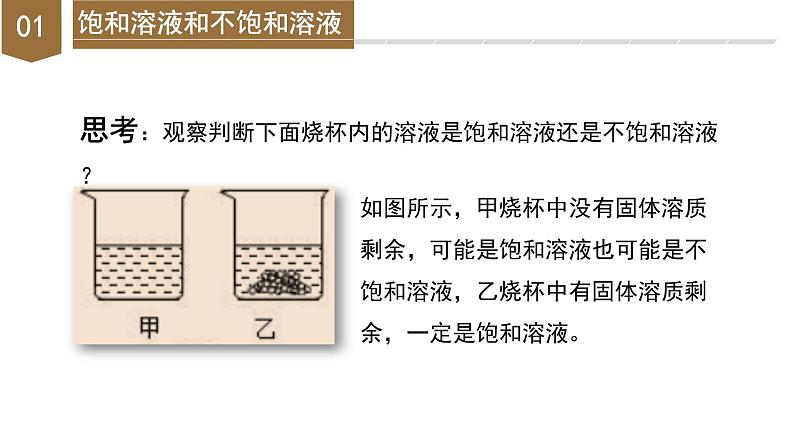
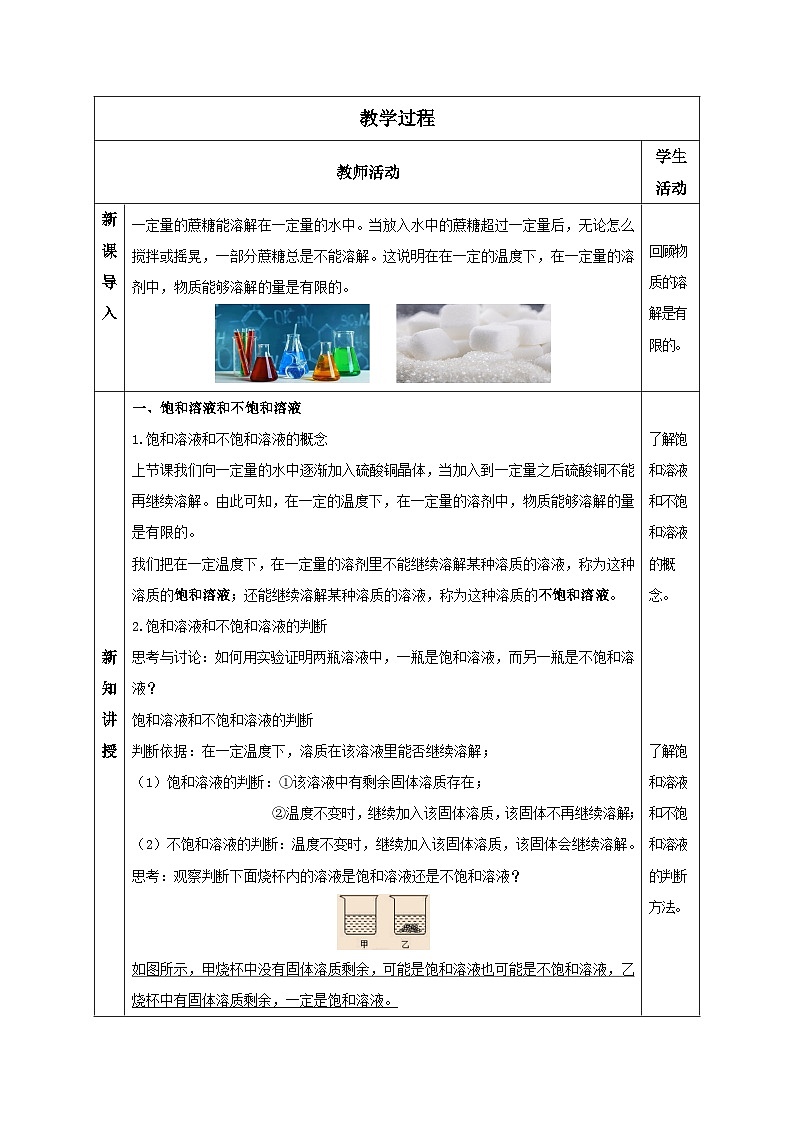
思考:观察判断下面烧杯内的溶液是饱和溶液还是不饱和溶液?
如图所示,甲烧杯中没有固体溶质剩余,可能是饱和溶液也可能是不饱和溶液,乙烧杯中有固体溶质剩余,一定是饱和溶液。
思考:如何将不饱和的硝酸钾溶液转化成饱和的硝酸钾溶液?向不饱和的硝酸钾溶液中继续加入硝酸钾固体并不断搅拌使其充分溶解,当其不能再继续溶解硝酸钾时,即变为饱和溶液;将不饱和硝酸钾溶液恒温蒸发水,直至有固体析出,则可变为饱和溶液;硝酸钾的溶解性随温度的升高而增大,随温度的降低而减小,故可降低温度,使硝酸钾的溶解性减小,直至析出固体,则可转化为饱和溶液。
饱和溶液和不饱和溶液的转化一般情况下,对于大多数固体物质(如硝酸钾)来说有以下转化关系:特殊情况下,对于极少数物质(如氢氧化钙)来说有以下转化关系:
对于溶解性随温度升高而增大的物质(如硝酸钾等),降低温度可将不饱和溶液变为饱和溶液;对于溶解度随温度升高而减小的物质(如氢氧化钙),升高温度可将不饱和溶液变为饱和溶液。
在溶液配制过程中,有的溶液溶有较多的溶质,称为浓溶液;有的溶液溶有较少的溶质,称为稀溶液。那么,饱和溶液是否一定是浓溶液呢?活动:在2支装有10毫升水的试管中分别加入1小匙蔗糖和熟石灰,振荡后,静置片刻,你看到了什么现象?
从以上活动中可知,熟石灰在水里溶解的量极少,溶液很稀,但已经达到饱和了;蔗糖在水里溶解的量较多,溶液很浓,却还未达到饱和。
思考与讨论:根据上述实验事实,思考“饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液”这句话是否正确。你能举出生活中的具体事例吗?溶液的浓稀与饱和不饱和是两个不同的概念:溶液的浓稀主要取决于溶质与溶剂的比例。而溶液的饱和与不饱和则指的是在一定条件下,溶液中是否还能继续溶解更多的溶质。这两者之间没有必然的联系,也就是说,一个溶液可能是饱和的但仍然很稀,也可能是不饱和的但非常浓。例如,氢氧化钙的饱和溶液即使在饱和状态下也可能非常稀,因为氢氧化钙在水中的溶解性很小。相反,蔗糖的不饱和溶液可以溶解大量的蔗糖,从而成为浓溶液。
饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液;但相同温度下同种物质的饱和溶液一定比其不饱和溶液更浓。
我们知道,在相同的条件下,不同物质的溶解性是不同的。那么,如何定量地来表示物质的溶解性呢?
溶解度我们常用溶解度定量地表示物质的溶解性, 即在一定的温度下,某物质在100克溶剂中达到饱和状态时所溶解的质量为该物质在这种溶剂里的溶解度。溶解度越大,表明该温度下物质的溶解性越强。这里的溶剂,通常指水。
条件:在一定温度下溶解度受温度影响,描述溶解度一定要指明“温度”。
状态:达到饱和状态只有达到饱和状态,溶解度才是一个定值。
标准:在100g溶剂中一定量的溶剂中溶解的溶质是一定的,科学规定“100g溶剂”;不特别说明,溶解度是指物质在水中的溶解度。
单位:克(g)溶解度是溶质的质量,单位是g。
不同物质具有不同的溶解度。下面是几种常见物质在20℃时的溶解度:
溶解度可以用来定量地表示物质的溶解性。溶解度与溶解性的关系(20℃)思考与讨论:说说上表中哪些是易溶物质,哪些是微溶物质?如表所示,氯化钠、蔗糖、氯化铵、硝酸钾均为易溶物质;氯酸钾是可溶物质;氢氧化钙是微溶物质。
习惯上把难溶物质叫做不溶物质,但实际上不存在绝对不溶的物质,只是其溶解度很小而已。
许多物质的溶解度随温度的变化而变化,如表1-7、表1-8中分别列出了硝酸钾和氢氧化钙的溶解度随温度变化的情况:根据以上相关数据,思考并讨论硝酸钾、氢氧化钙的溶解度是如何随温度的变化而变化的。大部分固体物质的溶解度随温度的升高而增大,如硝酸钾;个别固体物质的溶解度随温度的升高而减小,如氢氧化钙。
思考:烧开水时,随着温度的升高,沸腾前会出现气泡,想一想这些气泡产生的原因,思考气体物质的溶解度随温度的变化情况。打开汽水瓶盖,有大量气泡冒出,这是为什么?随着温度的升高,气体的溶解度减小,故沸腾前会出现气泡。打开瓶盖,气压减小,气体溶解度减小,产生大量气泡。
1.影响固体物质溶解度的因素内因:溶剂、溶质的性质;外因:温度。大多数固体物质的溶解度随温度升高而增大,如硝酸钾;少数固体物质的溶解度受温度变化影响不大,如氯化钠;极少数固体物质的溶解度随温度升高而减小,如氢氧化钙。2.影响气体溶解度的因素内因:气体本身的性质;外因:温度和压强。其他条件不变,温度越高,气体溶解度越小;其他条件不变,压强越大,气体溶解度越大。
曲线整体趋势: ;曲线上的点(A): ;曲线上方的点(B): ;曲线下方的点(C): ;曲线的交点(D): 。
表示物质溶解度随温度变化情况
表示物质在对应温度时的溶解度
表示此温度下的溶液饱和且有未溶固体
表示此温度下的溶液为不饱和溶液
表示在某温度时的溶解度相等
横坐标表示温度,纵坐标表示物质的溶解度。
缓升型:氯化钠、氯化铵、氯化钾陡升型:硝酸铵、硝酸钠、硝酸钾下降型:氢氧化钙
典例1 课堂上,老师配制了一杯70℃的已充分溶解的硫酸铜溶液,用滴管快速吸取后滴一滴在玻璃片上,发现玻璃片上有晶体析出(如图)。下列判断正确的是( )A.烧杯中溶液一定是饱和溶液B.烧杯中溶液不是饱和溶液C.玻璃片上溶液一定是饱和溶液D.玻璃片上溶液不是饱和溶液
考点分析:饱和溶液和不饱和溶液的概念一定温度下,一定量的溶剂里不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液;还能继续溶解某种溶质的溶液叫做这种溶质的不饱和溶液。晶体析出后的溶液是该溶质的饱和溶液。
【解析】饱和溶液是指在一定温度下,一定量的溶剂里不能再溶解某种溶质的溶液叫做这种溶质的饱和溶液;还能继续溶解某种溶质的溶液叫做这种溶质的不饱和溶液。晶体析出后的溶液是该溶质的饱和溶液。将70℃的已充分溶解的硫酸铜溶液,滴一滴在玻璃片上,发现玻璃片上有晶体析出,所以玻璃片上溶液一定是饱和溶液,而烧杯中的溶液状态不确定。故选C。
典例2 t℃时,为使接近饱和的氢氧化钙溶液变成饱和溶液,分别采取可以下列措施,其中能达到目的的是( )①降低温度 ②升高温度 ③加水 ④加入氢氧化钙固体A.①③ B.②③ C.①④ D.②④
考点分析:饱和溶液和不饱和溶液的转化
【解析】在一定温度下,在一定量的溶剂里不能再继续溶解某物质的溶液叫该物质的饱和溶液;能继续溶解的是不饱和溶液。氢氧化钙的溶解度随温度升高而减小,接近饱和的氢氧化钙溶液变成饱和溶液可以采用的方法有:升高温度、增加溶质、减少溶剂。故选D。
典例3 下列说法正确的有( )A.在一定量的溶剂里,食盐的饱和溶液比它的不饱和溶液要浓B.浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液C.20℃时的硝酸钾饱和溶液,当温度升高到60℃时,其它条件不变,该溶液还是饱和溶液D.对同一溶质的溶液而言,在一定温度下,饱和溶液比不饱和溶液要浓
考点分析:饱和溶液和不饱和溶液;浓溶液和稀溶液饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液;但相同温度下同种物质的饱和溶液一定比其不饱和溶液更浓。
【解析】一定温度下,一定量的溶剂中不能再继续溶解某溶质的溶液,是该溶质的饱和溶液,还能继续溶解的是不饱和溶液。A.在一定的温度下,一定量的溶剂里,食盐的饱和溶液比它的不饱和溶液要浓,故错误;B.浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液,故错误;C.硝酸钾的溶解度随温度的升高而增大,故20℃时的硝酸钾饱和溶液,当温度升高到60℃时,其它条件不变,该溶液变成不饱和溶液,故错误;D.在一定温度下,对同一溶质的溶液而言,饱和溶液比不饱和溶液要浓,故正确。故选D。
典例4 右图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:(1)溶解度受温度影响变化较大的是 (填“甲”或“乙”)物质;(2)t2℃时,把50g乙物质放入50g水中,充分搅拌,所得溶液是 (填“饱和”或“不饱和”)溶液;(3)t2℃时,有一接近饱和的甲溶液,可采用的方法 (写1种)使它变为该温度下的饱和溶液。
考点分析:溶解度;饱和溶液和不饱和溶液溶解度曲线的解读;饱和溶液和不饱和溶液的判断;不饱和转化为饱和溶液的方法:加入溶质、蒸发溶剂、改变温度。
加入甲物质(或蒸发水)
【解析】(1)甲物质溶解度曲线比较陡,即溶解度受温度影响变化较大;(2)t2℃时乙物质的溶解度是60g,即100g水中最多溶解60g,所以50g水中最多溶解30g,所以t2℃时,把50g乙物质放入50g水中,充分搅拌,只能溶解30g,所得溶液为饱和溶液;(3)不饱和溶液变为饱和溶液可以用加入溶质或蒸发溶剂,由于是使它变为该温度下的饱和溶液,所以不能通过改变温度达到饱和。
相关课件
这是一份浙教版八年级上册第3节 水的浮力精品课件ppt,文件包含13水的浮力第2课时教学课件pptx、13水的浮力第2课时教学设计docx、13水的浮力第2课时分层作业原卷版docx、13水的浮力第2课时分层作业解析版docx、13水的浮力第2课时导学案教师版docx、13水的浮力第2课时导学案学生版docx等6份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
这是一份初中科学浙教版八年级下册第5节 磁生电优质ppt课件,文件包含15磁生电2pptx、15磁生电2教学设计表格式doc、15磁生电2学案含答案doc、交流发电机原理动画wmv、发电机产生感应电流wmv等5份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
这是一份初中科学浙教版八年级上册第1章 水和水的溶液第5节 物质的溶解完整版教学ppt课件,文件包含2022浙教版八上科学15物质的溶解4pptx、2022浙教版八上科学15物质的溶解4教学设计doc、2022浙教版八上科学15物质的溶解4学案含答案doc、搅拌mp4、称量mp4等5份课件配套教学资源,其中PPT共28页, 欢迎下载使用。










