




所属成套资源:全套人教版高中化学必修第一册课时教学课件
高中第四章 物质结构 元素周期律第二节 元素周期律教学演示ppt课件
展开
这是一份高中第四章 物质结构 元素周期律第二节 元素周期律教学演示ppt课件,共60页。PPT课件主要包含了由1到8,由大到小,周期性,+1到+7,-4到-1,Na>Mg>Al,HClO4,SiH4,NaOH,Al2O3等内容,欢迎下载使用。
知识点一 1~18号元素性质的周期性变化规律
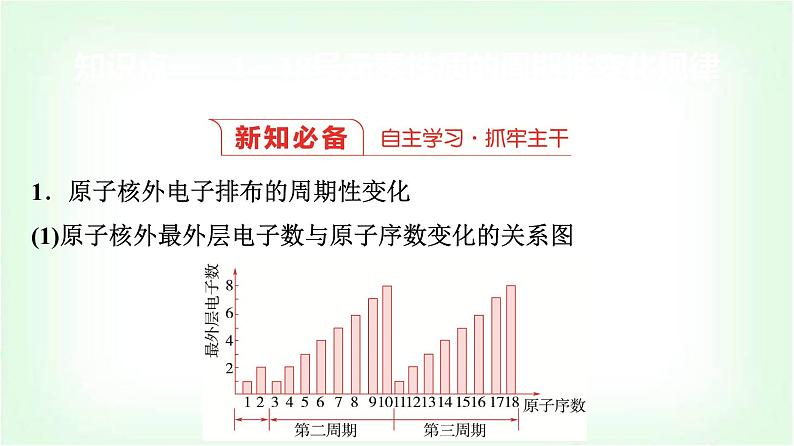
1.原子核外电子排布的周期性变化(1)原子核外最外层电子数与原子序数变化的关系图
(2)规律:随着原子序数的递增,同周期元素原子的最外层电子排布呈现______的周期性变化(第一周期除外)。
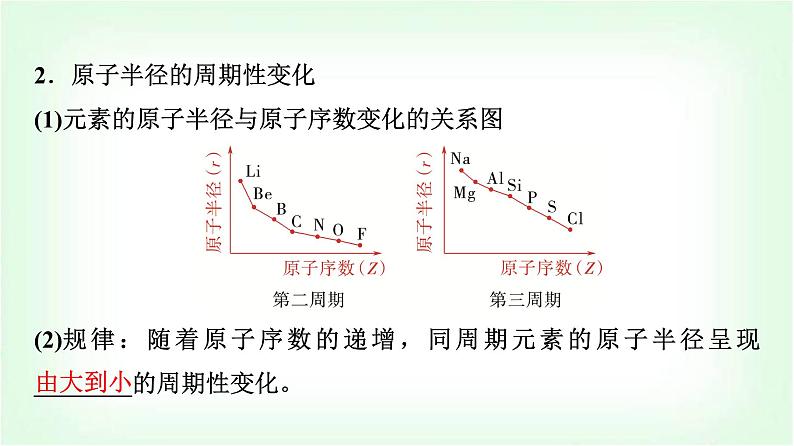
2.原子半径的周期性变化(1)元素的原子半径与原子序数变化的关系图 (2)规律:随着原子序数的递增,同周期元素的原子半径呈现________的周期性变化。
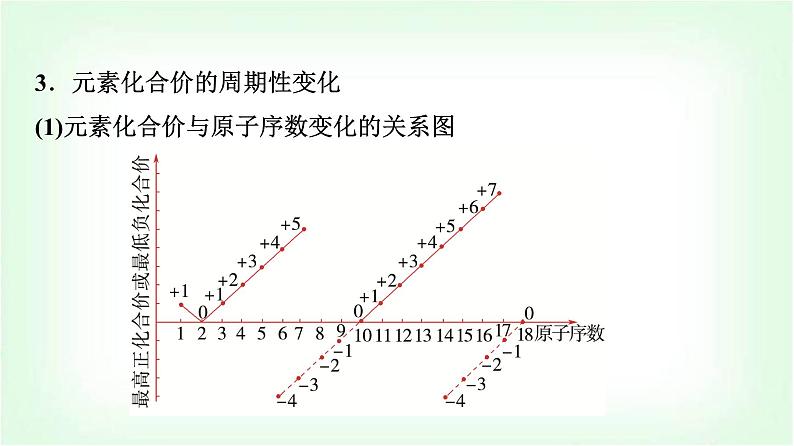
3.元素化合价的周期性变化(1)元素化合价与原子序数变化的关系图
(2)规律:随着原子序数的递增,元素的化合价呈______变化,即每周期,最高正价:________(O无最高正价、F无正价),最低负价:________。
特别提醒 ①并不是所有周期的主族元素最高正化合价重复+1至+7价的周期性变化。如O、F的最高正价不是+6、+7价。②并不是所有元素均有负化合价,如金属元素只有正价无负价。
1.下列关于元素周期律的叙述中不正确的是( )A.Na、Mg、Al最外层电子数依次增多,对应离子的氧化性依次增强B.P、S、Cl最高正化合价依次升高,对应气态氢化物的稳定性依次增强C.同周期元素的原子半径以第ⅦA族的为最大D.Na、Mg、Al的氢氧化物的碱性依次减弱
C [Na、Mg、Al原子的最外层电子数依次为1、2、3,原子的还原性依次减弱,但离子的氧化性依次增强;P、S、Cl的最高正化合价分别为+5、+6、+7,由于P、S、Cl的非金属性依次增强,对应的气态氢化物的稳定性也依次增强;除稀有气体元素外,同周期元素从左到右原子半径依次减小;因Na、Mg、Al的金属性依次减弱,则它们的氢氧化物的碱性也依次减弱。]
2.短周期主族元素X、Y、Z的原子核外最外层电子数之和为11,它们在元素周期表中的位置如图所示。下列说法正确的是( )A.X、Y的最高价氧化物分别属于酸性氧化物和碱性氧化物B.Y的单质与氢氧化钠溶液或盐酸反应都能产生气体C.简单氢化物的稳定性:X<ZD.X的最高价氧化物对应水化物的酸性比Z的弱
B [设Z元素原子的最外层电子数为x,则X元素原子的最外层电子数为x,Y元素原子的最外层电子数为x-1,依题意有x+(x-1)+x=11,故x=4,X、Y、Z分别为C、Al、Si。CO2为酸性氧化物,Al2O3为两性氧化物,A错误;Al与NaOH溶液或盐酸反应都产生H2,B正确;非金属性:X>Z,则简单氢化物的稳定性:X>Z,C错误;非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性:C>Si,故酸性:H2CO3>H2SiO3,D错误。]
3.下列各组粒子,按半径由大到小顺序排列正确的是( )A.Mg、Ca、K、Na B.S2-、Cl-、K+、Na+C.Br-、Br、Cl、SD.Na+、Al3+、Cl-、F-
B [K、Ca比Na、Mg多1个电子层,故有r(K)>r(Ca)>r(Na)>r(Mg),A错误;S2-、Cl-、K+三离子核外电子排布相同,核电荷数越小,离子半径越大,又因K+比Na+多1个电子层,故有r(S2-)>r(Cl-)>r(K+)>r(Na+),B正确;Br-比Br多1个电子,半径大,Br比Cl多1个电子层,故r(Br-)>r(Br)>r(Cl),但r(Cl)<r(S),C错误;Na+、Al3+、F-核外电子排布相同,核电荷数越小,离子半径越大,Cl-比F-多1个电子层,故有r(Cl-)>r(F-)>r(Na+)>r(Al3+),D错误。]
4.已知短周期主族元素的离子aA2-、bB-、cC+、dD3+都具有相同核外电子层结构,下列说法正确的是( )A.离子半径:C+>D3+>B->A2-B.原子序数:d>c>b>aC.氧化性:C+>D3+D.单质A与单质C加热反应的产物为C2A
B [aA2-、bB-、cC+、dD3+都具有相同核外电子层结构,则a+2=b+1=c-1=d-3,原子序数d>c>b>a;且四种离子为短周期主族元素的离子,则A为O、B为F、C为Na、D为Al。具有相同电子排布的离子,原子序数大的离子半径小,则离子半径:A2->B->C+>D3+,A错误;原子序数:d>c>b>a,B正确;C、D同周期,同周期从左到右元素金属性递减,离子氧化性递增,则氧化性:C+<D3+,C错误;单质A与单质C加热反应,即钠与氧气在加热下反应,产物为C2A2(Na2O2),D错误。]
题后归纳 “四同法”比较微粒半径的大小
知识点二 第三周期元素性质的递变
1.钠、镁、铝元素金属性的递变规律(1)钠、镁元素金属性的强弱
①该实验加热前,镁条表面附着了少量无色气泡,加热至沸腾后,有较多的无色气泡冒出,滴加酚酞溶液变为____色。该实验说明镁与____几乎不反应,能与热水反应,反应的化学方程式为________________________________。②由上述实验可知,镁和水反应不如钠和水反应____。
(2)镁、铝元素金属性的强弱
①实验甲中a、b两支试管中沉淀逐渐溶解,最终完全消失,对应的离子方程式分别为_________________________________________________________。由上述反应可知Al(OH)3为____氢氧化物。②实验乙中a试管中沉淀溶解,b试管中沉淀不溶解,a试管中反应的离子方程式为_______________________________。
Al(OH)3+3H+===Al3++3H2O、Al(OH)3+OH-
===[Al(OH)4]-
Mg(OH)2+2H+===Mg2++2H2O
③由上述实验可知钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为_____________________________。(3)钠、镁、铝的金属性由强到弱的顺序为________________。
NaOH>Mg(OH)2>Al(OH)3
2.硅、磷、硫、氯的非金属性的递变规律
HClO4>H2SO4>H3PO4>H2SiO3
3.同周期元素性质递变规律 同一周期从左到右,元素金属性逐渐____,非金属性逐渐____。
铝的金属性较活泼,易与O2等反应,但铝锅等铝制品可以长期使用,试说明原因。日常生活中常用到铝锅,但铝锅长时间盛放酸性或碱性食物容易腐烂,为什么?
提示:铝与氧气反应,在铝锅表面生成致密的氧化物保护膜,阻止铝与氧气继续反应,故铝锅可长期使用。氧化铝具有两性,能与酸性或碱性食物缓慢反应,使氧化铝失去保护作用。
1.下列关于铝元素及其化合物的说法正确的是( )A.Al(OH)3的碱性比Mg(OH)2的强B.原子的最外层电子数n:n(Al)>n(C)C.Al原子失电子的能力比硼(B)原子的强D.通常条件下,Fe单质比Al单质更耐腐蚀
2.下列递变规律不正确的是( )A.HClO4、H2SO4、H3PO4的酸性依次增强B.钠、镁、铝的还原性依次减弱C.HCl、H2S、PH3的稳定性依次减弱D.P、S、Cl三种元素的最高正化合价依次升高
A [非金属性:Cl>S>P,元素的非金属性越强,最高价氧化物对应水化物的酸性越强,则HClO4、H2SO4、H3PO4的酸性依次减弱,故A项错误;金属性:Na>Mg>Al,元素的金属性越强,对应的单质的还原性越强,则钠、镁、铝的还原性依次减弱,故B项正确;非金属性:Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,故C项正确;P、S、Cl三种元素原子的最外层电子数分别为5、6、7,最高正化合价分别为+5、+6、+7,故D项正确。]
3.在第三周期元素中,除稀有气体元素外:(1)原子半径最小的元素是________(填元素符号)。(2)金属性最强的元素是________(填元素符号)。(3)最高价氧化物对应水化物酸性最强的是________(填化学式,下同)。(4)最不稳定的气态氢化物是________。(5)最高价氧化物对应水化物碱性最强的是________。(6)氧化物中具有两性的是________。
1.(教材互鉴·苏教版必修第一册)在同一周期的元素中(稀有气体元素除外),随着原子序数的递增,下列说法中错误的是( )A.最外层电子数逐渐增多B.原子半径逐渐减小C.元素原子的失电子能力逐渐增强D.元素的非金属性逐渐增强
C [同一周期的元素中,随着原子序数的递增,元素原子的失电子能力逐渐减弱,得电子能力逐渐增强。]
2.下列4种微粒中,半径按由大到小的顺序排列的是( ) A.①>②>③>④ B.③>④>①>②C.③>①>②>④D.①>②>④>③
C [①~④依次为S、Cl、S2-、F,故微粒半径:③>①>②>④。]
3.下列关于元素的金属性、非金属性的说法,正确的是( )A.HCl的酸性强于H2S,故非金属性:Cl>SB.第ⅠA族金属元素是同周期中金属性最强的元素C.金属性:Na>Mg>Al,故其对应离子的氧化性:Na+>Mg2+>Al3+D.第ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
B [HCl的酸性强于H2S,与相应元素的非金属性强弱无关,A错误;同周期元素从左到右,元素的金属性逐渐减弱,因此第ⅠA族金属元素是同周期中金属性最强的元素,B正确;元素的金属性越强,其对应离子的氧化性越弱,故简单离子的氧化性应为Na+H3ZO4。下列说法中,不正确的是( )A.气态氢化物的热稳定性:X>Y>ZB.原子的得电子能力:YZD.三种元素原子的最外层电子数相等
BD [最高价氧化物对应水化物的酸性:HXO4>H2YO4>H3ZO4,所以非金属性:X>Y>Z,元素的非金属性越强,其气态氢化物越稳定,故A正确;元素非金属性越强,其原子的得电子能力越强,原子的得电子能力:X>Y>Z,故B不正确;元素的非金属性越强,其单质的氧化性越强,故C正确;由题意可知,X、Y、Z元素原子的最外层电子数分别为7、6、5,故D不正确。]
5.根据下表回答下列有关问题。
(1)写出下列元素符号:①_________,⑥___________,⑦________,⑪____________。(2)这些元素中最活泼的金属元素是________(填元素符号,下同),最活泼的非金属元素是________,最不活泼的元素是________。
(3)这些元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式,下同),碱性最强的是________,呈两性的氢氧化物是________,写出三者之间两两反应的化学方程式:______________________________________,_________________________________,________________________________。
KOH+Al(OH)3===K[Al(OH)4]
3HClO4+Al(OH)3===Al(ClO4)3+3H2O
===KClO4+H2O
(4)这些元素(除0族元素外)中原子半径最小的是________(填元素符号,下同),原子半径最大的是________。(5)在⑧与⑫中,单质的化学性质较活泼的是________(填元素符号),请设计化学实验证明(描述现象和反应即可)___________________________________________________________________________________________________。
将氯气通入溴化钠溶液中,溶液变为橙黄色,发生的反应为Cl2+2NaBr===2NaCl+Br2
[解析] 由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑪为Ca、⑫为Br;再结合元素周期律可知,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是稀有气体元素Ar。它们的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3。在比较Cl2与Br2的活泼性差异时,可根据元素非金属性强弱比较的依据设计实验。
课时分层作业(二十七) 元素性质的周期性变化规律
(选择题只有一个选项符合题目要求)1.元素性质呈周期性变化的决定因素是( )A.元素原子半径大小呈周期性变化B.元素相对原子质量依次增大C.元素原子核外电子排布呈周期性变化D.元素的最高正化合价呈周期性变化
C [结构决定性质,即原子的核外电子排布尤其是最外层电子排布决定了元素的性质,所以元素性质呈周期性变化的决定因素是元素原子核外电子排布呈周期性变化,C项正确。]
2.原子序数为11~17的元素,随核电荷数的递增而逐渐减小的是( )A.电子层数B.最外层电子数C.原子半径D.元素最高正化合价
C [原子序数为11~17的元素,随核电荷数的递增而逐渐减小的是原子半径,随核电荷数的递增而逐渐增大的是最外层电子数和元素最高正化合价,而电子层数均为3。]
3.下列事实或实验能作为判断依据的是( )A.盐酸是强酸,氢硫酸是弱酸,判断氯与硫的非金属性强弱B.热稳定性:H2Se<H2S<H2O,判断氧、硫与硒的非金属性强弱C.沸点:H2O>NH3>CH4,判断碳、氧与氮的非金属性强弱D.在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱
B [盐酸和氢硫酸均不是相应元素的最高价氧化物对应的水化物,不能作为判断氯与硫的非金属性强弱依据,A错误;非金属性越强的元素其单质越容易与氢气化合,得到的氢化物越稳定,故可依据热稳定性:H2Se<H2S<H2O,判断氧、硫与硒的非金属性强弱,B正确;沸点高低不能判断碳、氧与氮的非金属性强弱,C错误;镁与铝的金属性强弱可用其与酸反应的剧烈程度判断,在MgCl2与AlCl3溶液中分别加入过量的氨水,不能判断镁与铝的金属性强弱,D错误。]
4.若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是( )A.离子半径:Am+<Bn-B.原子半径:A<BC.A的原子序数比B大m+nD.b=a-n-m
B [A失去m个电子与B得到n个电子后核外电子排布相同,则A位于B的下一周期,故A的核电荷数比B的核电荷数大,所以离子半径:Am+<Bn-,原子半径:A>B,由于a-m=b+n,则a-b=m+n,b=a-m-n。]
5.已知X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。下列有关这四种元素的性质的描述中不正确的是( )A.与水反应,X比Y剧烈B.与H2化合,W单质比Z单质容易C.X形成的碱比Y形成的碱的碱性强D.W的最高价含氧酸比Z的最高价含氧酸的酸性强
D [由表中相对位置可知,X、Y为金属,且X比Y活泼,所以A、C正确;Z、W为非金属,且非金属性ZH2RD.单质与同浓度的稀盐酸反应的速率:Q>L
BC [根据表格数据可知 L是Mg,M是Al,Q是Be,R是S,T是O。Mg2+与S2-的核外电子数分别是10和18,不相等,A错误;氧化铝是两性氧化物,既能与强酸反应又能与强碱反应,B正确;元素的非金属性:O>S,元素的非金属性越强,其气态氢化物的稳定性就越强,所以氢化物的稳定性:H2O>H2S,C正确;由于Mg的金属性强于Be,所以单质与浓度相等的稀盐酸反应的速率:Be乙B.元素甲最外层只有一个电子,而乙最外层有两个电子,所以金属性:甲>乙C.金属元素A、B能分别形成+2、+3价离子,所以氧化性:A2+FeE.因为Cl2+Na2S===2NaCl+S,所以非金属性:Cl>SF.因为水溶液的酸性:HmA>HnB,所以非金属性:A>BG.HCl是一元酸,而H2SO4是二元酸,所以酸性:H2SO4>HCl
Ⅳ.(6)甲同学查阅资料知:氨气(NH3)的分解温度在850 ℃以上,甲烷(CH4)的分解温度是655 ℃,据此得出结论:N元素的非金属性强于C元素。乙同学对此结论持怀疑态度,甲同学通过实验间接证明了自己的结论。你认为甲同学的实验方案是(请结合离子方程式简要说明):___________________________________________________________________________________________________________________。
[解析] Ⅰ.元素a、b、c、d、e在元素周期表中的相对位置知:a为N、b为O、c为Al、d为S、e为Cl。(1)元素a即N在周期表中的位置是第二周期第ⅤA族。(2)电子层数越多,离子半径越大,具有相同的电子层结构的离子,核电荷数越大,离子半径越小;五种元素中离子半径最小的是Al3+。Ⅱ.同周期主族元素,从左到右原子半径逐渐减小;元素位于同主族时,核电荷数越大,电子层数越多,原子半径越大。由图知,X为O、Y为F、Z为Na、M为Al、N为Si、R为Cl。
(4)非金属性越强,对应最高价含氧酸的酸性越强,但F无正价,O无最高正价,没有对应的酸存在,则最高价含氧酸中酸性最强的是HClO4。Ⅲ.(5)金属性越强,对应的最高价氧化物的水化物的碱性越强,没有指明元素甲、乙的氢氧化物是否是最高价氧化物的水化物,所以难以比较金属性,A错误;金属性的强弱与最外层电子数的多少无关,所以难以比较金属性,B错误;金属性的强弱与最外层电子数的多少无关,所以难以比较离子的氧化性, C错误;因为铁是变价
相关课件
这是一份人教版 (2019)必修 第一册第四章 物质结构 元素周期律第二节 元素周期律课前预习课件ppt,共55页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
这是一份化学必修 第一册第二节 元素周期律教课课件ppt,共51页。PPT课件主要包含了新课情境呈现,课前素能奠基,电子层数,最外层电子数,产生白色沉淀,SiPSCl,核外电子排布,课堂素能探究,知识点,知识归纳总结等内容,欢迎下载使用。
这是一份化学必修 第一册实验活动1 配制一定物质的量浓度的溶液图片课件ppt,共60页。PPT课件主要包含了周期性,产生白色沉淀,白色沉淀逐渐溶解,白色沉淀逐,渐溶解,SiPSCl,周期性变化,原子核外电子排布呈现,周期性的变化,粒子半径大小比较等内容,欢迎下载使用。










