












初中科学浙教版九年级上册第1章 物质及其变化第3节 常见的酸公开课ppt课件
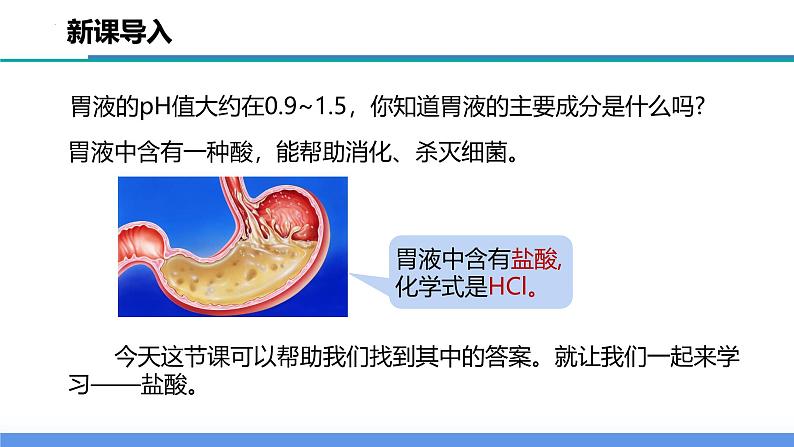
展开胃液的pH值大约在0.9~1.5,你知道胃液的主要成分是什么吗?
今天这节课可以帮助我们找到其中的答案。就让我们一起来学习——盐酸。
胃液中含有一种酸,能帮助消化、杀灭细菌。
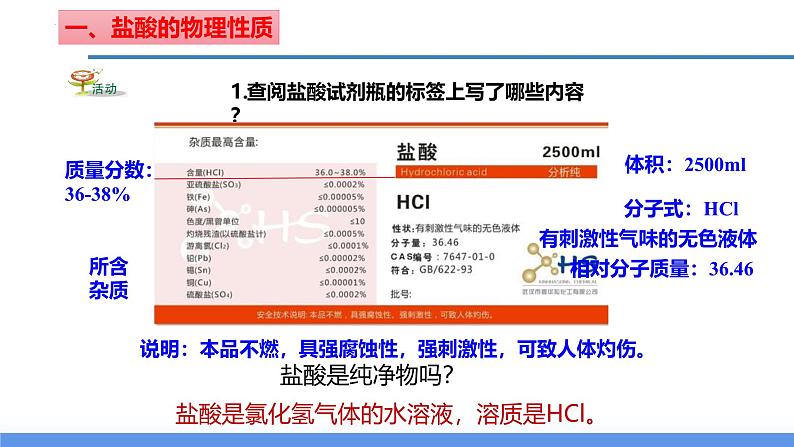
1.查阅盐酸试剂瓶的标签上写了哪些内容?
相对分子质量:36.46
有刺激性气味的无色液体
质量分数:36-38%
说明:本品不燃,具强腐蚀性,强刺激性,可致人体灼伤。
盐酸是氯化氢气体的水溶液,溶质是HCl。
氯化氢气体溶于水的溶液,是混合物,有H+呈酸性,常用浓盐酸中溶质的质量分数为36%-38%,密度为1·19克/厘米3,含有H+、Cl-、H2O三种粒子。
氯化氢气体,是纯净物,干燥时是分子状态,不存在H+,没有酸性。液态氯化氢也是纯净物,由氯化氢(HCl)分子构成。
2.观察试剂瓶中盐酸的颜色和状态。
左边:纯净盐酸是无色透明的液体右边:工业盐酸因含有FeCl3等杂质而常呈黄色
(默认为氯化氢水溶液)
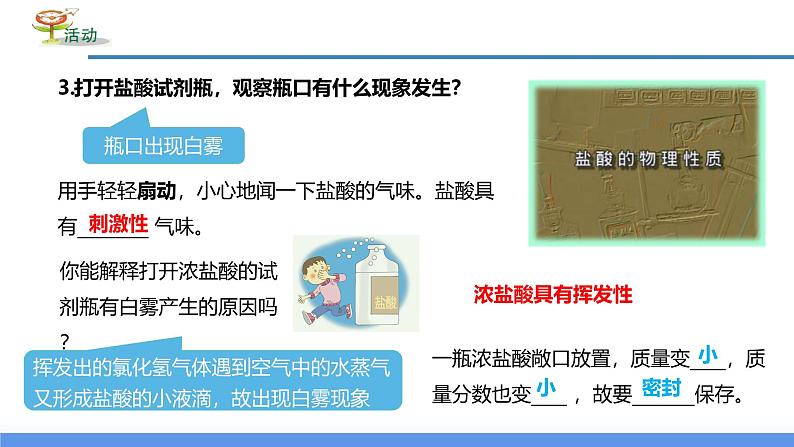
3.打开盐酸试剂瓶,观察瓶口有什么现象发生?
用手轻轻扇动,小心地闻一下盐酸的气味。盐酸具有________ 气味。
挥发出的氯化氢气体遇到空气中的水蒸气又形成盐酸的小液滴,故出现白雾现象
你能解释打开浓盐酸的试剂瓶有白雾产生的原因吗?
一瓶浓盐酸敞口放置,质量变____,质量分数也变____ ,故要_______保存。
取2支试管,分别加入少量稀盐酸溶液。然后在2支试管内分别滴入几滴紫色石蕊试液、无色酚酞试液,观察并记录呈现的颜色。
在盛有少量稀盐酸的试管里滴入几滴硝酸银溶液,观察现象
HCl+AgNO3=AgCl↓+HNO3
再滴稀硝酸,观察其现象
检验盐酸或氯离子的存在
盐酸与盐反应的规律如何?
滴加AgNO3溶液,若产生白色沉淀,继续滴加稀硝酸,无明显现象,则说明该物质中含有Cl-
检验Cl-时要加几滴稀硝酸,目的是除去CO32-离子的干扰。因为CO32-与AgNO3溶液接触时,也有白色沉淀Ag2CO3生成,但溶于稀硝酸,沉淀消失产生气泡。
检验Cl-时,为什么要加稀HNO3?
NaCl+AgNO3=AgCl↓+NaNO3 AgCl不溶于水也不与酸反应,无现象
Na2C03+2AgNO3=Ag2C03↓+2NaNO3 Ag2C03与酸反应,沉淀消失Ag2C03+2HN03=AgN03+H20+C02↑ 且产生气泡
把鸡蛋壳放入盛有盐酸的试管中,将燃着的火柴伸入试管口,观察现象
产生大量的气泡,生成的气体能使燃着的木条熄灭
CaCO3+2HCl=CaCl2+H2O+CO2↑
由金属阳离子(或铵根离子)和酸根阴离子构成的化合物
红棕色的铁锈逐渐溶解,溶液由无色变为黄色
取生锈的铁钉放入试管,注入稀盐酸,观察现象
Fe2O3+6HCl=2FeCl3+3H2O
铁锈主要成分是Fe2O3
除铁锈的时间为什么不可太长?
铁锈除去后,盐酸会与铁发生反应
向盛有少量氧化铜粉末的试管中加入2毫升盐酸,微微加热,观察现象
黑色的氧化铜粉末逐渐溶解,溶液由无色变为蓝色
CuO+2HCl=CuCl2+H2O
盐酸与金属氧化物反应的规律如何?
酸+金属氧化物→盐+水
蓝色的氢氧化铜逐渐溶解,溶液由无色变为蓝色
向盛有少量氢氧化铜粉末的试管中加入2毫升盐酸,微微加热,观察现象
Cu(OH)2+2HCl=CuCl2+2H2O
盐酸与碱反应的规律如何?
Mg+2HCl=MgCl2+H2↑
Fe+2HCl=FeCl2+H2↑
将镁条投入稀盐酸中,观察现象
有气泡产生,溶液由无色变为浅绿色
将铁钉投入稀盐酸中,观察现象
金属与盐酸反应的规律?
补充:1、有较多的金属都能与盐酸反应,如Mg Al Zn等
2、金属Na不仅能与酸反应,还能与水反应,漂浮在水上产生氢气,四处游动。
如CuSO4溶液,CuCl2溶液,Cu(NO)2溶液
CuSO4晶体是CuSO4.5H2O
如FeSO4溶液,FeCl2溶液,Fe(NO)2溶液
如Fe2(SO4)3溶液,FeCl3溶液,Fe(NO)3溶液
问题探究:在盐酸除铁锈的实验中,气体是由什么反应生成的
你的假设是:____________________________________。
应该用怎样的实验来验证你的假设?
盐酸能继续与金属铁反应生成气体
A、试管中Fe2O3溶解,溶液变黄色,无气泡产生。
B、试管中铁钉表面产生气泡,溶液变浅绿色。
C、试管中无明显现象。
3、实验结果分析:你的实验支持你的假设吗?为什么?
气体检验:用燃着的火柴放在试管口,B试管口有淡蓝色火焰,将干冷的烧杯罩在上方,烧杯内壁出现水珠。
铁与稀盐酸反应的化学方程式是:Fe + 2HCl = FeCl2 + H2 ↑
总结:盐酸能与某些金属反应,生成盐和氢气
因此成立,铁能跟稀盐酸反应产生气体,且产生的气体是氢气。
4、交流与探讨:与同学讨论对照实验的设计思路和作用。
支持,因为盐酸中含有H+
1.盐酸能与某些金属氧化物反应,在实际生活生产中有什么应用?
2.盐酸除锈时,有什么需要注意的?
不接触皮肤,因为盐酸有腐蚀性;
不过量,因为过量的盐酸要与金属反应。
3.结构决定性质,盐酸中的哪些离子决定了盐酸的化学性质?
与某些金属氧化物反应;
与含CO32-的盐反应;
与硝酸银反应生成不溶于酸的白色沉淀
重要化工产品,用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等 ;人体胃液中含有盐酸,可帮助消化。
通过查阅各种资料,你能列出盐酸的主要用途吗?
胃酸过多的病人常服用一种叫“复方氢氧化铝”的药片来治病,该药片的主要成分是氢氧化铝。为什么“复方氢氧化铝”能医治胃酸过多症?
“复方氢氧化铝”的主要成分氢氧化铝是一种碱,能和胃酸反应,所以可以用来治疗胃酸过多。3HCl+Al(OH)3=AlCl3+3H2O
1.下列关于盐酸的描述,错误的是( )A.浓盐酸有刺激性气味B.盐酸具有强烈的吸水性C.盐酸是氯化氢气体的水溶液D.打开盛有浓盐酸的试剂瓶,瓶口处有白雾
2.鸡蛋壳的主要成分是碳酸钙,将一个新鲜的鸡蛋放在盛有足量稀盐酸的烧杯中,可以观察到鸡蛋表面有气泡冒出。该气泡的主要成分是( )A.H2 B.CO2 C.O2 D.N2
知识点睛:D选项中丁实验稀盐酸与硝酸银反应生成不溶于酸的白色沉淀是由氯离子决定的,生成难溶的白色沉淀氯化银。
3.下列有关盐酸性质探究实验的叙述中,错误的是( ) A.甲中试剂瓶口出现白雾,说明浓盐酸具有挥发性 B.乙中铁锈溶解且溶液变黄色,说明盐酸可用于除铁锈 C.丙中白色固体溶解消失,说明两者发生了化学反应 D.丁中出现白色沉淀,由此可证明盐酸中存在H+
4.小明同学往氢氧化钠溶液中滴加稀盐酸研究中和反应时,忘记了滴加酸碱指示剂。为了确认滴加的盐酸是否已经过量,从烧杯中取少量反应后的溶液于试管中,用某种试剂进行检验。下表是小明同学设计的实验方案,其中不正确的是( )
知识点睛:本实验方程NaOH+HCl=NaCl+H20,A选项盐酸过量,含有多余的氢离子,能够与金属铁反应产生氢气,故正确;B选项盐酸呈酸性,pH试纸<7说明是酸性溶液;C选项反应前后Cl-都存在,都有白色沉淀产生,故错误;D选项盐酸能使紫色石蕊试液变红。
1.3 常见的酸 第1课时
科学九年级上册第3节 常见的酸完美版ppt课件: 这是一份科学九年级上册<a href="/kx/tb_c98613_t3/?tag_id=26" target="_blank">第3节 常见的酸完美版ppt课件</a>,文件包含13常见的酸第2课时教学课件pptx、13常见的酸第2课时教学设计docx、13常见的酸第2课时分层作业-原卷版docx、13常见的酸第2课时分层作业解析版docx、13常见的酸第2课时导学案教师版docx、13常见的酸第2课时导学案学生版docx等6份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
初中浙教版第3节 水的浮力优秀课件ppt: 这是一份初中浙教版<a href="/kx/tb_c92804_t3/?tag_id=26" target="_blank">第3节 水的浮力优秀课件ppt</a>,文件包含13水的浮力第3课时教学课件-pptx、13水的浮力第3课时教学设计docx、13水的浮力第3课时分层作业解析版docx、13水的浮力第3课时分层作业学生版docx、13水的浮力第3课时导学案教师版docx、13水的浮力第3课时导学案学生版docx等6份课件配套教学资源,其中PPT共31页, 欢迎下载使用。
浙教版八年级上册第3节 水的浮力精品课件ppt: 这是一份浙教版八年级上册<a href="/kx/tb_c92804_t3/?tag_id=26" target="_blank">第3节 水的浮力精品课件ppt</a>,文件包含13水的浮力第2课时教学课件pptx、13水的浮力第2课时教学设计docx、13水的浮力第2课时分层作业原卷版docx、13水的浮力第2课时分层作业解析版docx、13水的浮力第2课时导学案教师版docx、13水的浮力第2课时导学案学生版docx等6份课件配套教学资源,其中PPT共29页, 欢迎下载使用。













