











科学九年级上册第3节 常见的酸完美版ppt课件
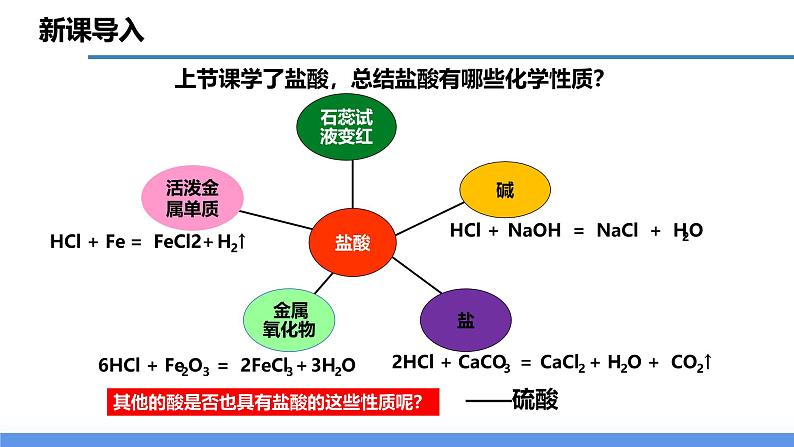
展开上节课学了盐酸,总结盐酸有哪些化学性质?
HCl + NaOH = NaCl + H2O
其他的酸是否也具有盐酸的这些性质呢?
6HCl + Fe2O3 = 2FeCl3+3H2O
2HCl + CaCO3 = CaCl2 + H2O + CO2↑
HCl + Fe = FeCl2+H2↑
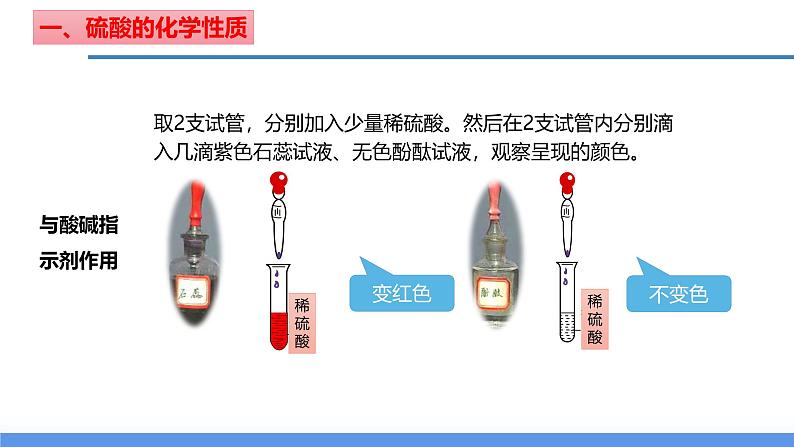
取2支试管,分别加入少量稀硫酸。然后在2支试管内分别滴入几滴紫色石蕊试液、无色酚酞试液,观察呈现的颜色。
将稀硫酸分别滴入盛有锌粒(Zn)、 Fe2O3 粉末、CuO 粉末、Cu(OH)2、BaCl2 溶液的试管中,如图1-21所示。
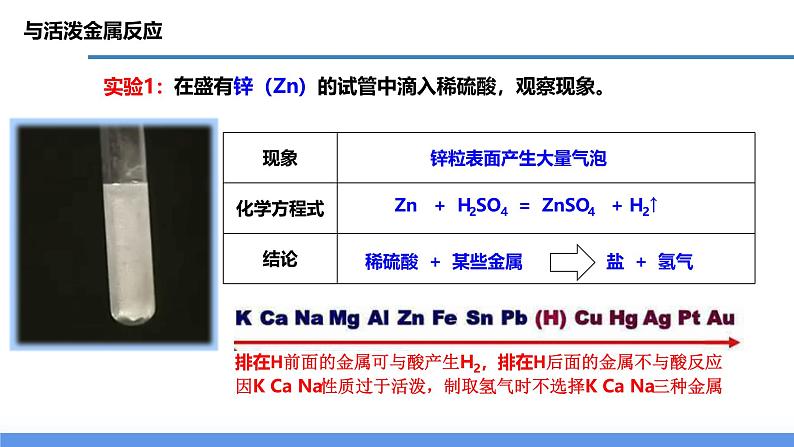
Zn + H2SO4 = ZnSO4 + H2↑
稀硫酸 + 某些金属 盐 + 氢气
在盛有锌(Zn)的试管中滴入稀硫酸,观察现象。
排在H前面的金属可与酸产生H2,排在H后面的金属不与酸反应
因K Ca Na性质过于活泼,制取氢气时不选择K Ca Na三种金属
红色粉末逐渐消失,溶液呈浅黄色
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
稀硫酸 + 金属氧化物 盐 + 水
在盛有氧化铁的试管中滴入稀硫酸,观察现象。
黑色粉末逐渐消失,溶液呈蓝色
CuO + H2SO4 = CuSO4 + H2O
在盛有氧化铜的试管中滴入稀硫酸,观察现象。
蓝色絮状沉淀逐渐溶解,溶液呈蓝色
Cu(OH)2 + H2SO4 =CuSO4 +2H2O
稀硫酸 + 碱 盐 + 水
在盛有氢氧化铜的试管中滴入稀硫酸,观察现象。
复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应。可简记为AB+CD=AD+CB。复分解反应发生的条件:反应物至少有一种物质是可溶的,生成物中至少有一种物质是气体或沉淀或水。
BaCl2 + H2SO4 = BaSO4 ↓ + 2HCl
硫酸 + 某些盐 新盐 + 新酸
在盛有氯化钡的试管中滴入稀硫酸,观察现象。
补充:根据复分解反应要求,必须有气体/沉淀/水生成稀硫酸还能与碳酸钙等盐反应,但不能与NaCl、Mg(NO3)2反应,因为没有气体/沉淀/水生成。
取一瓶浓硫酸,结合标签观察浓硫酸的物理性质
无色、黏稠、油状的液体,难挥发,密度比水大
(1)浓硫酸的物理性质
小贴士:浓硫酸不慎溅到皮肤上,要先用干布拭去,然后用大量清水冲洗,最后用小苏打溶液冲洗
能直接吸收空气中的水分
根据这个性质,浓硫酸有何用途?
一瓶浓硫酸敞口放置,质量变___,质量分数也变___,故要______保存
O2、H2、CO2、SO2等气体可用浓硫酸进行干燥,但是能与其反应的NH3等碱性气体不可用它干燥。
酸性气体干燥时没有酸性!
能把由C、H、O等元素组成的化合物里的H、O元素按原子个数比2:1的比例从化合物中“脱出”,结合成水
用玻璃棒蘸取少量浓硫酸滴在纸片上,观察有何现象发生。
取一只盛有 50 毫升水的烧杯,把约 10 毫升浓硫酸沿玻璃棒慢慢倒入水中,并不断地搅拌。用手触摸烧杯外壁,有何感觉?
水的密度比浓硫酸小,若把水倒入浓硫酸中,水浮在浓硫酸表面,浓硫酸溶于水时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,造成危险。
切不可把水倒入浓硫酸中稀释,知道这是为什么吗?
重要化工原料,用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。浓硫酸有吸水性,在实验室中常用它做干燥剂。
通过查阅各种资料,你能列出硫酸的主要用途吗?
见光易分解,所以需要密封在棕色的试剂瓶中。
在工业上有着广泛用途的强酸
无色、易挥发、有刺激性气味的液体
浓硫酸、硝酸有很强的氧化性,与金属反应不能生成H2,而是生成水。所以酸的通性通常指的是盐酸和稀硫酸,而不是指浓硫酸和硝酸。
①不同的酸在水溶液中都能电离出自由移动的H+,所以酸具有相似的化学性质。由于酸根离子不同,不同酸也有各自的特性。②要特别注意铁与稀盐酸和稀硫酸反应时生成的是FeCl2和FeSO4,而不是FeCl3和Fe2(SO4)3
鉴别硫酸根离子(SO42-)的方法:先滴入氯化钡溶液,产生白色沉淀,再滴入稀硝酸,白色沉淀不消失。
鉴别硫酸根离子(CO32-)的方法:先滴入氯化钡溶液,产生白色沉淀,再滴入稀硝酸,白色沉淀消失,并且产生气泡。
BaCl2 + Na2SO4 = BaSO4 ↓ + 2NaCl
BaSO4与稀硝酸不反应,因此白色沉淀不消失(无现象)
BaCl2 + Na2CO3 = BaCO3 ↓ + 2NaCl
BaCO3 + 2HNO3 = Ba(NO3)2 + H2O +CO2 ↑ 因此白色沉淀消失,有气泡产生
总结:滴加Ba2+的溶液,在沉淀中继续滴加稀硝酸,可鉴别SO42- 或CO32- 白色沉淀不消失:说明有SO42- 白色沉淀全消失:说明有CO32- 白色沉淀部分消失:说明有SO42- 和CO32-
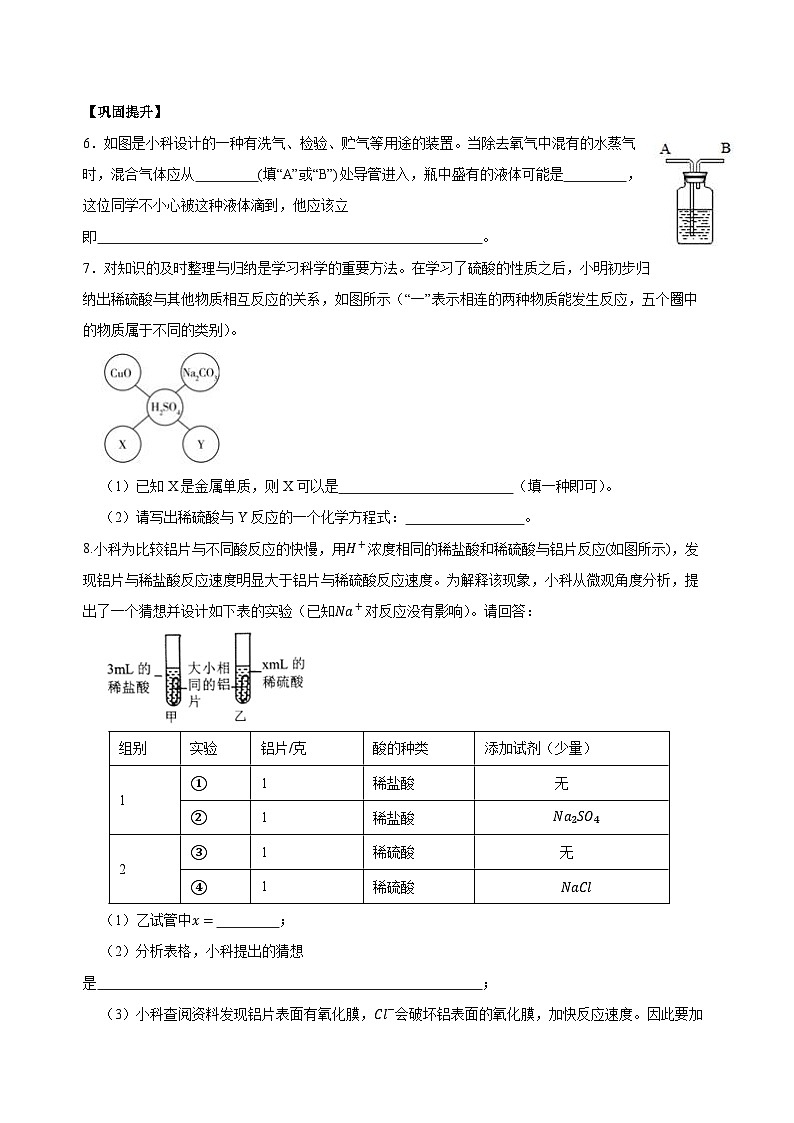
1.小金用如图实验探究硫酸的化学性质,对该实验下列表述不正确的是( )A.稀硫酸能与不溶性的碱反应B.稀硫酸和Cu(OH)2反应后,溶液呈蓝色C.该实验反应基本类型有两种D.与BaC12溶液反应的本质是H+和C1-结合
2.如图所示小试管中盛有几毫升水,与大试管连通的U形细玻璃管内放有少量水(已染成红色)。如沿试管壁小心地慢慢注入3毫升浓硫酸,静置片刻后,U形细玻璃管中可观察到的液面现象是( ) A. 左高右低 B. 左低右高 C. 左右一样高 D. 来回振动
知识点睛:酸入水放出大量热
3.下列试剂能区别稀硫酸和盐酸的是( )A.锌粒 B.紫色石蕊试液 C.氢氧化钾溶液 D.氯化钡溶液
4.从微观构成方面来看,稀盐酸、稀硫酸中因为含有相同的某种微粒而具有相似的化学性质,下列变化不能体现不同酸溶液相似的化学性质的是( )A.稀硫酸能与氯化钡反应 B.稀盐酸能使紫色石蕊试液变红C.稀硫酸能与氢氧化钠反应 D.稀盐酸能与碳酸盐反应产生二氧化碳
1.3 常见的酸 第2课时
初中科学浙教版九年级上册第1章 物质及其变化第3节 常见的酸公开课ppt课件: 这是一份初中科学浙教版九年级上册<a href="/kx/tb_c98613_t3/?tag_id=26" target="_blank">第1章 物质及其变化第3节 常见的酸公开课ppt课件</a>,文件包含13常见的酸第1课时教学课件pptx、13常见的酸第1课时教学设计docx、13常见的酸第1课时分层作业-原卷版docx、13常见的酸第1课时分层作业解析版docx、13常见的酸第1课时导学案教师版docx、13常见的酸第1课时导学案学生版docx等6份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
初中浙教版第3节 水的浮力优秀课件ppt: 这是一份初中浙教版<a href="/kx/tb_c92804_t3/?tag_id=26" target="_blank">第3节 水的浮力优秀课件ppt</a>,文件包含13水的浮力第3课时教学课件-pptx、13水的浮力第3课时教学设计docx、13水的浮力第3课时分层作业解析版docx、13水的浮力第3课时分层作业学生版docx、13水的浮力第3课时导学案教师版docx、13水的浮力第3课时导学案学生版docx等6份课件配套教学资源,其中PPT共31页, 欢迎下载使用。
浙教版八年级上册第3节 水的浮力精品课件ppt: 这是一份浙教版八年级上册<a href="/kx/tb_c92804_t3/?tag_id=26" target="_blank">第3节 水的浮力精品课件ppt</a>,文件包含13水的浮力第2课时教学课件pptx、13水的浮力第2课时教学设计docx、13水的浮力第2课时分层作业原卷版docx、13水的浮力第2课时分层作业解析版docx、13水的浮力第2课时导学案教师版docx、13水的浮力第2课时导学案学生版docx等6份课件配套教学资源,其中PPT共29页, 欢迎下载使用。













