















初中科学浙教版九年级上册第4节 常见的碱优秀ppt课件
展开在具有碱性的物质中,碱是重要的一类。
NaOH = Na+ + OH–
Ba(OH)2= Ba2+ +2OH–
Ca(OH)2= Ca2+ +2OH–
辨析:碱与碱性的关系:
碱溶液呈碱性,碱性溶液不一定是碱溶液。
你能写出下列物质的电离方程式吗?
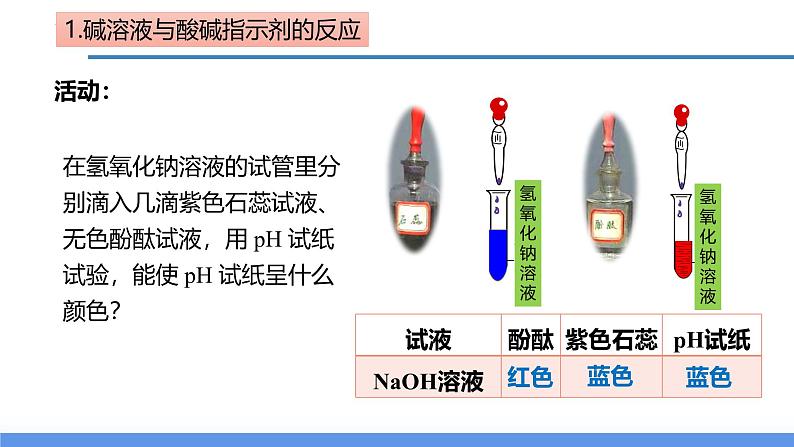
在氢氧化钠溶液的试管里分别滴入几滴紫色石蕊试液、无色酚酞试液,用 pH 试纸试验,能使 pH 试纸呈什么颜色?
1.碱溶液与酸碱指示剂的反应
碱的水溶液能使紫色石蕊试液变蓝色,使无色酚酞试液变红色
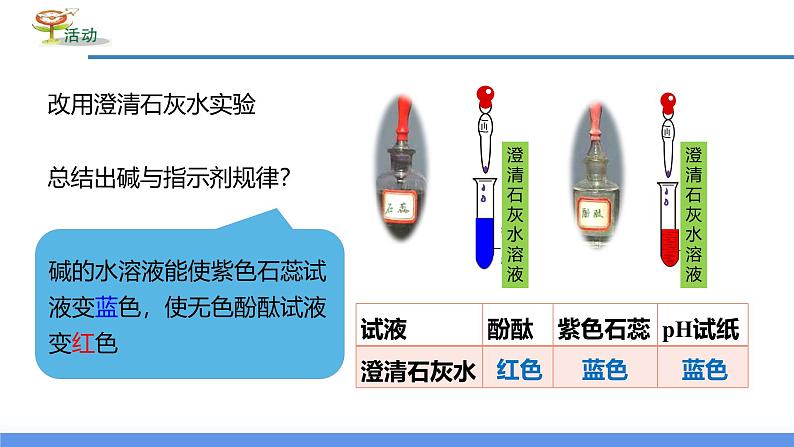
总结出碱与指示剂规律?
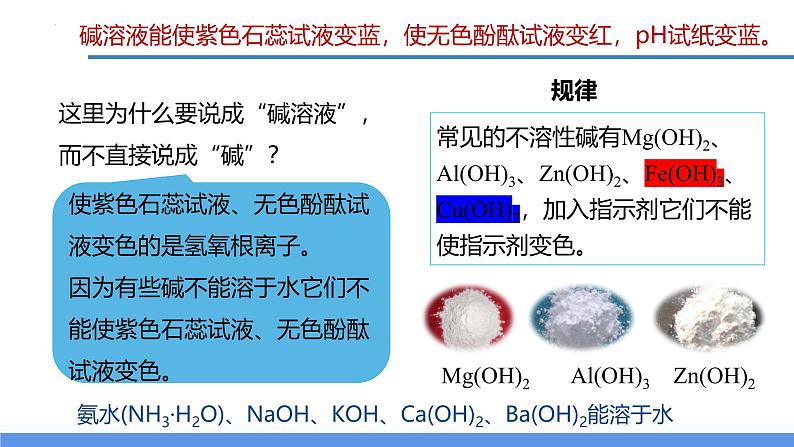
这里为什么要说成“碱溶液”,而不直接说成“碱”?
常见的不溶性碱有Mg(OH)2、Al(OH)3、Zn(OH)2、Fe(OH)3、Cu(OH)2,加入指示剂它们不能使指示剂变色。
使紫色石蕊试液、无色酚酞试液变色的是氢氧根离子。因为有些碱不能溶于水它们不能使紫色石蕊试液、无色酚酞试液变色。
碱溶液能使紫色石蕊试液变蓝,使无色酚酞试液变红,pH试纸变蓝。
氨水(NH3·H2O)、NaOH、KOH、Ca(OH)2、Ba(OH)2能溶于水
2.某些碱与某些非金属氧化物反应
(1)氢氧化钙与CO2的反应
向一支盛有澄清石灰水的试管中通入二氧化碳,观察发生了什么现象?
根据反应现象,此反应有何应用?
可用来检验二氧化碳的存在
Ca(OH)2+CO2=CaCO3↓+H2O
(2)氢氧化钠与二氧化碳的反应
氢氧化钠或氢氧化钠溶液不能敞口放置,为什么?
吸收二氧化碳,因为氢氧化钠极易溶于水能吸收更多的二氧化碳
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O 会变质
(3)氢氧化钠与二氧化硫的反应
可用氢氧化钠溶液来吸收硫酸厂产生的废气SO2
SO2+2NaOH=Na2SO3+H2O
思考:已知二氧化碳是酸性气体,二氧化硫也是酸性气体,二氧化硫排入大气有何危害?如何除去二氧化硫气体呢?请写出化学方程式。
(4)二氧化硅和氢氧化钠反应
SiO2+2NaOH=Na2SiO3+H2O
盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,应用橡皮塞或木塞
找出下列化学方程式的共同点
非金属氧化物+碱→盐+水
胃酸过多的病人常服用一种叫“氢氧化铝片”的药来治疗,药的主要成份是氢氧化铝,为什么能用它来治疗胃酸过多呢?
Al(OH)3能与胃液中的盐酸反应
3HCl+Al(OH)3=AlCl3+3H2O
氢氧化镁也会与硫酸反应,你能写出反应的化学方程式吗?你还写出其他的碱与酸反应的化学方程式吗?
氢氧化镁也常是治疗胃酸过多的药物成分,写出反应的化学方程式
Mg(OH)2+2HCl=MgCl2+2H2O
分析以上几个化学方程式,可得出什么结论?
NaOH+HCl=NaCl+H2OCu(OH)2+2HCl=CuCl2+H2O
Mg(OH)2+H2SO4=MgSO4+2H2O
氢氧化钠与稀盐酸反应没有明显的现象,该如何显示?实验时有的氢氧化钠溶液中加入过量的稀盐酸,会发现产生气泡,这是为什么?
1.加入指示剂。2.氢氧化钠吸收了空气中的CO2而变质成了Na2CO3,Na2CO3与盐酸反应产生了CO2。
CO2+2NaOH=Na2CO3+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O
注意:治疗胃酸的碱碱性不能太强,所以不能使用氢氧化钙、氢氧化钠等。
在试管中注氯化铜溶液,它们显什么颜色?
在试管中滴加氢氧化钠溶液,管中发生了什么变化?
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
4.某些碱与某些盐反应
在试管中注入氯化铁溶液,它们显什么颜色?
在试管中滴加氢氧化钠溶液,发生了什么变化?
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
请你模仿上述化学反应,写出下列化学方程式:
硫酸镁、硫酸锌能跟氢氧化钠溶液反应,生成白色的氢氧化镁和氢氧化锌白色絮状沉淀。
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓
ZnSO4+2NaOH=Na2SO4+Zn(OH)2↓
根据上述碱和盐的反应,你能总结出什么规律?
碱有哪些相似的化学性质--碱的通性?为什么具有相似的化学性质?
使紫色石蕊试液变蓝色,使无色酚酞试液变红色。
2.碱+非金属氧化物=盐+水。
3.碱 +盐 = 新碱 + 新盐
4.碱 +酸 = 盐 + 水
可溶性碱,溶液都含有氢氧根离子
碱的化学性质(课堂方程式整合)
1.已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似。下列对氢氧化锂化学性质的说法错误的是( )A.能与二氧化碳反应 B.能使无色酚酞试液变红C.能与稀硫酸反应 D.能使紫色石蕊试液变红
2.下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是( )A.能与CO2反应生成水B.能与盐酸反应生成水C.能与Na2SO4溶液反应生成BaSO4沉淀D.能使紫色石蕊试液变蓝色
知识点睛:AD是碱与空气中二氧化碳反应,为化学变化;B铁钉生锈也是化学变化;C浓硫酸吸水性为物理变化。故选C。
3. 下列质量增加的变化有一种与其他三种存在着本质的区别,这种变化是( )A.长期放置在空气中的氢氧化钠质量增加B.久置在潮湿空气中的铁钉质量增加C.长期敞口放置的浓硫酸质量增加D.久置在空气中的澄清石灰水质量增加
知识点睛:由于小白鼠进行有氧呼吸时消耗氧气,产生二氧化碳,产生的二氧化碳能被氢氧化钠吸收,则导致容器内的气体体积减小,所以A处下降、B处上升。
4.请据图回答,经数小时后,U形管A、B两处的液面会出现的情况是(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封,忽略水蒸气和温度的影响)( )
A.A处上升,B处下降 B.A、B两处都下降C.A处下降,B处上升 D.A、B两处都不变
1.4 常见的碱 第1课时
碱溶液与指示剂反应 使紫色石蕊试液变蓝色,使无色酚酞试液变红色碱与某些非金属氧化物反应生成盐和水碱与酸反应生成盐和水碱与某些盐反应生成新碱和新盐
一、碱有哪些性质 (OH-)
浙教版九年级上册第4节 常见的碱一等奖ppt课件: 这是一份浙教版九年级上册<a href="/kx/tb_c98614_t3/?tag_id=26" target="_blank">第4节 常见的碱一等奖ppt课件</a>,文件包含14+常见的碱第2课时教学课件pptx、14常见的碱第2课时教学设计docx、14常见的碱第2课时分层作业原卷版docx、14常见的碱第2课时分层作业解析版docx、14常见的碱第2课时导学案教师版docx、14常见的碱第2课时导学案学生版docx等6份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
初中科学浙教版九年级上册第1章 物质及其变化第3节 常见的酸公开课ppt课件: 这是一份初中科学浙教版九年级上册<a href="/kx/tb_c98613_t3/?tag_id=26" target="_blank">第1章 物质及其变化第3节 常见的酸公开课ppt课件</a>,文件包含13常见的酸第1课时教学课件pptx、13常见的酸第1课时教学设计docx、13常见的酸第1课时分层作业-原卷版docx、13常见的酸第1课时分层作业解析版docx、13常见的酸第1课时导学案教师版docx、13常见的酸第1课时导学案学生版docx等6份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
初中科学第1章 物质及其变化第4节 常见的碱评课课件ppt: 这是一份初中科学第1章 物质及其变化第4节 常见的碱评课课件ppt,共16页。PPT课件主要包含了蓝色PH7,结论1,化学方程式,如何证明,CO2,NaOH,Na2CO3,H2O,[化学方程式],碱具有哪些共性等内容,欢迎下载使用。













