





高中化学人教版 (2019)选择性必修1第二节 化学平衡教学演示课件ppt
展开知识点一 温度、催化剂对化学平衡的影响
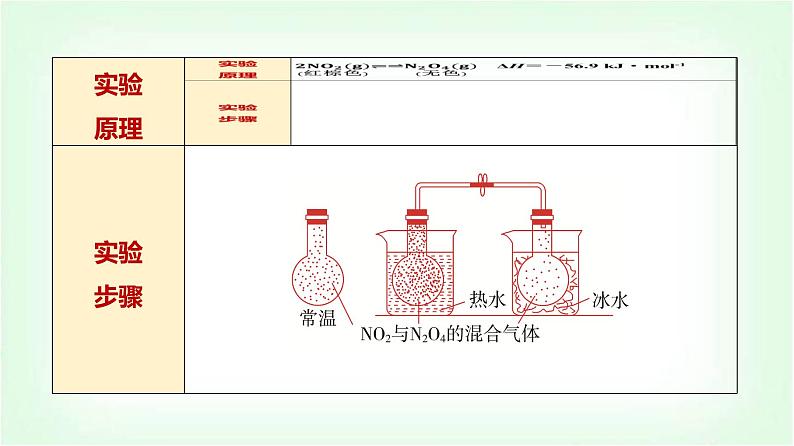
1.温度对化学平衡的影响(1)实验探究温度对化学平衡的影响按表中实验步骤要求完成实验,观察实验现象,填写下表:
(2)温度对化学平衡的影响规律①任何化学反应都伴随着能量的变化(放热或吸热),所以任意可逆反应的化学平衡状态都受温度的影响。②当其他条件不变时:温度升高,平衡向__________的方向移动;温度降低,平衡向__________的方向移动。
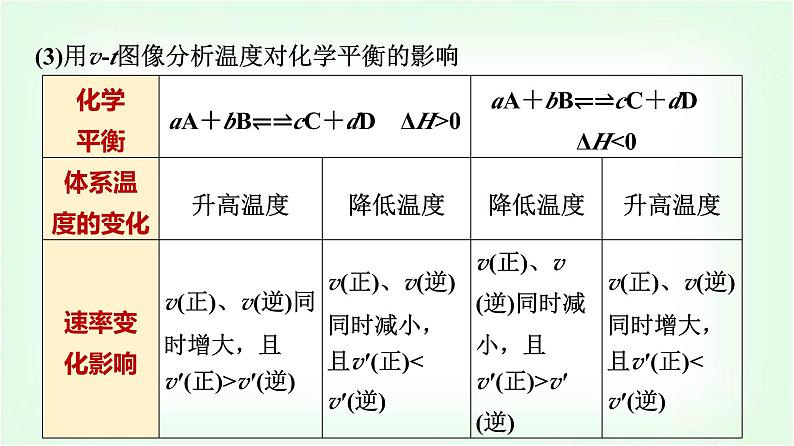
(3)用v-t图像分析温度对化学平衡的影响
2.催化剂对化学平衡的影响(1)催化剂对化学平衡的影响规律当其他条件不变时:催化剂______改变达到化学平衡状态时反应混合物的组成,但是使用催化剂____改变反应达到化学平衡所需的时间。(2)用v-t图像分析催化剂对化学平衡的影响
t1时刻,加入催化剂,v′(正)、v′(逆)同等倍数增大,则v′(正)=v′(逆),平衡不移动。
特别提醒 ①一般说的催化剂都是指的正催化剂,即可以加快反应速率。特殊情况下,也使用负催化剂,减慢反应速率。②用速率分析化学平衡移动的一般思路。
1.N2O5是一种新型硝化剂,在一定温度下可以发生以下反应:4NO2(g)+O2(g)⥫⥬2N2O5(g)。T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
回答下列问题:(1)该反应在密闭容器中达到化学平衡状态,若改变温度,此化学平衡是否一定发生移动?(2)该反应达到平衡后,若温度改变,其反应速率的变化曲线分别如下图所示:
可得出的结论是什么?(3)T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,比较K1和K2的大小?
[提示] (1)任何化学反应都伴随着能量的变化(放热或吸热)。因此,改变温度,化学平衡一定发生移动。(2)图甲表示的变化是升高温度,平衡移动方向是向逆反应方向。图乙表示的变化是降低温度,平衡移动方向是向正反应方向。正反应是放热反应,逆反应是吸热反应。(3)由(2)可知该反应的正反应为放热反应,升高温度,平衡常数减小,故K1
(2)催化剂对可逆反应的反应速率影响规律如图所示,该图还适用于什么情况下的影响?
[提示] (1)使用催化剂 未使用催化剂(2)若某可逆反应在反应前后气体的总体积不发生变化,则增大该体系的压强(压缩容器体积)时,反应速率的变化也可用题述图像表示。
1.判断正误(正确的打“√”,错误的打“×”)。(1)温度可以影响任意可逆反应的化学平衡状态。( )(2)升高温度,反应速率加快,化学平衡正向移动。( )(3)升高温度,反应速率加快,但反应物的转化率可能降低。( )(4)升高温度,化学平衡常数增大。( )(5)催化剂能加快反应速率,提高单位时间内的产量,也能提高反应物的转化率。( )
2.已知反应:2NO2(g)⥫⥬N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用弹簧夹夹住橡皮管,把A烧瓶放入热水里,把B烧瓶放入冰水里,如图所示(省略夹持装置)。与常温时烧瓶内气体的颜色进行对比,发现A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅。下列说法错误的是( )
A.把A烧瓶放入热水中,A烧瓶内正、逆反应速率均加快B.上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大C.上述过程中,A、B烧瓶内气体密度均保持不变D.2NO2(g)⥫⥬N2O4(g)的逆反应为放热反应
D [升高温度,正、逆反应速率都增大,A项正确;B烧瓶内气体颜色变浅,说明平衡向生成N2O4的方向移动,B烧瓶内c(NO2)减小,c(N2O4)增大,B项正确;容器的容积不变,混合气体的质量不变,A、B烧瓶内气体密度均保持不变,C项正确;放在热水中的A烧瓶内气体颜色变深,放在冰水中的B烧瓶内气体颜色变浅,说明升高温度平衡向生成NO2的方向移动,降低温度平衡向生成N2O4的方向移动,故2NO2(g)⥫⥬N2O4(g)的逆反应为吸热反应,D项错误。]
3.在固定容积的密闭容器中,发生反应:2X(g)+Y(s)⥫⥬Z(g)+W(g),其化学平衡常数与温度的关系如表:
对该反应而言,下列说法正确的是 ( )A.增大压强,平衡向正反应方向移动B.温度不变,增加X的量,K增大C.达到平衡后,加入催化剂,反应物转化率增大D.该反应的正反应为吸热反应
D [反应2X(g)+Y(s)⥫⥬Z(g)+W(g)中,Y为固体,则反应前后气体体积不变,增大压强平衡不移动,A错误;K只受温度的影响,和物质的量的增加没关系,即温度不变,增加X的用量,K不变,B错误;达到平衡后,加入催化剂,平衡不移动,反应物转化率不变,C错误;根据表格数据知,温度越高,该反应的K值越大,说明正反应是吸热反应,D正确。]
4.在某密闭容器中发生反应:2SO2(g)+O2(g)⥫⥬2SO3(g),反应体系在平衡状态时SO3的质量分数与温度的关系如图所示。下列说法正确的是( )
A.D点:v正
D [在D点时欲使反应达到平衡状态,同一温度下,需增大SO3的质量分数,即反应正向进行,故v正>v逆,A错误;温度越高,SO3的质量分数越小,说明平衡左移,正反应是放热反应,ΔH<0,B错误;B、C点的温度不同,则KB≠KC,C错误;恒温恒压下向平衡体系中通入氦气,使容器容积变大,相当于减小压强,平衡向左移动,D正确。]
知识点二 勒夏特列原理
1.内容如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够______这种改变的方向移动。这就是勒夏特列原理。
2.适用范围(1)勒夏特列原理仅适用于已达到平衡的反应体系,不可逆过程或未达到平衡的可逆过程均不能使用该原理。此外,勒夏特列原理对所有的动态平衡(如溶解平衡、电离平衡和水解平衡等)都适用。(2)勒夏特列原理只适用于判断“改变影响平衡的一个因素”时平衡移动的方向。若同时改变影响平衡移动的几个因素,则不能简单地根据勒夏特列原理来判断平衡移动的方向,只有在改变的因素对平衡移动的方向影响一致时,才能根据勒夏特列原理进行判断。(3)平衡移动的结果是“减弱”外界条件的影响,而不是“消除”外界条件的影响,更不是“扭转”外界条件的影响。如由T ℃升温为T ℃+10 ℃,达到新平衡时,温度的范围为T ℃~T ℃+10 ℃。
[教材·科学史话]根据大量的事实,勒夏特列于1884年提出了“平衡移动原理”。1888年他又用简洁的语言阐明了这一原理:每一种影响平衡因素的变化都会使平衡向减少这种影响的方向移动。后人为纪念勒夏特列,便把“平衡移动原理”称为“勒夏特列原理”。该原理被广泛应用于工业生产中,大大提高了生产效率。
(1)下列事实中,不能用勒夏特列原理解释的是________(填字母)。①溴水中存在如下平衡:Br2+H2O⥫⥬HBr+HBrO,当加入NaOH溶液后颜色变浅。②对2H2O2⥫⥬2H2O+O2的反应,使用MnO2可加快制O2的反应速率。③反应:CO(g)+NO2(g)⥫⥬CO2(g)+NO(g) ΔH<0,升高温度,平衡向逆反应方向移动。④合成氨反应:N2(g)+3H2(g)⥫⥬2NH3(g) ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施。⑤H2(g)+I2(g)⥫⥬2HI(g),缩小体积加压颜色加深。⑥使用催化剂可加快SO2转化为SO3的速率。
题后归纳(1)勒夏特列原理只能解决与平衡移动有关的问题。不涉及平衡移动的问题都不能用勒夏特列原理解释,常见的有:①使用催化剂不能使化学平衡发生移动。②反应前后气体体积不变的可逆反应,改变压强可以改变化学反应速率,但不能使化学平衡发生移动。③发生的化学反应本身不是可逆反应。④外界条件的改变对平衡移动的影响与生产要求不完全一致的反应。(2)平衡移动的结果只能是“减弱”外界条件的改变,但不能完全“消除”这种改变。可概括为“外变大于内变”。
D [A.该反应的正反应是气体体积减小的放热反应,在反应达到平衡后升温,化学平衡向逆反应方向移动,c(NO2)增大,因而气体的红棕色变深,能用勒夏特列原理解释,A不符合题意;B.在工业上采用N2、H2在高温、高压催化剂条件下合成氨气,该反应的正反应是气体体积减小的放热反应,合成NH3的生产过程中,为使化学平衡正向移动而提高NH3的产率,理论上应采取相对较高的压强,能用勒夏特列原理解释,B不符合题意;C.在平衡体系中加入AgNO3溶液,Ag+与溶液中的Br-反应产生AgBr沉淀,会使题述化学平衡正向移动,能用勒夏特列原理解释,C不符合题意;D.催化剂使该反应的反应速率加快,但由于对正、逆反应速率的影响相同,因此不能使化学平衡发生移动,因此不能提高SO3生产效率,故不能用勒夏特列原理解释,D符合题意。]
2.对于反应:CO2(g)+3H2(g)⥫⥬CH3OH(g)+H2O(g) ΔH<0,有利于提高平衡时CO2转化率的措施是( )A.使用催化剂B.加压C.增大CO2和H2的初始投料比D.升高温度
B [A.使用催化剂,平衡不移动,CO2的平衡转化率不变,故A错误;B.加压平衡向气体体积减小的方向移动,即平衡正向移动,CO2的平衡转化率增大,故B正确;C.增大一种反应物的浓度,可以提高另一反应物的转化率,而自身转化率是降低的,则增大CO2和H2的初始投料比,相当于H2浓度不变,增大CO2的浓度,故CO2的平衡转化率减小,故C错误;D.升高温度平衡向吸热反应方向移动,即平衡逆向移动,CO2的平衡转化率减小,故D错误。]
3.(教材互鉴:改编自鲁科版教材)已知反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0。在一定温度和压强下的密闭容器中,反应达到平衡。下列叙述错误的是( )A.升高温度,K增大B.移出部分H2O(g),c(CO2)减小C.更换高效催化剂,α(CO2)增大D.充入一定量的氮气,n(H2)不变
C [A.此反应ΔH>0,正反应为吸热反应,温度升高,平衡正向移动,K增大,故A正确;B.移出部分H2O(g),平衡向正反应方向移动,此时二氧化碳浓度会减小,故B正确;C.催化剂只能改变化学反应速率,不能使平衡发生移动,故CO2的转化率不变,故C错误;D.反应左右两边是气体体积不变的反应,充入一定量的氮气,平衡不发生移动,n(H2)不变,故D正确。]
4.一定条件下的密闭容器中:4NH3(g)+5O2(g)⥫⥬4NO(g)+6H2O(g) ΔH=-905.9 kJ·ml-1,下列叙述不正确的是( )A.通入适当过量的氧气,有利于提高NH3的转化率B.使用催化剂能缩短该反应到达平衡的时间C.平衡后降低压强,混合气体平均摩尔质量增大D.平衡后升高温度,混合气体中NO含量降低
5.现有反应:mA(g)+nB(g)⥫⥬pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的逆反应为________(填“吸热”或“放热”)反应,且m+n________(填“>”“=”或“<”)p。(2)减压使容器体积增大时,A的质量分数________(填“增大”“减小”或“不变”,下同)。
高中化学人教版 (2019)选择性必修1第二节 化学平衡示范课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002420_t3/?tag_id=26" target="_blank">第二节 化学平衡示范课ppt课件</a>,共36页。PPT课件主要包含了2特征,随堂评估·知能落实等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 化学平衡多媒体教学ppt课件: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002420_t3/?tag_id=26" target="_blank">第二节 化学平衡多媒体教学ppt课件</a>,共36页。PPT课件主要包含了逆反应,正反应,吸热反应,放热反应,应|用|体|验,勒夏特列原理,pp′2p,随堂演练·知识落实等内容,欢迎下载使用。
化学第二节 化学平衡评课课件ppt: 这是一份化学第二节 化学平衡评课课件ppt,共37页。PPT课件主要包含了目录索引等内容,欢迎下载使用。













