






高中化学人教版 (2019)选择性必修1第一节 电离平衡集体备课课件ppt
展开知识点一 电离平衡常数
1.概念在一定条件下,当弱电解质的电离达到平衡时,溶液里各组分的浓度之间存在一定的关系。对于一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的____________________,与溶液中________ __________之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,通常用Ka、Kb分别表示弱酸、弱碱的电离平衡常数。
3.电离常数的影响因素(1)内因:同一温度下,不同弱电解质的电离常数______,说明电离常数首先由弱电解质的______所决定。(2)外因:对于同一弱电解质,电离平衡常数只与______有关,由于电离为______过程,所以电离平衡常数随温度______而增大。4.意义表示弱电解质的电离能力。一定温度下,K越大,弱电解质的电离程度越____,酸(或碱)性越____。
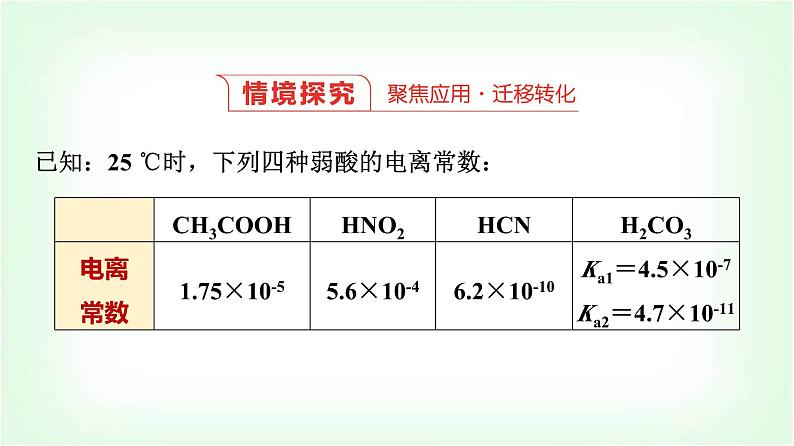
已知:25 ℃时,下列四种弱酸的电离常数:
回答下列问题:(1)25 ℃时,当向醋酸中加入一定量的盐酸时,CH3COOH的电离常数如何变化?将该溶液加水稀释10倍,则CH3COOH的电离常数如何变化?理由是什么?(2)向HNO2溶液中加入一定量的盐酸时,HNO2的电离平衡向哪个方向移动?此时HNO2的电离常数是否发生变化?为什么?
D [醋酸中存在电离平衡:CH3COOH⥫⥬CH3COO-+H+,题中Ka为醋酸的电离常数,由于电离常数只随温度的变化而变化,所以排除A、B两项;因为醋酸的电离是吸热过程,所以升高温度,Ka增大,降低温度,Ka减小,标准状况下(0 ℃)温度低于25 ℃,则Ka<1.75×10-5,所以C项不成立、D项可能成立。]
知识点二 电离常数的计算和应用
2.电离平衡常数的应用(1)根据电离平衡常数可以判断弱酸(或弱碱)的相对强弱,相同条件下,电离平衡常数越大,酸性(或碱性)越强。(2)根据电离平衡常数可以判断盐与酸(或碱)反应是否发生,相同条件下相对强的酸(或碱)可以制相对弱的酸(或碱)。(3)根据浓度商Q与电离平衡常数K的相对大小判断电离平衡的移动方向。
(2)电离度的影响因素
25 ℃时,几种弱酸的电离平衡常数如下:CH3COOH:Ka=1.75×10-5;H2CO3:Ka1=4.5×10-7,Ka2=4.7×10-11;HClO:Ka=4.0×10-8。回答下列问题:(1)0.01 ml·L-1的CH3COOH溶液和0.01 ml·L-1的HClO溶液中c(H+)分别为多少?用计算式表示。
1.已知室温时,0.1 ml·L-1某一元酸HA溶液中HA的电离度为0.1%,已知,室温时,Ka(CH3COOH)=1.7×10-5,下列叙述错误的是( ) A.该溶液中c(H+)=10-4 ml·L-1B.升高温度,溶液的pH增大C.此酸的电离平衡常数约为1×10-7D.此酸的酸性比醋酸弱
2.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
知识点三 酸性强弱的比较
1.实验探究:CH3COOH与H2CO3酸性强弱比较
2.思考与讨论:镁条与等浓度、等体积的盐酸、醋酸的反应向两个锥形瓶中各加入0.05 g镁条,盖紧橡胶塞,然后用注射器分别注入2 mL 2 ml·L-1盐酸、2 mL 2 ml·L-1醋酸溶液,测得锥形瓶内气体的压强随时间的变化如图所示:
由上述图像分析两种反应的反应速率的变化情况
3.一元强酸与一元弱酸的比较(1)相同体积、相同物质的量浓度的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
(2)相同体积、相同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
1.在相同温度时,浓度均为0.1 ml·L-1的盐酸和醋酸两种溶液相比较,下列叙述中错误的是(Ka为CH3COOH的电离平衡常数)( )A.两溶液的氢离子浓度:盐酸>醋酸B.两溶液的导电能力:盐酸>醋酸C.取1 mL上述CH3COOH溶液加水稀释后,Ka增大D.分别完全中和等物质的量的NaOH时,消耗二者的体积:盐酸=醋酸
C [盐酸为强酸,完全电离,醋酸为弱酸,不能完全电离,则0.1 ml·L-1的盐酸和0.1 ml·L-1 醋酸溶液中,氢离子浓度:盐酸>醋酸,故A正确;0.1 ml·L-1的盐酸和0.1 ml·L-1 醋酸溶液,离子浓度:盐酸>醋酸,离子浓度越大,导电能力越强,则溶液的导电能力:盐酸>醋酸,故B正确;电离平衡常数Ka只与温度有关,温度不变,平衡常数不变,故C错误;盐酸和醋酸均为一元酸,分别完全中和等物质的量的NaOH时,消耗二者的物质的量相等,由于二者浓度也相等,则消耗二者的体积:盐酸=醋酸,故D正确。]
2.在a、b两支试管中分别装入形态相同、质量相等的一颗锌粒(锌足量),然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白:(1)a、b两支试管中的现象:相同点是_______________________________,不同点是_________ _____________,原因是______________________________________。
都产生无色气泡,锌粒逐渐溶解
盐酸是强酸,醋酸是弱酸,盐酸中c(H+)大
(2)a、b两支试管中生成气体的体积开始时是V(a)________(填“大于”“小于”或“等于”,下同)V(b),反应完毕后生成气体的总体积是V(a)________V(b),原因是___________________________________________________________________________________。(3)若a、b两支试管中分别加入c(H+)相同、体积相同的稀盐酸和稀醋酸,则a、b两支试管中开始生成气体的速率v(a)________v(b),反应完毕后生成气体的总体积是V(a)________V(b),原因是________________________________________________________________________________。
反应开始时,盐酸中所含H+的浓度较
大,但二者最终能电离出的H+的总物质的量相等
c(H+)相同,所以速率相等,醋酸是弱电解质,最终电离出的H+的总物质的量大
[解析] (2)锌粒与酸反应的实质是Zn与酸电离出的H+发生置换反应产生H2,c(H+)越大,产生H2的速率越大。盐酸是强酸,醋酸是弱酸,在起始物质的量浓度相同时,盐酸电离出的c(H+)远大于醋酸电离出的c(H+)。所以反应开始时,醋酸产生H2的速率比盐酸小。因醋酸存在电离平衡CH3COOH⥫⥬CH3COO-+H+,Zn与H+发生反应,c(H+)减小,使醋酸的电离平衡向电离方向移动,继续发生H+与Zn的反应,足量的Zn可使醋酸中的H+全部电离出来与Zn反应生成H2,又因为n(HCl)=n(CH3COOH),因而最终产生H2的量相等。
2.(教材互鉴:改编自苏教版教材)相同温度下,根据三种酸的电离常数,下列判断正确的是( )
3.相同体积、相同c(H+)的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于产生氢气的体积(V)随时间(t)变化的示意图正确的是( )
A B C D
C [相同体积、相同c(H+)的一元强酸溶液和一元弱酸溶液,刚开始与锌粉反应的速率是相同的,随着反应进行,弱酸能继续电离出H+,故其反应速率比强酸的大,排除B、D项;弱酸的物质的量浓度大于强酸的,所以弱酸与足量的锌粉反应生成氢气的量较多,排除A项。]
4.弱酸、弱碱的电离程度可以分别用它们的电离常数(Ka、Kb)或电离度(α)表示,请根据下列情景列式计算。(1)乙酰水杨酸是一种一元弱酸(可用HA表示),在一定温度下,0.1 ml·L-1的乙酰水杨酸的水溶液中,乙酰水杨酸的电离常数Ka为3.4×10-4,求该酸的电离度为________。(2)已知在25 ℃时,1 ml·L-1氨水中NH3·H2O的电离度为0.42%,求NH3·H2O的电离常数Kb=___________。
高中化学第二节 化学平衡课文ppt课件: 这是一份高中化学<a href="/hx/tb_c4002420_t3/?tag_id=26" target="_blank">第二节 化学平衡课文ppt课件</a>,共50页。PPT课件主要包含了浓度商,反应的限度,不完全,K105,主要因素,正反应方向,平衡状态,逆反应方向,ΔH1+ΔH2,K1·K2等内容,欢迎下载使用。
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡说课ppt课件: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002426_t3/?tag_id=26" target="_blank">第三章 水溶液中的离子反应与平衡第一节 电离平衡说课ppt课件</a>,共51页。PPT课件主要包含了电离平衡常数,各种离子浓度的乘积,未电离分子的浓度,电离常数只与温度,75×10-5,电离程度,强酸与弱酸的比较,随堂演练·知识落实等内容,欢迎下载使用。
选择性必修1第一节 电离平衡评课ppt课件: 这是一份选择性必修1第一节 电离平衡评课ppt课件,共48页。PPT课件主要包含了目录索引等内容,欢迎下载使用。













