





所属成套资源:全套人教版高中化学选择性必修1课时教学课件
人教版 (2019)选择性必修1第二节 电解池课文内容课件ppt
展开
这是一份人教版 (2019)选择性必修1第二节 电解池课文内容课件ppt,共46页。PPT课件主要包含了②根据“盐桥”判断,NaOH,Ag2O,考点三二次电池等内容,欢迎下载使用。
考点一 隔膜在电化学中的应用
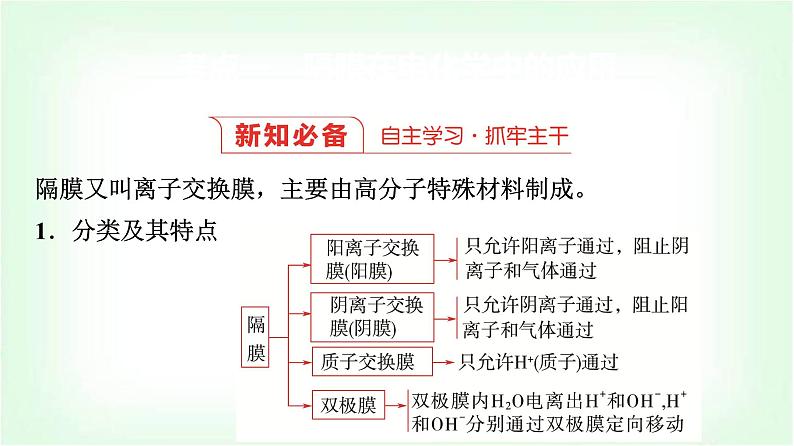
隔膜又叫离子交换膜,主要由高分子特殊材料制成。1.分类及其特点
特别提醒 ①阳离子通过阳离子交换膜移向原电池的正极或电解池的阴极。②阴离子通过阴离子交换膜移向原电池的负极或电解池的阳极。③通过交换膜的离子带的电荷数等于外电路转移的电子数。
2.应用(1)用于物质的制备:通过隔膜在阴、阳极区分别制备特定物质。(2)物质的分离与提纯。(3)海水的淡化。3.隔膜的作用(1)能将两极区隔离,阻止两极区产生的物质接触,防止发生化学反应。(2)能选择性地通过离子,起到平衡电荷、形成闭合回路的作用。
4.离子交换膜类型的判断方法根据电解质溶液呈电中性的原则和实验目的,判断膜的类型,判断时首先写出阴、阳两极上的电极反应,依据电极反应式确定该电极附近哪种离子剩余,因该电极附近溶液呈电中性,从而判断出离子移动的方向,进而确定离子交换膜的类型,如电解饱和食盐水时,阴极反应式为2H++2e-===H2↑,则阴极区域破坏水的电离平衡,OH-有剩余,阳极区域的Na+穿过离子交换膜进入阴极室,形成NaOH溶液,故电解饱和食盐水中的离子交换膜是阳离子交换膜。
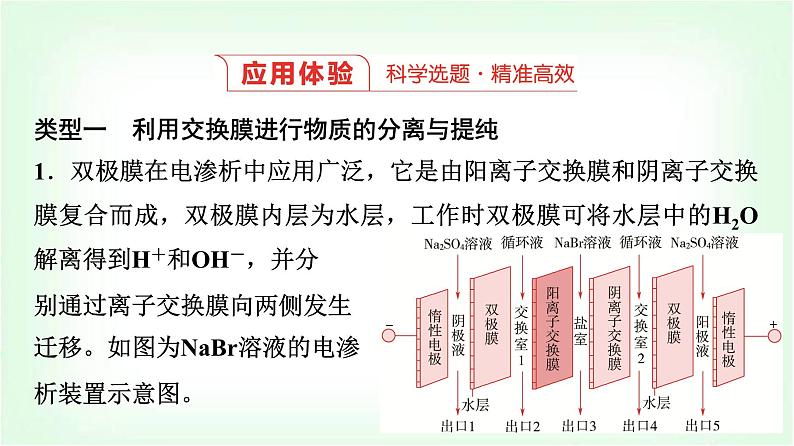
类型一 利用交换膜进行物质的分离与提纯1.双极膜在电渗析中应用广泛,它是由阳离子交换膜和阴离子交换膜复合而成,双极膜内层为水层,工作时双极膜可将水层中的H2O解离得到H+和OH-,并分别通过离子交换膜向两侧发生迁移。如图为NaBr溶液的电渗析装置示意图。
下列说法不正确的是( )A.出口1的物质为硫酸钠溶液B.Br-可从盐室最终进入阳极液中C.出口2的物质为NaOH溶液D.阳极电极反应式为2H2O-4e-===O2↑+4H+
类型二 利用交换膜进行物质的制备2.可利用三室式电解法电解Na2SO4溶液制备硫酸溶液、NaOH溶液、H2和O2,原理如图所示。下列说法不正确的是( )
A.可向阴极区加入稀NaOH溶液增强导电性B.a可使用阳离子交换膜C.电解时阴极区发生还原反应D.电解时阳极区反应式为2H++2e-===H2↑
A.阳极室溶液由无色变成棕黄色B.阴极的电极反应式为4OH--4e-===2H2O+O2↑C.电解一段时间后,阴极室溶液的pH升高D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
考点二 串联电解池的分析
1.分类判断(1)有外接电源的电解池串联
(2)原电池为电源的电解池串联①根据电极材料和电解液判断
⇒甲为原电池,乙为电解池
⇒甲为电解池,乙、丙构成原电池
2.“串联”类电池的解题流程
类型一 有外接电源的电解池串联1.在实验室用如图所示装置以惰性电极进行电解实验,闭合电键一段时间后,e电极上有固体析出。下列说法不正确的是( )
类型二 原电池为电源的电解池串联2.如图是一个化学过程的示意图,回答下列问题:
(2)一段时间,当乙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=_____(已知NaCl溶液足量,假定生成的氯气完全逸出,且电解后溶液体积为200 mL)。(3)若要使乙池恢复电解前的状态,应向乙池中加入________(写化学式)。
(1)甲池中通入C3H8的电极反应式为____________________________ ________________,丙池中D极的产物是______________(写化学式)。
1.新型二次电池电极的确定思路(1)根据总反应中物质元素的化合价变化确定两极反应物,进而确定两极。(2)根据两极物质的变化以及化合价升降确定得失电子,进而确定两极。(3)根据反应类型确定两极。(4)根据电子或电流流向或阴、阳离子移向确定两极。
特别提醒 二次电池的放电与充电的反应方向相反,放电时电池负极反应与充电时的阴极(外接负极)反应方向相反。
类型一 锂离子电池1.Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电Li-O2电池(如图所示)。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li+ +e-===Li)和阳极反应(Li2O2+2h+===2Li++O2↑)对电池进行充电。下列叙述错误的是( )
A.充电时,Li+从阴极穿过离子交换膜向阳极迁移B.放电时,正极发生反应:O2+2Li++2e-===Li2O2C.左槽和右槽只能使用非水电解质 D.该蓄电池可实现如下能量转化:光能→电能→化学能→电能
A [A.充电时,Li+向阴极迁移,A错误;B.放电时总反应为2Li+O2===Li2O2,正极反应为O2+2Li++2e-===Li2O2,B正确;C.电池中有活泼碱金属锂参与反应,只能使用非水电解质,C正确;D.蓄电池先由光催化产生电能,电解Li2O2,将电能转化为化学能,然后Li与O2反应放电又将化学能转化为电能,实现如下能量转化:光能→电能→化学能→电能,D正确。 ]
2.某汽车配置磷酸铁锂“刀片电池”,进而解决磷酸铁锂电池能量密度低的问题。“刀片电池”放电时的总反应:LixC6+Li1-x FePO4===6C+LiFePO4,工作原理如图所示。下列说法错误的是( )
A.放电时,负极反应为LixC6-xe-===xLi++6CB.用充电桩给汽车电池充电的过程中,阴极质量增加C.充电时的铝箔与电源正极相连D.放电时,电子由铜箔通过隔膜流向铝箔,Li+移向正极,使正极质量增加
D [A.放电时,负极LixC6失去电子生成锂离子,电极反应为LixC6-xe-===xLi++6C,A正确;B.电池充电过程中,铜箔为阴极,锂离子得到电子发生还原反应,电极反应为xLi++6C+xe-===LixC6,阴极质量增加,B正确;C.充电时,铝箔为阳极,与电源正极相连,C正确;D.放电时,电子不能通过有机溶液,D错误。]
类型二 钠离子电池3.钠离子电池被认为是极具潜力的下一代电化学储能技术,与锂离子电池有类似的工作原理,其工作原理示意如图所示,放电时电池总反应为Na1-xTMO2+NaxC===C+NaTMO2,TM代表过渡金属,下列说法不正确的是( )
A.放电时,含硬碳的铜箔或铝箔一极为负极B.充电时,阴极发生的反应为C+xNa++xe-===NaxCC.放电时,若电路中转移1 ml电子,则有1 ml Na+生成D.与钠资源相比,锂储量更丰富且分布广泛
D [由图可知,放电时,含硬碳的铜箔或铝箔为原电池的负极,NaxC在负极失去电子发生氧化反应生成碳和钠离子,含钠过渡金属氧化物的铝箔为正极,Na1-xTMO2在正极得到电子发生还原反应生成NaTMO2;充电时,与直流电源负极相连的含硬碳的铜箔或铝箔为阴极,含钠过渡金属氧化物的铝箔为阳极。
A.放电时,含硬碳的铜箔或铝箔为原电池的负极,故A正确;B.充电时,与直流电源负极相连的含硬碳的铜箔或铝箔为阴极,碳作用下钠离子在阴极得到电子发生还原反应生成NaxC,电极反应为C+xNa++xe-===NaxC,故B正确;C.放电时,含硬碳的铜箔或铝箔为原电池的负极,NaxC在负极失去电子发生氧化反应生成碳和钠离子,电极反应为NaxC-xe-===C+xNa+,则电路中转移1 ml电子,负极有1 ml钠离子生成,故C正确;D.与锂资源相比,地球上钠资源的储量更丰富且分布广泛,故D错误。]
类型三 离子隔膜电池5.我国科学家发明了一种Zn-PbO2二次电池,装置如图所示,X、Z区域电解质溶液不同,分别为H2SO4溶液和KOH溶液中的一种。下列说法错误的是( )
A.Z区域电解质溶液为H2SO4溶液B.充电时,Y区域K2SO4溶液浓度减小,N为阴离子交换膜C.放电时,Zn电极反应为Zn+4OH--2e-===[Zn(OH)4]2-D.放电时,Z区域pH降低
6.一种大型贮液蓄电站的工作原理示意图如图所示,下列叙述正确的是( )
7.科学家近日发明了一种无污染、无需净化高效产氢的可充电电池,电池工作原理示意图如图所示。电极为金属锌和选择性催化材料,实现了阴极析氢和N2H4氧化两个独立的反应,可稳定循环600次。下列说法错误的是( )
A.充电时,阴极区溶液pH增大B.放电时,OH-由b极区向a极区迁移C.充电时,b极反应式为N2H4+4OH--4e-===N2↑+4H2OD.产生1 ml H2,a极质量增大65 g
相关课件
这是一份人教版 (2019)选择性必修1第四节 沉淀溶解平衡课前预习ppt课件,共31页。PPT课件主要包含了考点一曲线型图像,考点二对数型图像等内容,欢迎下载使用。
这是一份高中人教版 (2019)第二节 电解池背景图课件ppt,共43页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 电解池教案配套课件ppt,共31页。PPT课件主要包含了目录索引等内容,欢迎下载使用。










