




高中化学第二节 电解池课文内容课件ppt
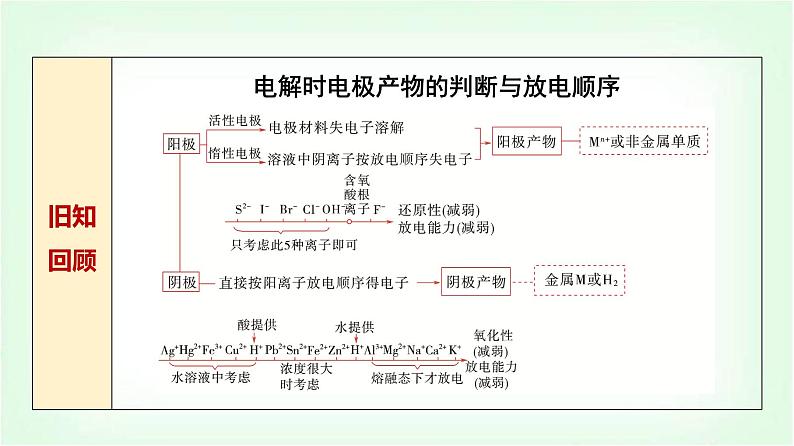
展开知识点一 电解饱和食盐水
1.氯碱工业:烧碱、氯气都是重要的化工原料,习惯上把电解饱和食盐水的工业生产叫做__________。2.电解饱和食盐水原理(1)通电前,氯化钠饱和溶液中含有的离子是____________________ ______。通电时,移向阳极的离子是____________,移向阴极的离子是___________。
Na+、Cl-、H+、
(2)阳极反应式为________________________;阴极反应式为_____________________________。(3)电解的总反应式化学方程式为__________________________________________;离子方程式为__________________________________________。
2Cl--2e-===Cl2↑
2H2O+2e-===H2↑+2OH-
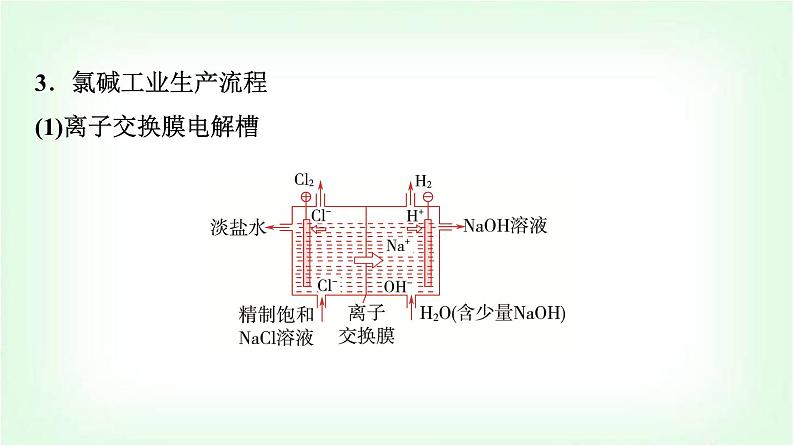
3.氯碱工业生产流程(1)离子交换膜电解槽
(2)离子交换膜的作用:只允许Na+等阳离子通过,不允许Cl-、OH-等阴离子及气体分子通过,可以防止阴极产生的氢气与阳极产生的氯气混合发生爆炸,也能避免氯气与阴极产生的氢氧化钠溶液反应而影响氢氧化钠溶液的产量和质量。
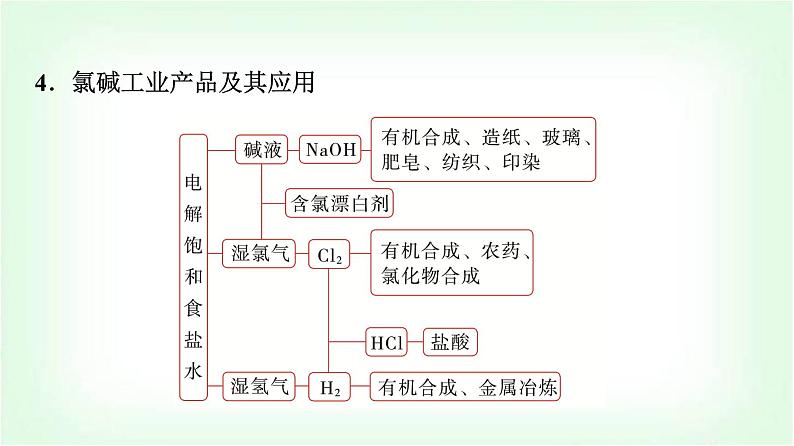
4.氯碱工业产品及其应用
“84”消毒液是环境消毒液之一。某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置。该装置中c、d都为石墨电极。
完成下列填空:(1)a为电源的________(填“正”“负”“阴”或“阳”,下同)极,c为电解池的________极。(2)d电极的电极反应式:_________________________________,电解产生消毒液的总化学方程式为______________________________ _________________________________________________________。
1.判断正误(正确的打“√”,错误的打“×”)。(1)电解饱和NaCl溶液可以制取金属钠。( )(2)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e-===Cl2↑。( )(3)氯碱工业电解槽中滴入酚酞溶液,变红色的区域为阳极区。( )(4)电解饱和食盐水时,阳极和阴极都可以选择金属材料(如铁)作电极。( )
2.如图为阳离子交换膜法电解饱和食盐水的原理示意图(所用电极均为惰性电极)。下列说法不正确的是( )
A.从E口逸出的气体是H2B.从B口加入含少量NaOH的水溶液以增强导电性C.标准状况下每生成22.4 L Cl2,便产生2 ml NaOHD.通电一段时间后加适量NaCl可以使电解液恢复到通电前的浓度
题后归纳 离子交换膜是“具有选择透过性能的网状立体结构的高分子功能膜或分离膜”,常运用于膜电解和电渗析等离子交换膜法技术中。它具有选择透过性、分离效率高、能耗低、污染少等特点,在水处理、环保、化工、冶金等领域都有广泛应用。离子交换膜的种类有阳离子交换膜、阴离子交换膜、质子交换膜等。离子交换膜的作用:①隔离某些物质,防止阴极与阳极产物之间或产物与电解质溶液发生反应;②用于制备某些物质:通过离子定向移动使得阴极区或阳极区得到所制备的新物质;③对物质进行分离、提纯等。
知识点二 电镀 电冶金 电有机合成
1.电镀(1)电镀:利用______原理在某些金属表面镀上一薄层其他______或______的加工工艺。(2)目的:使金属增强抗腐蚀能力,增加表面硬度和美观。
(3)电镀池的构成(在铁制钥匙上面镀铜):阳极材料:镀层金属:____,电极反应:_____________________;阴极材料:镀件:__________,电极反应:_____________________。电解质溶液:Cu2+浓度__________。
Cu-2e-===Cu2+
Cu2++2e-===Cu
2.电解精炼(粗铜含锌、银、金等杂质)
阳极材料:______,电极反应:Zn-2e-===Zn2+、Cu-2e-===Cu2+;阴极材料:______,电极反应:Cu2++2e-===Cu;电解质溶液:Cu2+浓度______,金、银等金属沉积形成阳极泥。
Na++e-===Na
特别提醒 工业生产金属镁和金属铝均采用电解法,制取Mg时电解的是熔融的MgCl2,而制取Al时电解的却是熔融的氧化铝,不是AlCl3,这是因为MgCl2是离子化合物,在熔融状态时导电,而AlCl3是共价化合物,在熔融状态下不导电,故电解制取金属铝用的是熔融的氧化铝。
A.电解熔融氢氧化钠制取金属钠,阳极发生的电极反应为2OH--2e-===H2↑+O2↑B.盖·吕萨克制钠的原理是利用铁的还原性比钠强C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数不同D.目前工业上常用电解熔融氯化钠法制取金属钠,电解槽中石墨为阴极,铁为阳极
2.若要在铜片上镀银,则下列叙述中错误的是( )①将铜片接在电源的正极上 ②将银片接在电源的正极上 ③在铜片上发生的反应是Ag++e-===Ag ④在银片上发生的反应是2H2O-4e-===O2↑+4H+ ⑤可用CuSO4溶液作电解质溶液 ⑥可用AgNO3溶液作电解质溶液A.①③⑥ B.②③⑥C.①④⑤D.②③④⑥
C [根据电镀原理,若在铜片上镀银,则铜作电解池的阴极与电源负极相连,电解质溶液中的银离子得到电子发生还原反应生成银;银作电解池的阳极,和电源正极相连,银失电子发生氧化反应生成银离子;电解质溶液为硝酸银溶液。铜片应接在电源的负极上,故①错误;银片应接在电源的正极上,故②正确;铜片上发生的反应是Ag++e-===Ag,故③正确;银片上发生的反应是Ag-e-===Ag+,故④错误;用硫酸铜溶液作电解质溶液,阴极析出铜,故⑤错误;应用硝酸银溶液作电解质溶液,故⑥正确。]
3.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,思考回答下列问题:(1)阳极发生________反应,其电极反应式:_______________、 _________________、 _________________、 。(2)电解过程中,阳极质量的减少与阴极质量的增加________(填“相等”或“不相等”)。(3)电解后,溶液中存在的金属阳离子有_____________、Ni2+等。(4)电解后,电解槽底部含有___________(填元素符号)等金属。
Ni-2e-===Ni2+
Fe-2e-===Fe2+
Zn-2e-===Zn2+
[解析] (2)电解过程中阳极失电子的有Fe、Zn、Ni,阴极析出的是镍,依据得失电子守恒,阳极质量的减少与阴极质量的增加不相等。(4)粗镍作阳极,Fe、Zn在电极上失去电子形成阳离子进入溶液中,但Cu和Pt沉到电解槽底部。
(1)电极X为________(填“阴”或“阳”)极。(2)写出ⅰ的电极反应式:__________ _________________________________。
CHCN+2H++2e-===NC(CH2)4CN
[解析] (1)电解池中阳离子向阴极移动,根据题图并结合总反应可知,电极X为阳极,反应为水失去电子发生氧化反应生成氧气和氢离子;(2)结合(1)分析可知,Y为阴极,丙烯腈得到电子发生还原反应生成己二腈,反应为2CH2===CHCN+2H++2e-===NC(CH2)4CN。
知识点三 电解的有关计算
1.常见考查方向无论是电解单一电解质溶液,还是混合溶液,一般考查电解后电极产物的质量、气体体积、溶液的pH或物质的量浓度等。2.三个计算原则(1)阳极失去的电子数等于阴极得到的电子数。(2)串联电路中通过各电极的电子总数相等。(3)电源输出的电子总数和电解池中转移的电子总数相等。
2.如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答下列问题:
(1)电源中X极是_____ (填“正”或“负”)极。(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前c(CuSO4)=______________。(3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解后溶液的pH=______(Kw=1.0×10-14)。
0.025 ml·L-1
1.下列关于氯碱工业中电解NaCl饱和溶液的叙述正确的是( )A.两极都可用铁作电极B.电解时在阳极得到氯气,在阴极得到金属钠C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色D.阳极生成的气体能使湿润的KI-淀粉试纸变蓝
2.餐具表面镀银可达到增强抗腐蚀性、提升美观度等目的。下列关于铁表面镀银的说法不正确的是( )A.电路中每通过1 ml e-,阴极析出1 ml 银B.铁电极应与电源负极相连C.阳极电极反应式为Ag-e-===Ag+D.电镀液需要不断更换
D [在铁表面镀银,阴极发生反应:Ag++e-===Ag,故电路中每通过1 ml e-析出1 ml银,故A正确;铁为镀件,应与电源负极相连,故B正确;阳极为镀层金属,电极反应式为Ag-e-===Ag+,故C正确;电镀液浓度不变,不需要更换,故D错误。]
A.b为电源的负极B.阳极的电极反应为Mn2+-e-===Mn3+C.电解刚刚开始时,观察到阴极石墨棒上有无色气体产生:2H++2e-===H2↑D.电解过程中,混合溶液中H+的物质的量浓度将减小
4.电动汽车的迅速发展带来废旧电池回收利用的难题。通过电解废旧锂电池中的LiMn2O4可获得难溶性的MnO2和可溶性的锂盐,工作原理如图(固体颗粒不能透过玻璃纤维,电解过程中溶液的体积变化忽略不计)。下列说法错误的是( )
A.电极甲为阳极,发生氧化反应B.电极乙的电极反应:LiMn2O4+8H++3e-===Li++2Mn2++4H2OC.电解过程中Mn2+浓度增大D.电解一段时间后溶液中pH保持不变
5.火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电器工业的要求,工业上常使用电解精炼法将粗铜提纯。利用电解法可将含有Fe、Zn、Ag、Au等杂质的粗铜提纯,回答下列问题:(1)电解时粗铜作_____极,连接电源的______极,电极反应为_______________________________________________________;纯铜作_____极,电极反应为________________________。
Cu-2e-===Cu2+,Fe-2e-===Fe2+,Zn-2e-===Zn2+
Cu2++2e-===Cu
(2)电解质溶液应选择________(填字母)。A.CuCl2溶液B.CuSO4溶液C.ZnSO4溶液(3)电解后,电解槽底部会形成含少量________等金属的阳极泥。(4)若纯铜片增重6.4 g,则电路通过的电子为______ml。
高中人教版 (2019)第二节 电解池背景图课件ppt: 这是一份高中人教版 (2019)第二节 电解池背景图课件ppt,共43页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池教学课件ppt,共44页。PPT课件主要包含了课前·新知导学,抗腐蚀,CuSO4溶液,阳极泥,获得电子,活泼金属,课堂·重难探究,重难突破,典例精练,2计算的方法等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第二单元 化学能与电能的转化备课ppt课件: 这是一份苏教版 (2019)选择性必修1第二单元 化学能与电能的转化备课ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3,点击右图进入等内容,欢迎下载使用。













